可注射水凝胶在微创注射到人体后能够原位形成固体凝胶,并能充分填充不规则的目标空间,因其在组织工程支架和局部药物释放载体等生物医学应用领域的突出优势和巨大潜力而日益受到关注。迄今为止,人们利用化学反应和物理相互作用两种策略实现其溶胶-凝胶转变,即在注射到目标空间后形成三维网状结构。通过这两种策略制备的可注射分子水凝胶(IMHs)各有优势,但其固有的局限性也令人沮丧。例如,与点击反应、迈克尔加成反应、席夫碱反应、酶介导反应和光交联反应等化学反应相关的 IMHs 通常生物相容性较差,原因在于其分子链中存在反应基团、反应剂(如交联剂、(光)引发剂或催化剂)或产生的中间体(如自由基),这些中间体可能与细胞生物大分子的活性基团发生反应。
来自东华大学的查刘生和Xiaoyun Liu团队和来自上海交通大学的Xiaolong Zha 团队合作通过缩短和分散在 pH 值为 7.4 的磷酸盐缓冲溶液中、能在体温下自卷曲的 Janus 纤维,制成了一种可注射的仿 ECM 水凝胶(IEMH)。纤维含量仅为 5 wt%的 IEMHs 可在体温下发生溶胶-凝胶转变,成为具有理想稳定性、坚固性、弹性和自愈能力的固体凝胶。此外,它们还具有显著的假塑性,有利于在室温下进行注射。扫描电子显微镜、全内反射荧光显微镜、核磁共振和傅立叶变换红外光谱仪的研究结果表明,它们在生理条件下的凝胶转变源于热引起的自卷曲纤维之间的紧密缠结和纤维之间的疏水相互作用的协同作用。利用 C2C12 成肌细胞进行了 MTT 试验,以检验 IEMH 在生物医学应用中的体外细胞毒性。相关工作以题为“Injectable Extracellular Matrix-mimetic Hydrogel Based on Electrospun Janus Fibers”的文章发表在2024年1月31日的国际知名期刊《Materials Horizons》。
1. 创新型研究内容
本研究开发了一种新型可注射水凝胶,即可注射仿 ECM 水凝胶(IEMH),它由缩短的电纺 Janus 纤维组成,能够在体温下自卷曲。扫描电子显微镜(SEM)和全内反射荧光显微镜(TIRFM)观察、流变学测量、傅立叶变换红外光谱(FTIR)和核磁共振(NMR)表征证实了这一点。采用热响应聚(N-异丙基丙烯酰胺-4-丙烯酰二苯甲酮)(PNA)和甲基丙烯酸缩水甘油酯(GMA)改性聚(乙烯醇)(MPVA)作为纺丝聚合物,结合紫外线(UV)辐照,通过并排(s-b-s)电纺丝工艺可大规模制备 Janus 纤维。在不使用任何有机溶剂或活性化学品的情况下,通过匀浆器将 Janus 纤维缩短并分散在 pH 值为 7.4 的磷酸盐缓冲溶液(PBS)中,从而制造出 IEMH。这种新型可注射水凝胶具有显著的假塑性,有利于在室温下注射,并在体温下快速凝胶化。其凝胶产物的纤维结构类似于 ECM,在生理条件下具有理想的稳定性、坚固性、弹性和自愈能力。这些独特的特性使我们开发的 IEMH 非常适合生物医学应用,如组织工程支架。
【体温自卷曲Janus纤维的制备及表征】
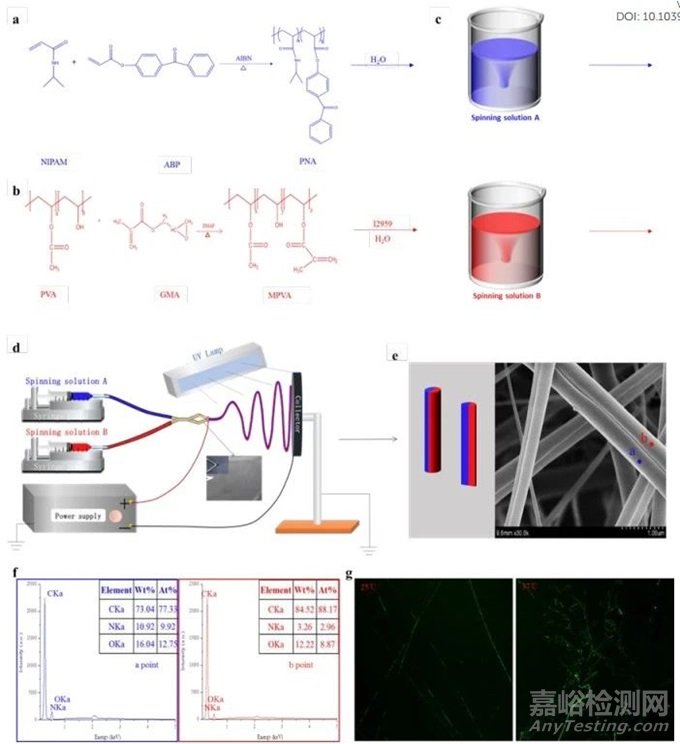
如图 1 所示,通过 s-b-s 电纺丝工艺并结合紫外线照射,制备出了能够在体温下自卷曲的 Janus 纤维。首先,通过 Nisopropylacrylamide(NIPAM)和 4-acryloylbenzophenone (ABP)的自由基共聚合成了热响应聚(N-异丙基丙烯酰胺-4-丙烯酰二苯甲酮)(PNA),如图 1a 所示。另一种纺丝聚合物是用甲基丙烯酸缩水甘油酯(GMA)和二甲氨基吡啶(DMAP)作为催化剂对聚(乙烯 醇)(PVA)进行改性而制备的(见图 1b),简称 MPVA。用于 TIRF 和 CLSM 表征 Janus 纤维的荧光 MPVA(FMPVA)是通过酯化作用在 MPVA 侧链中引入过烯成分制备的。凝胶渗透色谱法(GPC)测定的共聚物的数均分子量为 8.97ⅹ104。通过 UVvis 测定,其临界溶解温度(LCST)为 29.2 ℃,低于通过 NIPAM 自由基聚合合成的聚异丙基丙烯酰胺(PNIPAM)均聚物的临界溶解温度(32 ℃),这是因为引入了疏水性 ABP 成分。此外,在纺丝溶液 B 中加入 1.0 wt% 的 I 2959 至 MPVA(图 1c)。最后,使用这两种纺丝溶液进行 s-b-s 电纺丝,然后用紫外线照射纺成的 PNA/MPVA Janus 纤维,如图 1d 所示。用于 TIRF 和 CLSM 表征的 PNA/FMPVA Janus 纤维是通过相同的工艺制作的。
图1 通过 s-b-s 电纺丝工艺制备 PNA/MPVA Janus 纤维的示意图和表征结果
【可注射ECM模拟水凝胶的制备和可注射性】
本研究将 PNA/MPVA Janus 纤维缩短并用匀浆器分散在 pH 7.4 的 PBS 中,制备可注射的仿 ECM 水凝胶(IEMH)。通过改变匀浆时间来控制 IEMH 中缩短纤维的平均长度。根据相同的匀浆时间(3 分钟)制备了一系列不同纤维浓度(3 wt%、5 wt% 和 7 wt%)的 IEMH,分别命名为 IEMH-3b、IEMH-5b 和 IEMH-7b。此外,还根据不同的均质时间(1.5 分钟、3 分钟和 6 分钟)制备了一系列含有不同平均长度纤维的 5 wt% IEMH,分别命名为 IEMH5a、IEMH-5b 和 IEMH-5c。根据它们的多幅 SEM 图像(典型图像见图 2a),使用 ImageJ 软件测量了 50 根纤维的长度,从而统计出它们缩短纤维的平均长度。IEMH-5a、IEMH-5b 和 IEMH-5c 的数值及标准偏差分别为 109±19μm、68±11 μm 和 40±6 μm,随着均质时间的延长而减小。如图 2a 插入图所示,IEMH 通常呈半透明乳液状,至少在 6 个月内外观不会发生任何变化,这意味着它们具有理想的分散稳定性。它们的含水量超过 90 wt%,明显高于已报道的 IMH,1-3,26。图 2b 给出了所有 IEMH 在 25℃ 时的表观粘度(ηa )与剪切速率的函数关系。除 IEMH-7b 外,当剪切速率超过 100 s-1 时,其他 IEMH 的 ηa 均低于 0.05 Pa.s。此外,在 25 ℃ 下,所有 IEMH 的 ηa 都随着剪切速率的增加而减小,这表明它们在环境温度下具有假塑性。这些特性使其易于通过注射器进行注射应用,且能耗极低。为了阐明 IEMH 中缩短纤维的浓度和平均长度对其假塑性的影响,本研究使用流变学模型 Ostwald de-Waele 幂定律来拟合图 2b 中从 0.1 s-1 到 300 s-1 的流动曲线,以确定其流动行为指数(n)。IEMH 的 n 值随着其浓度或缩短纤维平均长度的增加而降低,这意味着其假塑性增强。这种行为可能与 IEMH 中缩短纤维之间的一些不紧密缠结有关,这些缠结在剪切力的作用下很容易解开。使用 TRIFM 观察了不同浓度的缩短 PNA/FMPVA Janus 纤维的类似物,证明了这一推测。纤维的浓度越高,它们之间的不紧密缠结就越多。可以推测,缠结会随着纤维平均长度的增加而增强。通过实际注射效果进一步评估了 IEMHs 的可注射性。如图 2b 两个插片中的一个所示,由于 IEMH-5b 具有上述低粘度和显著的假塑性,用手就能轻松、顺畅地将其从 25G 注射器针头(内径 260 微米)中挤出。相比之下,以前报道的 IMH 通常使用较粗的注射器针头,如 18G(内径 840 微米)和 22G(内径 410 微米)。

图2 IEMH的制备及注射性
【生理条件下 IEMH 的溶胶-凝胶转变行为】
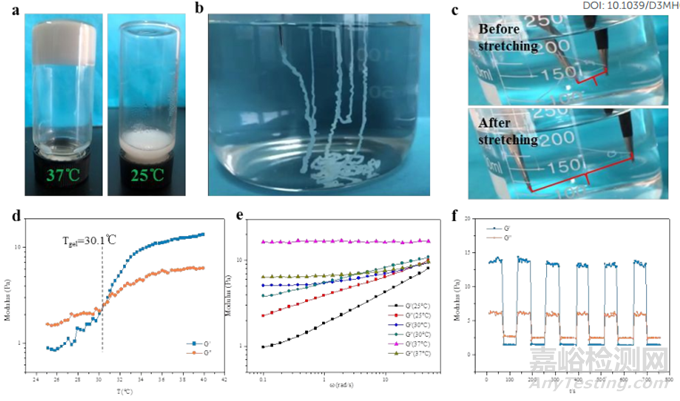
可注射水凝胶的溶胶-凝胶转变行为及其转变后的特性,尤其是在生理条件下的特性,对其生物医学应用至关重要。本研究制备的 IEMHs 在生理条件下的溶胶-凝胶转变行为首先是通过小瓶倒置试验直观观察到的,如图 3a所示。如上所述,在 25℃时,IEMH-5b 是一种自由流动的粘性液体(溶胶)。当温度升高到 37 ℃ 时,它变成了能够保持重量的固态凝胶,当温度降回 25 ℃ 时又恢复到初始液态。这一现象表明,IEMH 可以随着 25 ℃ 至 37 ℃ 之间的温度变化发生可逆的溶胶-凝胶转变。此外,与 IEMH-5b 浓度相同的 IEMH-5a 表现与 IEMH-5b 相似,而浓度相同的 IEMH-5c 也能发生溶胶-凝胶转变,但形成的凝胶太弱,无法在倒置的小瓶中保持重量。然而,较低浓度的 IEMH-3b 无法发生溶胶-凝胶转变,而较高浓度的 IEMH-7b 则不能完全从 37 ℃ 时的凝胶状态恢复到 25 ℃ 时的初始液态。这些现象表明,IEMH 的溶胶-凝胶转变与其说取决于其组成纤维的长度,不如说取决于其浓度。根据这些样品以及更多样品的小瓶反转测试结果,得到了以纤维长度和浓度为变量的 IEMHs 溶胶凝胶相图。从相图中可以估算出不同纤维长度下纤维浓度的临界值。
如图 3b所示,本研究将 IEMHs 在室温下通过 25G 的针头注射到 37 ℃ 的 pH 7.4 PBS 浴中,进一步评估了 IEMHs 在生理条件下的溶胶-凝胶转变行为及其转变后的特性。它们瞬间失去流动性,形成稳定的纤维状水凝胶,表明它们的溶胶-凝胶转变迅速发生。这一特点有利于防止它们在注入人体目标部位后流向不需要的部位。如图 3c所示,将形成的纤维状水凝胶在 pH 值为 7.4 的 PBS 中于 37 ℃ 下拉伸,即使拉伸到初始长度的 300% 左右,它仍能保持其完整性。这一结果表明,IEMHs 溶胶-凝胶转变后生成的纤维状水凝胶具有理想的弹性和坚固性。
图3 IEMH 在生理条件下的溶胶-凝胶转变行为及其转变后的特性
【生理条件下IEMHs的溶胶-凝胶转变机制】
为了深入研究所制备的IEMH在生理条件下的溶胶-凝胶转变机理,首先采用与IEMH-5b相同的配方和工艺,使用单轴电纺丝和紫外固化的MPVA或PNA纤维或它们1:1质量比的混合物制备了三个IEMH-5b的对照样品,分别简称为IEMH-m、IEMH-p和IEMH-mp。虽然这些样品中纤维的平均长度和浓度与 IEMH-5b 相同,但只有 IEMH-p 与之表现相似,能在生理条件下发生溶胶-凝胶转变,这一点已通过小瓶倒转测试结果得到证实。这是由于 IEMH-p 中的 PNA 纤维在高于 PNA LCST 的 37 ℃ 时变得疏水,因此它们之间的疏水作用导致了样品的溶胶-凝胶转变,这在我们之前的出版物中已有讨论。虽然 IEMH-mp 也含有 PNA 纤维,但其浓度仅为 2.5 wt%。此外,2.5 wt% 亲水性 MPVA 纤维的存在可能会阻碍这些 PNA 纤维在 37℃下的疏水相互作用,从而使对照样品无法在生理条件下发生溶胶-凝胶转变。当温度从 25 ℃ 升至 37 ℃ 时,MPVA 纤维的亲水性应该保持不变,因此 IEMH-m 在生理条件下的表现与 IEMH-mp 类似,这是因为它们之间不存在疏水作用。本研究发现:其 G′明显小于 IEMH-5b 在 37℃ 时的 G′,见图 3e。此外,在振荡频率大于 2 rad s-1 时,IEMH-p 的 G′小于其 G″,这意味着 37℃ 时 PNA 纤维之间的疏水相互作用相对较弱。根据上述结果,本研究得出结论:除了疏水相互作用外,IEMH-5b 中的 PMVA/PNA Janus 纤维之间应该存在某种更强的相互作用,从而导致其在生理条件下发生溶胶-凝胶转变。此外,应该是纤维的 Janus 结构导致它们产生了较强的相互作用。
傅立叶变换红外光谱(FTIR)和核磁共振(NMR)间接证明了在生理条件下 IEMH-5b 内 PMVA/PNA Janus 纤维之间的疏水相互作用,使用 D2O 代替 pH 7.4 PBS 制备的类似物进行测试,当温度在 25℃ 至 37℃ 之间变化时,该类似物也会发生可逆的溶胶-凝胶转变。因此,纤维中 PNA 组分酰胺基团和 MPVA 组分羟基的活性 H 原子被 D 原子取代,从而避免了傅立叶变换红外光谱中水的变形带与酰胺 I 带的重叠,如图 4a 所示。当温度从 25℃ 升高到 37℃ 时,酰胺 I 波段从 1622 cm-1 蓝移到 1633 cm-1,而酰胺 II 波段从 1455 cm-1 红移到 1447 cm-1。这些结果表明,PNA 成分的酰胺基团与水分子之间的氢键在 37 ℃ 时断裂,导致 Janus 纤维的 PNA 侧从亲水性转变为疏水性。相比之下,分别属于 MPVA 的 O-D 和 C-O 伸展振动的 3437 cm-1 和 1208 cm-1 波段并没有随着温度的升高而发生变化。
此外,图 4b 还给出了 IEMH-5b 类似物分别在 25 ℃ 和 37 ℃ 下测定的 1H NMR 光谱。可以看出,与在 25 ℃ 下获得的光谱相比,在 37 ℃ 下获得的光谱的主要变化是所有 PNA 线的综合强度明显下降。除了异丙基的 CH3 质子(1.21ppm)外,PNA 的其他质子信号几乎都从光谱中消失了。这些现象表明,随着温度从 25℃ 升至 37℃,PMVA/PNA Janus 纤维的 PNA 侧变得疏水,其夹带的水分子被排出,从而使大多数 PNA 单元的迁移率降低,以至于相应的线变得太宽(各质子的自旋-自旋弛豫时间 T2 太短),无法在使用液态 NMR 光谱仪测量的 1H NMR 光谱中检测到。当温度降回 25 ℃ 时,得到的 1H NMR 图谱与加热前在该温度下的图谱没有区别,表明 IEMH-5b 的溶胶-凝胶转变具有可逆性。
图4 用于研究 IEMH-5b 溶胶-凝胶转变机制的表征结果
【IEMH 的细胞毒性】
以 IEMH-5b 为代表,本研究通过 MTT 试验评估了 IEMH 的细胞毒性。结果表明,与 IEMH 混合的小鼠 C2C12 成肌细胞在培养时间(11 天)内保持存活和生长。图 5 显示,与对照组相比,细胞在培养时间内的存活率超过 95%,这反映出 IEMH 具有良好的生物相容性。众所周知,PNIPAM 和 PVA 都是生物相容性聚合物,已被广泛用于制备组织工程支架。因此,在 PNIPAM 链上引入少量 ABP 单元或在 PVA 链上引入甲基丙烯酸酯基团,并在紫外线照射下产生交联结构,都不会改变它们的生物相容性。
图5 三种培养时间间隔下 IEMH-5b 的 MTT 检测结果
2. 总结与展望
总之,本研究设计并制备了一种新型可注射水凝胶,它能在生理条件下发生溶胶-凝胶转变,形成仿 ECM 纤维结构的固体凝胶。IEMHs 由缩短的 Janus 纤维组成,能够在体温下自卷曲,不含任何有毒或活性化学物质。这种 Janus 纤维可以通过 s-b-s 电纺丝工艺结合紫外线照射大量制成,并使用水作为溶剂来制备纺丝溶液。傅立叶变换红外光谱(FTIR)、核磁共振(NMR)、扫描电镜(SEM)和 TRIFM 的表征结果表明,IEMHs 的溶胶-凝胶转变应源于热诱导自卷曲纤维之间的紧密缠结和纤维之间的疏水相互作用的协同作用,从而使其在生理条件下具有良好的稳定性。在环境温度下,它们具有显著的有利于注射的假塑性,这种假塑性随着纤维浓度或纤维平均长度的增加而增强。在体温下,纤维含量仅为 5 wt%的 IEMHs 可迅速凝胶化,形成具有理想坚固性、弹性和自愈能力的固体凝胶。体外细胞毒性实验结果表明,与 IEMH 混合的小鼠 C2C12 肌母细胞在 11 天的培养时间内仍能存活和生长,细胞存活率超过 95%。由于其形成的固体凝胶也具有类似于 ECM 的纤维结构,与普通的可注射分子水凝胶相比,这种新型可注射水凝胶可能具有生物效应,因此更适合用作组织工程支架。
文章来源:https://pubs.rsc.org/en/content/articlelanding/2024/mh/d3mh01789c