今日头条
和誉FGFR2/3抑制剂亮相ESMO大会。和誉医药新一代FGFR2/3高选择性抑制剂ABSK061在ESMO TAT2024会议上公布其用于晚期实体瘤患者的首次人体I期临床数据。结果显示,在携带FGFR激活改变的8例患者中,有3例患者达到确认的部分缓解(cPR),ORR为37.5%;3例患者达到疾病稳定(SD),2例患者发生疾病进展(PD),DCR为75%。临床中,大多数不良事件都是低级和可逆的。
国内药讯
1.百济神州PD-1单抗美国报胃癌BLA。百济神州PD-1抑制剂替雷利珠单抗的生物制品许可申请(BLA)获FDA受理,与含氟嘧啶和铂化疗联合治疗局部晚期不可切除或转移性胃或胃食管交界处(G/GEJ)腺癌患者。在RATIONALE-305试验中,替雷利珠单抗联合化疗相比化疗显著改善PD-L1高表达的患者总生存期(中位OS:17.2vs12.6个月;HR:0.74;P=0.0056);在ITT人群中,联合治疗也显著改善患者OS(中位OS:15.0vs12.9个月,HR:0.80)。
2.百奥泰PD-1抗体启动头对头III期临床。百奥泰PD-1抗体BAT3306在Clinicaltrials.gov网站上注册一项I/III期研究,拟评估BAT3306与原研药Keytruda对比一线治疗IV期非鳞状非小细胞肺癌患者的有效性与安全性。该项试验将在中国、欧洲以及其他国家开展,预计今年8月启动,并于2027年7月获得主要终点数据。据悉,Keytruda美国专利保护期至2028年,欧洲专利保护期至2031年,中国专利保护期至2028年。
3.驯鹿CAR-T临床研究见刊EMBO分子医学。驯鹿生物BCMA CAR-T产品伊基奥仑赛注射液(CT103A)针对复发/难治性抗体介导的神经系统特发性炎症性疾病的一项探索性研究(NCT04561557)结果积极。2例难治性重症肌无力(MG)患者接受单次CT103A回输3个月-18个月期间,患者重症肌无力-日常生活活动评分(MG-ADL)、QMG评分、MG-QOL评分和改良Rankin评分(mRS)持续改善。详细结果公布于在《EMBO Molecular Medicine》期刊上。
4.AZ引进双抗中国获批白血病IND。阿斯利康靶向CD19/CD3的双特异性T细胞衔接蛋白(TCE)AZD0486获国家药监局批准,即将在中国开展用于治疗复发性或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)的新药研究。2022年8月,阿斯利康逾12亿美元收购TeneoTwo公司并囊获AZD0486。公布于ASH会议上的Ⅰ/Ⅱ期研究显示,AZD0486单药治疗复发/难治性B细胞非霍奇金淋巴瘤(B-NHL)患者具有较好的安全性及初步疗效。
5.罗氏FcRH5/CD3双抗中国获批IND。罗氏1类生物制品cevostamab获国家药监局临床许可,拟开发治疗多发性骨髓瘤(MM)患者。cevostamab(RG6160)是一款FcRH5/CD3双特异性抗体,目前处于Ⅰ/Ⅱ期临床开发阶段。公布于ASH2021年会上的临床数据显示,该新药在接受过CAR-T治疗的患者亚群中ORR为36.7%,接受过其它双特异性疗法治疗的患者亚群中ORR为33.3%,接受过ADC或抗BCMA疗法治疗的患者亚群中ORR分别为50.0%和36.4%。
6.云顶新耀引进FIC泽托佐米获批临床。Kezar Life Sciences公司新型选择性免疫蛋白酶体抑制剂Zetomipzomib(泽托佐米,KZR-616)获国家药监局批准在中国开展国际Ⅱb期PALIZADE试验,评估治疗活动性狼疮肾炎(LN)的潜力。去年9月,云顶新耀与Kezar Life Sciences达成合作协议,获得该新药在大中华区、韩国和部分东南亚国家的临床开发和商业化权益。一项Ⅱ期临床MISSION数据显示,zetomipzomib联合基础疗法治疗达到64%的缓解率。
国际药讯
1.高脑渗透性ARI罕见病NDA获优先审评。Applied公司新型醛糖还原酶抑制剂(ARI)govorestat(AT-007)的新药申请(NDA)获FDA授予优先审评,用于治疗经典半乳糖血症,PDUFA日期为今年8月28日。在临床研究中,Govorestat显著降低患者的血浆半乳糖醇水平,改善患者的日常生活活动、行为症状、认知、精细运动技能。今年2月初,govorestat也在治疗山梨醇脱氢酶(SORD)缺乏症的Ⅲ期临床INSPIRE达到主要和关键次要终点。
2.毒蘑菇致幻成分抗抑郁Ⅱ期临床积极。Incannex Healthcare裸盖菇素(psilocybin)疗法治疗广泛性焦虑症(GAD)的Ⅱ期临床Psi-GAD1达到主要终点。与安慰剂相比,裸盖菇素治疗患者的汉密尔顿焦虑评分量表(HAM-A)评分显著改善,两组HAM-A评分较基线分别降低12.8分和3.6分(p<0.0001);治疗组有44%患者的焦虑评分较基线降低≥50%;临床中未观察到严重或重度不良事件。裸盖菇素是源于毒蘑菇致幻成分。
3.秋水仙碱注射疗法获批痛风Ⅱ期临床。PK MED公司开发拟用于治疗痛风的局部关节内注射疗法PKM-01获FDA批准直接进入Ⅱ期临床研究。PKM-01是全球首创的秋水仙碱注射物,由秋水仙碱和局麻药罗哌卡因组合而成。与现有的治疗方法不同,罗哌卡因的麻醉效果有望在病发关节部位注射后几分钟内发挥止痛效果,有望为痛风患者带来新选择。PK MED预计PKM-01将在美国市场达到超10亿美元规模。
4.干眼症新药III期临床未达研究终点。Palatin公司黑皮质素受体激动剂PL9643治疗干眼症(DED)的III期MELODY-1研究未达到主要终点及次要终点。与安慰剂相比,PL9643治疗患者的上方角膜荧光染色评分和结膜丽斯胺绿染色评分无显著性差异。在经年龄和性别调整的ITT人群中,PL9643在缓解眼部不适方面的疗效具有临床意义。PL9643治疗相关不良事件(TRAE)发生率较安慰剂更少(6.3% vs. 5.6%)。Palatin股价当日大跌38%。
5.艾伯维超7亿美元引进FIC抗体。艾伯维与OSE Immunotherapeutics公司就后者开发用于激活G蛋白偶联受体(GPCR)靶点ChemR23的潜在“first-in-class”单抗OSE-230达成合作许可协议,获得OSE-230开发、生产和商业化的全球独家许可,应用于慢性和严重炎症领域。根据协议,OSE公司将获得4800万美元的预付款,高达6.65亿美元的临床开发、监管和商业里程碑后期付款。OSE-230通过影响巨噬细胞和中性粒细胞的调节功能,可促使组织炎症反应结束。
6.晖致引进Idorsia两款临床后期新药。Viatris公司与Idorsia公司就后者两款临床后期项目(selatogrel和cenerimod)达成合作许可协议,获得两款新药的全球开发和商业化授权。Selatogrel是一款高选择性P2Y12抑制剂,用于治疗急性心肌梗死(AMI)患者;Cenerimod是一款潜在“first-in-class”的S1P1R调节剂,拟开发治疗系统性红斑狼疮(SLE)。根据协议,Idorsia将获得3.5亿美元的预付款、潜在的开发和监管里程碑等款项。
医药热点
1.徐英辉同志任中国医科大学党委书记。2月27日,中国医科大学召开干部会议,宣布学校干部任命决定:徐英辉同志任中国医科大学党委书记。公开信息显示,徐英辉,男,汉族,1965年11月生于辽阳,研究生学历,博士学位,教授、主任医师。此前,徐英辉同志曾任大连医科大学党委副书记、校长,辽宁省卫健委党组书记、主任。
2.华中科技大学同济咸宁医院开建。2月28日上午,位于咸宁市梓山湖新城滨湖大道和蓝田路交汇处的咸宁国家区域医疗中心项目华中科技大学同济咸宁医院正式开工建设。该项目规划用地215亩,总建筑面积12.65万平方米,总投资12.5亿元,预计2026年建设完工并投入运营。建成后的同济咸宁医院将以华中科技大学同济医学院附属同济医院为输出医院,以咸宁市中心医院为依托医院,由咸宁市人民政府与同济医院合作共建。
3.山西省人民医院推出“夜间特需门诊”。2月26日起,山西省人民医院开放夜间特需门诊服务,为非工作时间就诊患者提供优质、便捷、贴心的一站式延伸医疗服务。夜间特需门诊的出诊时间为周一至周五晚6时至9时,出诊的专家为该院省优秀专家、享受国务院特殊津贴的专家以及经验丰富的高年资专家。对于一些多器官、多系统疾病及疑难杂症的患者,还可提供多学科联合会诊服务,为患者提供个性化、精准化且科学全面的诊疗方案。
评审动态
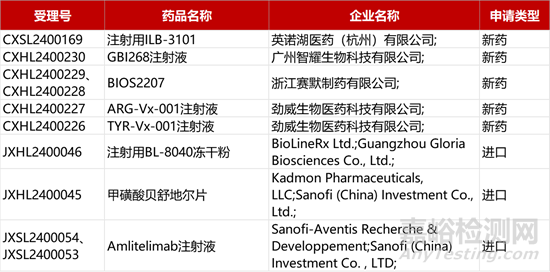
1. CDE新药受理情况(02月29)
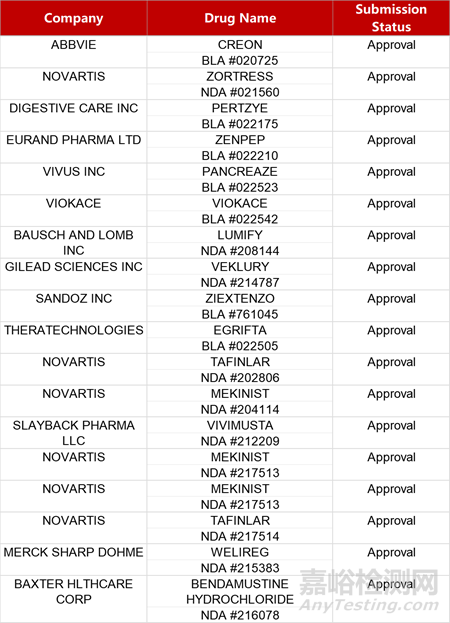
2. FDA新药获批情况(北美02月28日)