无菌检查法(Sterility tests),顾名思义就是检查是否无菌,凡是药典要求无菌的药品、医疗器具、原料、辅料等均需要经过此项检查,因此它也成为制药行业绕不过去的一个话题。
虽然中国药典、美国药典等,都对无菌检查法进行了明确的规定,但不同国家中具体实施却不尽相同,因此对于中美双报或者多个国家申报的公司,明确各国药典中的差异尤为重要。
认识无菌检查法
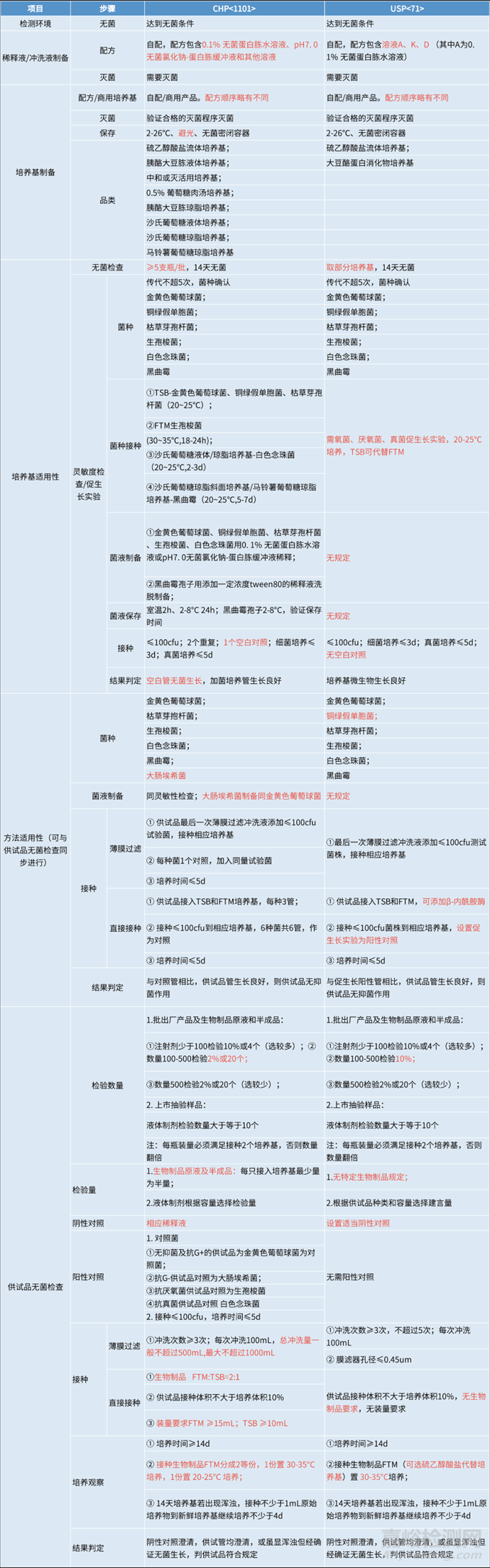
除去培养基制备、储存和稀释液、冲洗液配制等准备工作,无菌检查法还包含3个部分的实验,分别为:培养基适用性检查、方法适用性试验和供试品的无菌检查。
各国药典比较分析
关于无菌检查法,美国、日本、欧洲药典等基本实现药典协调,因此这里重以中美之间的差异为切入点进行分析。
1.菌种差异
用于无菌检测的菌种,虽然各国采用的种类大致相同,但菌种往往带有独特的ID编号。国内来说,“中国医学细菌保藏管理中心(CMCC)”为主流机构,而欧美国家则普遍认可“美国标准菌种保藏中心(ATCC)”。
对于不同来源的菌株,国家药典委在2018年ICH Q4药典相关检测方法专题研讨会给出的协调建议是“基本一致,可以协调,不同来源菌株一致性需进行验证”。中国药典<9203>药品微生物实验室质量管理原则中也要求“标准菌株应来自认可的国内或国外菌种保藏机构”,<1101>中却并没有提及可以使用等效菌株代替。而美国药典<71>里也并未提及<61>“equivalent strains”。
2.汇总对比分析
下表汇总对比了无菌检查法在中美药典中的差异,其中红色标记为需要重点关注的地方。
小结
当前,中国药典的无菌检查法暂时没有和国际统一,这对于药品双报或多报的企业来说就有了更多的挑战,按不同的药典要求建立符合注册国的无菌检查法可能更加稳妥。