众所周知,药物进入人体试验之前需要开展大量非临床动物研究。各指导原则对于安全性研究中的动物数量也有明确建议。不过,目前的趋势是世界各地监管机构或协会大都在努力减少动物的使用。当然,前提是不失其科学性。比如EMA在Directive 2010/63/EU中,规定了动物的替代(replacement)、减少(reduction)和优化(refinement)原则,即著名的“3R”原则,旨在加强对动物的保护。FDA也出台了Modernization Act 2021,允许使用新的替代方法评估药物安全性。
正是基于减少动物使用的原则,虚拟对照(virtual control groups)的概念被引入安全性评价试验中,并用于取代平行对照组(concurrent control groups)。所谓的平行对照组通常指给予稀释药物用的溶媒或其它溶剂的阴性对照组,一般占毒理研究的25%的动物数量。虚拟对照的依据则主要来源于历史对照数据。但是,虚拟对照的使用是有很大挑战的,如果试验相关协变量不能得到充分控制,有可能对毒理研究结果造成影响。
2023年,徕博科(Labcorp)团队就虚拟对照替代平行对照可行性这一主题进行了研究。选取了13周和52周重复给药毒性试验作为样本,因为这个阶段已经有了部分人体数据,且Vehicle对照已经基本确定。另外,考虑到非人灵长类(Non-human primates, NHP)的全球短缺,关注度最高,主要收集的是非人灵长类动物的安全性数据。调查之初,研究团队首先提出了3个问题:
1)NHP毒理试验中,什么样的毒理学终点只有在平行对照存在的情况才能评估?
2)如果把平行对照数据从整体试验中移除,会出现什么样的挑战?
3)如果不参照平行对照数据,给药组的数据应该如何评估?
带着这3个问题,研究团队从近3年在徕博科开展的20项NHP研究中收集数据,并进行了分析。纳入的毒理学参数包括:临床观察、体重、眼科检查、体温、血压、心电图、尿液分析、血常规、血生化、凝血、免疫细胞亚群、细胞因子/趋化因子、T细胞依赖的抗体反应(TDAR)、器官重量、大体解剖观察、组织病理学检查等。
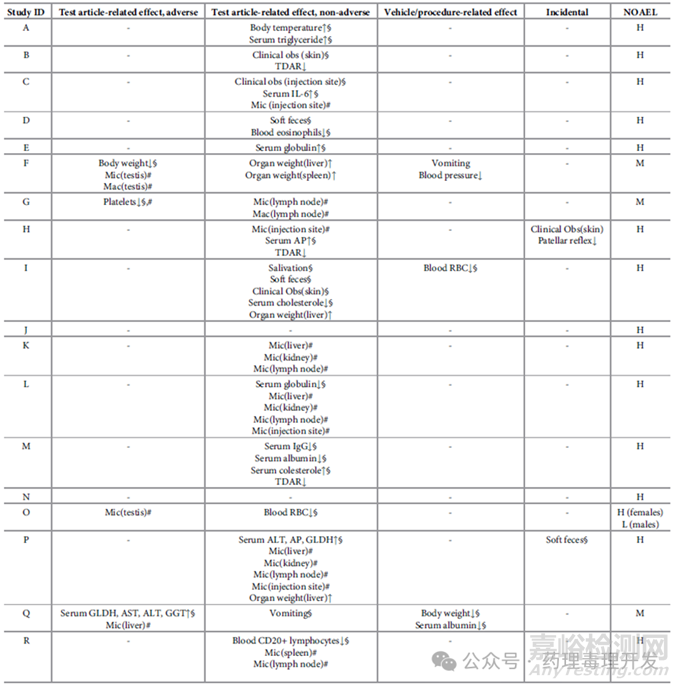
20项研究中,有2项未见任何毒理学异常发现,予以剔除。剩余18项研究中,有4项出现了供试品相关的不良反应,研究ID分别为F、G、O、Q,如下表所示。
这些供试品相关的毒性发现最后均用于NOAEL的判定,那么问题来了,如果不参照平行vehicle对照数据,这些毒性表现可以发现吗?
供试品相关的不良反应
F试验,高剂量3只动物在给药末期的体重与阴性对照相比,出现降低。不过,如果与药前值对比,依然能确定这3只动物体重降低。高剂量组雄性动物大体解剖和病理学检查发现睾丸异常。这些异常通过历史病理对照数据,依然可以识别出来。
G试验,高剂量2只动物与平行vehicle对照相比,出现血小板降低。即使没有平行对照,该结果依然可以通过与药前值、历史对照数据对比发现。
O试验,中剂量和高剂量组动物发现睾丸大体解剖和病理学检查的异常,其中高剂量的毒性反应比之中剂量更为严重。不过,即使没有平行对照,这些异常通过历史病理对照数据也可以进行判断。
Q试验,与平行vehicle对照相比,高剂量组动物谷氨酸脱氢酶、天冬氨酸氨基转移酶,丙氨酸氨基转移酶和γ-谷氨酰转移酶升高。即使没有平行对照,以上毒理学发现,依然可以通过药前值和历史对照数据识别出来。而且,病理发现这些动物同时伴有肝内胆管肥大和增生,也可以辅助判断。
以上介绍了供试品相关的不良反应,再看下供试品相关的非不良反应判定情况。
18项研究中,如果不参照平行对照组数据,大部分的非不良反应依然可以检出。只有器官重量改变、TDAR是例外的。
F试验,高剂量组的肝脏、脾脏重量与阴性对照相比是升高的。不过,由于未在镜检中发现与器官重量增加相关的异常,未被视为不良反应。如果没有平行阴性对照,只能与历史对照组数据比对,但未获得充分的器官重量历史对照数据。I和P研究中也遇到了同样的问题。
TDAR主要用于检测免疫功能包括抗原摄取、递呈、辅助性T细胞功能、B细胞激活和抗体产生。通过采用标准抗原如KLH进行免疫,然后检测免疫球蛋白IgM、IgG。B研究中,与平行阴性对照相比,给药组免疫后的IgG水平下降,考虑到与供试品的作用机制相关,未被定为不良反应。如果不参照平行对照数据,TDAR的异常结果无法判定。这点在H、M、S研究中同样存在。
Vehicle或操作引起的毒性表现
F试验发现阴性对照3只雄性动物、中剂量1只雄性动物、高剂量4雄3雌出现呕吐,考虑到平行阴性对照也有同样发现,呕吐判定为vehicle相关的。而呕吐这类反应是没有历史对照数据的,如果没有平行对照,本试验中的呕吐原因是无法解释的。F试验还发现雄性动物(包括阴性对照)收缩压、舒张压和平均动脉压轻度降低,最后判定为频繁操作引起,动物适应操作后有所好转。如果没有平行对照,这一心血管发现可能会归类为供试品相关。
I试验发现红细胞计数、红细胞压积和血红蛋白浓度下降,鉴于阴性组有同样发现,最后判定为毒代动力学频繁采血所致。如果无平行对照,很难定性这一异常与频繁操作有关。
Q试验中,几乎所有的动物(包括vehicle对照组)均出现体重降低,4周后体重趋于稳定,并在随后几周体重恢复增长。最后将这一异常归因于每天2次的频繁操作导致的动物应激反应。如果未设置vehicle对照组,体重下降可能会被认为与供试品相关。同理,该试验中所有组动物均出现白蛋白降低,也是需要借助平行阴性对照进行析因。
偶发毒性发现
有些毒性发现既不是vehicle相关的,也不是频繁的动物操作所致。比如H试验可见动物皮肤变色,平行设置的vehicle对照组和给药组均有发现,故不认为是供试品相关的,因不影响动物整体健康状态,具体发生原因也未做明确归因。如果未设置vehicle对照,这一结果的解释就要困难很多。同理,P试验中可见vehicle对照组和给药组一过性软便,也是需要参照vehicle数据查找原因。
移除平行对照数据后的统计分析
虽然重复给药的样本量较小,对于一些程度较轻的毒性变化,统计效力往往是不够的。但无论ICH,还是OECD相关指导原则,依然建议采用统计学方法进行毒理学分析。常用的统计方法是先进行fix-effect ANOVA,再采用Dunnett’s test进行组间成对分析。假如去掉平行对照数据进行统计,比如与药前值进行对比,则建议采用mixed-design ANOVA方法进行统计。采用fix-effect ANOVA/Dunnett’s test统计发现的22个具有统计学差异的指标,82%可以通过mixed-design ANOVA检出,18%不能检出的原因与指标变化程度轻且伴随个体间高度变异等有关。
总结
1)供试品相关的不良反应:供试品相关的不良反应对于NOAEL的确定非常关键。4项发现供试品相关不良反应的研究中,即使没有平行阴性对照,通过药前值或者历史对照数据,依然可以准确获得NOAEL。
2)供试品相关的非不良反应:很多供试品相关的效应是non-adverse的,人体风险低,也不影响NOAEL的确定。绝大多数的non-adverse反应在没有平行阴性对照的情况下,依然是可以检出的。当然,器官重量和TDAR例外。
3)Vehicle或操作引起的异常发现:很多动物的指标异常在vehicle对照可同时发现,或与操作导致的动物应激反应有关,或与过度采血有关,亦或者其它可能原因。如果去掉对照组,对于这些反应的归因可能会存在挑战。不过,徕博科研究团队认为,这些异常情况并不罕见,已经有足够经验帮助判断,即使没有平行设置的阴性对照,也可以对Vehicle或操作引起的异常数据进行解释。
4)偶发性毒性:其实,平行设置阴性对照组最主要的一个原因是用于解释一些不可控的偶发性的异常指标。比如文中提及的动物皮肤异常或者软便情况。离开平行对照,这类终点的解读会有些难度。当然,徕博科团队依然认为如果积累足够多的历史对照数据,这些情况也是可以解决的。
总之,考虑到涉及NOAEL制定的供试品相关的不良反应、绝大多数供试品相关的非不良反应均可以通过虚拟对照达到目的,徕博科这篇文章的结论是regulatory(sub)chronic NHP toxicity studies represent a good starting point to implement virtual control groups–rather than concurrent control groups—in nonclinical safety testing,即采用虚拟对照对于NHP重复给药毒性研究是可行的。
当然,本文并不是鼓励NHP一般毒理研究中不设置vehicle对照,相反,这种方案设计,个人理解,几乎百分百会被监管机构退回,起码现阶段应该是这样的。
不过,减少动物的使用是大趋势,徕博科团队的这项前瞻性研究是很有意义的,但这项结论成立是有前提的。首先,样本量太少,仅回溯20项研究得出的结论有一定代表性,但不一定绝对客观,也不宜过度解读。其次,即使这项结论客观,还是有一些毒性发现比如vehicle导致的,更别提很多新药采用的vehicle溶媒并不普遍,没太多背景数据可参考。缺少平行阴性对照,使得很多毒性终点的判定颇具挑战。最后,历史对照数据是可以很大程度上作为虚拟对照数据,用于弥补平行对照缺失引发的问题,但这里面同样有问题,一是国内有多少机构有历史对照数据积累,二是历史对照数据是否可靠(对质量体系的考验),三是历史对照数据是否足够多(对项目数量的考验),四是历史对照数据是否全面,是否囊括了大部分毒理学指标。药前值数据就更不必说了,对于一次性的数据比如器官重量、病理等的解释是爱莫能助的,还涉及一些统计效力问题。
作为药理毒理研究大军的一份子,我们保留对现有监管尺度和原则认知的同时,也需要捕捉国际同行对个别问题理解的变化。有挑战并不可怕,问题终究是用来解决的,对历史对照数据的充分重视其实就是个不错的起点。