洁净间是指将一定空间范围内的空气中的尘粒、微粒子、有害空气、细菌、微生物等污染物排除,并将室内温度、洁净度、室内压力、气流速度与气流分布、噪音振动及照明、静电控制在某一需求范围内,而所给予特别设计的房间。其建筑结构、装备及其作用均具有减少该房间(区域)内污染源的介入、产生和滞留的功能。不论外在空气条件如何变化,其室内均能具有维持原先所设定要求的洁净度、温湿度及压力等性能的特性。对于医疗器械而言,洁净间包括洁净生产区域和洁净检验区域。
《无菌医疗器具生产管理规范》(YY/T 0033-2000)标准中对洁净间定义有了明确的规定,即需要对尘埃及微生物含量进行控制的房间(区域),其建筑结构、装备及其作用具有减少对该房间(区域)内污染源的介入、产生和滞留的功能。
《洁净室及相关受控环境 第1部分:按粒子浓度划分空气洁净度等级》(GB/T 25915.1-2021)中规定,洁净室是指空气悬浮粒子浓度受控并分级的房间,其设计、建造到运行均使进入、产生、滞留于房间的粒子受控。洁净区是指空气悬浮粒子计数浓度受控并分级的限定空间。其建造和运行使进入、产生和滞留于空间的粒子受控。洁净区可以是限定于洁净室内的空间,也可用隔离装置实现。隔离装置既可设在洁净室内也可在洁净室外。
二、洁净间的预期用途
洁净间最主要的作用在于控制产品所接触大气的洁净度及温湿度,使产品能在一个良好的环境空间中生产、制造和微生物检验,此空间我们称之为洁净间。
三、洁净间适用的产品
(一)适用于通过最终灭菌的方法、通过无菌加工技术使产品无任何存活微生物的医疗器械以及体外诊断试剂产品的生产,如血管内支架、骨科植入物、体外诊断试剂、介入手术器具等。
(二)需要控制初始污染菌的医疗器械品种,如透析粉(液)等。
(三)与产品直接接触的单包装。
四、洁净间的构成
一般情况下,洁净间是指医疗器械生产和检验所需的工作环境,对于生产环节,应包括与生产产品工艺流程相对应的功能间,如注塑间、干燥间等;对于检验环节,应包括与检验有关的功能间,如阳性对照室、无菌检验室和微生物限度室等;为生产服务的辅助功能间,如洗衣间、洁具间等以及连接各功能间的缓冲过渡通道。
五、洁净间的洁净度级别和设置原则
(一)洁净度级别
洁净度:洁净环境内单位体积空气中含大于或等于某一粒径悬浮粒子的允许统计数。
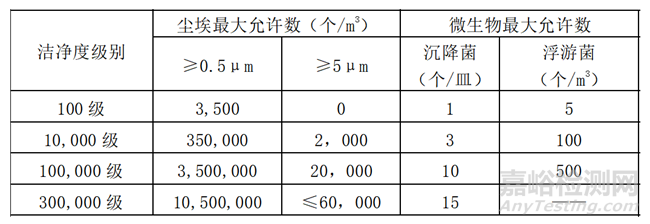
依据《无菌医疗器具生产管理规范》(YY/T 0033-2000)标准,洁净间的环境级别分为300,000级、100,000级、10,000级和100级。
表1 《无菌医疗器具生产管理规范》(YY/T 0033-2000)中空气洁净度等级
《医药工业洁净厂房设计标准》(GB 50457-2019)中对洁净度等级也作出了相关的规定。
表2 《医药工业洁净厂房设计标准》(GB 50457-2019)中医药洁净间空气洁净度等级
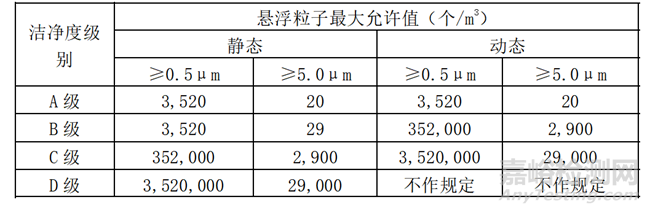
表3 《医药工业洁净厂房设计标准》(GB 50457-2019)中医药洁净室环境微生物监测的动态标准
(二)设置原则
除了上述标准之外,原国家食品药品监督管理局2015年发布的《医疗器械生产质量管理规范附录无菌医疗器械》、《医疗器械生产质量管理规范附录植入性医疗器械》中分别规定了无菌医疗器械洁净间设置原则和植入性医疗器械洁净间设置原则,《医疗器械生产质量管理规范附录体外诊断试剂》中也规定了相应产品生产环境级别要求,生产企业应结合相应法规要求和技术标准要求识别并确定本企业洁净环境级别,并验证后执行。医疗器械法规和标准没有规定的,生产企业可参照上述要求确定产品生产洁净级别,或自行验证并确定产品的生产洁净级别。
洁净间洁净度级别设置原则:
1.采用使污染降至最低限的生产技术,以保证医疗器械不受污染或能有效排除污染。倡导技术进步,建议用先进的生产技术。包括先进的生产工艺、先进的设备、工装和设施等。在生产过程中尽量减少人为因素,最大程度地使产品不暴露在操作环境中,尽可能避免人与产品的直接接触。
2.植入和介入到血管内器械,不清洗零部件的加工,末道清洗、组装、初包装及其封口,不低于10,000级。植入到人体组织、与血液、骨腔或非自然腔道直接或间接接触器械,(不清洗)零部件的加工、末道清洗、组装、初包装及其封口等,不低于100,000级。与人体损伤表面和粘膜接触器械,(不清洗)零部件的加工、末道精洗、组装、初包装及其封口,不低于300,000级。
与无菌医疗器械的使用表面直接接触、不清洗即使用的初包装材料,宜遵循与产品生产环境的洁净度级别相同的原则,使初包装材料的质量满足所包装无菌医疗器械的要求。若初包装材料不与无菌医疗器械使用表面直接接触,不低于300,000级。对于有要求或无菌操作技术加工的,在10,000级下的局部100级洁净间内。洁净工作服清洗、干燥和穿洁净工作服室、专用工位器具的末道清洗与消毒的区域的空气洁净度级别可低于生产区一个级别。
医疗器械法规规定,高风险生物活性物料(如强毒微生物、芽胞菌制品、激素类试剂组分、放射性物质)的操作应使用单独的空气净化系统,与相邻区域应保持负压,排出的空气不应循环使用;阴性、阳性血清、质粒或血液制品的处理操作应当在至少10,000级环境下进行,与相邻区域保持相对负压,并符合防护规定;生产激素类试剂组分的洁净环境应当采用独立的专用的空气净化系统,且净化空气不得循环使用;强毒微生物操作区、芽胞菌制品操作区应与相邻区域保持相对负压,配备独立的空气净化系统,排出的空气不得循环使用。酶联免疫吸附试验试剂、免疫荧光试剂、免疫发光试剂、聚合酶链反应(PCR)试剂、金标试剂、干化学法试剂、细胞培养基、校准品与质控品、酶类、抗原、抗体和其他活性类组分的配制及分装等产品的配液、包被、分装、点膜、干燥、切割、贴膜、以及内包装等工艺环节,现场核实,至少应在100,000级洁净环境中进行操作,无菌物料的分装必须在局部100级洁净环境下进行。
无菌实验室原则上应设三间10,000级下的局部100级洁净间,用作无菌检验室、阳性对照室和微生物限度室。无菌检验室应当和洁净生产区分开设置,有独立的区域、单独的空气净化系统和专用的人流物流通道及实验准备区等。阳性对照室应配备不低于《生物安全柜》(GB 41918-2022)、《Ⅱ级生物安全柜》(YY 0569-2011)要求的生物安全柜。
生产企业可在启用的洁净间入口处张贴洁净间平面图,标识洁净间布局、环境控制级别以及人流物流走向等。
六、洁净间的日常监测项目
依据《无菌医疗器具生产管理规范》(YY/T 0033-2000)标准,洁净间的监测项目包括温湿度、静压差、风速、换气次数、尘埃粒子数、沉降菌或浮游菌。
表4 《无菌医疗器具生产管理规范》(YY/T 0033-2000)中环境监测项目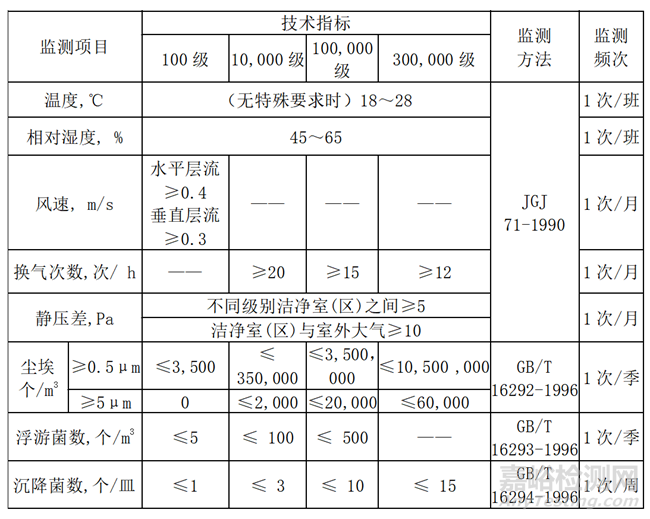
七、影响洁净间洁净度的主要因素
(一)医疗器械产品自身特性
(二)医疗器械生产工艺
(三)人员、设施卫生要求:由于患者或工作人员自身带菌而污染或由于和非完全无菌的用具,器械和人的接触而污染。
(四)大气环境:由于空气中所含细菌的沉降、附着或被吸入而污染。
(五)其他:由于昆虫等其他因素而污染细菌还可能产生毒性物质、色素等代谢产物。
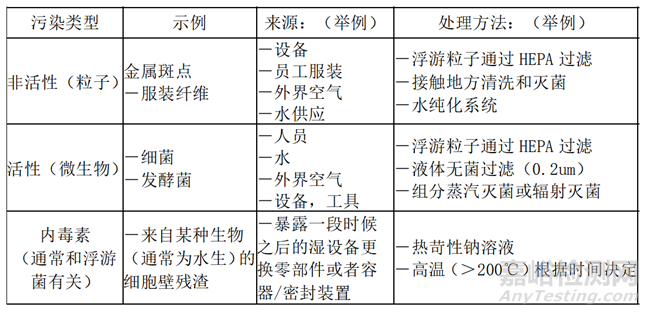
表5 污染物来源