制药行业中,原料药的粒度分布可能会对产品的性能,如溶解度、生物利用度、含量均匀度、稳定性等,产生显著影响。
ICHQ6A指导原则中给出了何时需要制定粒度标准的决策树,建议对固体制剂或含不溶原料药的液体制剂,当粒度大小是以下几方面的关键因素时,需要建立粒度标准。
• 溶出度、溶解度或生物利用度;
• 制剂生产;
• 制剂稳定性;
• 制剂含量均匀度
制药行业内最广泛使用的粒度分析技术之一是激光衍射技术,具有广泛适用性,适用于粒径在0.1到3500微米范围内的湿法或干法系统。
下文将以激光衍射法为例,讨论如何进行粒度标准制订。
1、选择合适的粒度指标
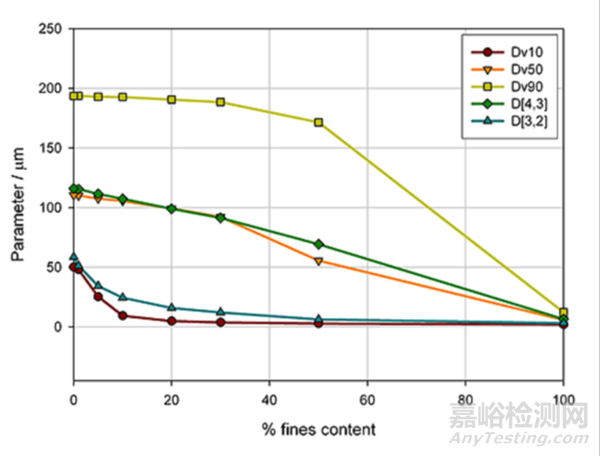
测量不同粒度指标对样品配方变化的敏感性是作为参数选择的重要依据之一。图1中使用激光衍射法(马尔文帕纳科的Mastersizer)测量混合了不同比例细颗粒的样品,显示了随着细颗粒含量增加不同粒径指标的变化。
图1.不同粒度指标对细颗粒含量的敏感性
这个例子中,显然Dv10和D[3,2]只在细颗粒含量占比低于10%时对粒径有相应的敏感性,而Dv90在细颗粒含量高于40%时能反映出粒径的变化。
相比之下,Dv50和D[4,3]始终表现出对粒径变化好的表征效果,因此建议采用Dv50和D[4,3]制定粒径控制标准较为合适。
2,设定偏差范围
激光衍射等技术具有出色的重复性、重现性和稳定性,能够提供高质量的数据。
高重复性意味着在相同系统上运行的同一样品获得的结果一致,因此测量结果的好坏更多的取决于样品分散的重现性。
重现性是一个更严格的参数,用于量化由操作员、样品、时间和仪器变化引入的误差;采样方法也至关重要。测量误差直接影响标准制定中偏差的设定。
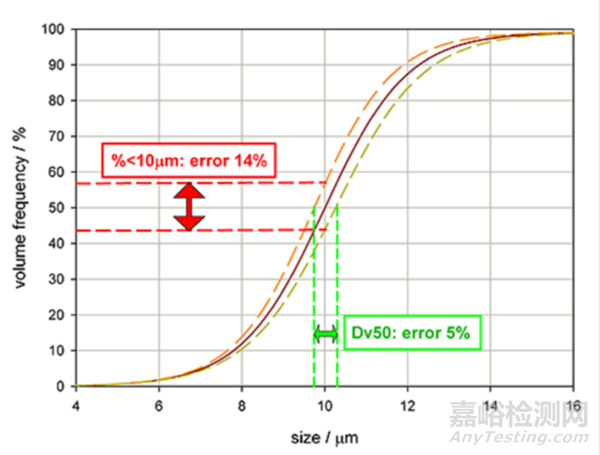
图2粒度分布曲线,红色实线是典型读数,黄色和橙色虚线表示偏差范围。
如果该产品的标准规定是Dv50=10μm,那么图中对应的测量误差是+/-5%。但是,不能因此就错误的以为小于10μm的偏差也是该数值。
如果标准规定样品中小于或等于10μm的颗粒累积体积分布百分比为50%,测量误差就是+/-14%。
图2测量精度受指标规定的影响。
随着测量误差的增加,测量结果更不可靠。这很容易理解,但在标准制订中并没有充分考虑这一点。
以下是一个片剂混合物的标准要求(Evolutions in Direct Compression,Douglas McCormick,Pharmaceutical Technology,April2005. Pg52-62):
Dv10>30μm
D[4,3]>80μm
Dv90<1000μm
上述标准设定没有考虑到任何由测量引入的误差,只是描述了最理想的结果。参照USP<429>的要求,中位值Dv50RSD≤10%,两侧值Dv10和Dv90RSD≤15%。那么30μm样品允许的Dv10最大测量值是34.5μm(误差15%)。如果想确保样品的实际Dv10大于30μm,需要调整相应的指标要求。调整后如下:
Dv10>34.5μm
D[4,3]>88μm
Dv90<850μm
精度较低的方法则需要制定更严格的粒度标准。因此建议使用重现性更高的仪器和开发更稳定的方法。
3、 结 论
粒度和粒度分布是原辅料及药物颗粒的关键质量属性,直接影响药效,需要严格控制。激光衍射法是一种适用于多种行业的粒度分析技术。
经典的马尔文帕纳科Mastersizer3000激光粒度仪可提供高重现性的结果(+/-1%),避免因测量方法不准确而需要缩小偏差范围。
参考资料
https://www.malvernpanalytical.com/en/learn/knowledge-center/whitepapers/wp110325pharmamanufacspecs