您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-19 08:07
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
四川厌氧从粪便分离创新药获批临床。四川厌氧生物治疗用生物制品1类创新药KAL-002获国家药监局两项临床试验默示许可,即将开展I期临床,评估用于治疗化疗相关性腹泻以及放射性肠炎的安全性与有效性。KAL-002是从健康人粪便中分离和筛选而获得的五株菌种组成的多联活菌配方,可以降低腹泻次数并改善腹痛程度,从而提高患者的生活质量。
国内药讯
1.华津溶瘤细菌启动II期临床。广州华津医药广谱溶瘤产品桑美威克®(SGN1)启动一项II期临床,拟用于治疗二线及以上治疗失败的晚期头颈部鳞状细胞癌。SGN1通过减毒沙门氏菌载体搭载特异的甲硫氨酸水解酶,剥夺肿瘤生长所需的必须氨基酸,从而杀伤肿瘤并阻止肿瘤扩散。此前,该产品已获得FDA授予用于治疗骨肉瘤、肝细胞癌(HCC)和小细胞肺癌(SCLC)的三项孤儿药资格。
2.恒瑞尿道癌ADC获快速通道资格。恒瑞医药自主研发的靶向Nectin-4的抗体偶联药物(ADC)注射用SHR-A2102获FDA授予快速通道资格,用于治疗晚期尿路上皮癌。SHR-A2102的有效载荷是拓扑异构酶抑制剂(TOPi)。在中国,SHR-A2102单药或联合其他抗肿瘤治疗用于晚期实体瘤的临床试验申请也已获得NMPA的许可,目前进入了Ⅱ期临床试验阶段。
3.加科思胰腺癌新药获孤儿药资格。加科思药业KRAS G12C抑制剂戈来雷塞(glecirasib)获FDA授予孤儿药资格,针对适应症为胰腺癌。公布于2024 ASCO GI会议上的临床数据显示,戈来雷塞在KRAS G12C突变胰腺癌经治患者中,确认客观缓解率为41.9%,疾病控制率为93.5%。此前,glecirasib用于治疗携带KRAS p. G12C突变的局部晚期或转移性非小细胞肺癌也被CDE纳入突破性治疗品种。
4.复宏汉霖肝癌单抗获批临床。复宏汉霖创新型TIGIT Fc融合蛋白HLX53获国家药监局临床许可,拟联合PD-1抑制剂斯鲁利单抗注射液及贝伐珠单抗开展一项II期临床,评估三药联合一线治疗局部晚期或转移性肝细胞癌的安全性和有效性。TIGIT可通过多种作用机制抑制固有和适应性免疫,在肿瘤免疫抑制中的“踩刹车作用”和PD-1/PD-L1类似;TIGIT靶点与PD-1通路也在临床前研究中显示出了协同抗肿瘤效应。
5.苏州复融中美双报激动剂报新IND。复融生物创新生物药FL115注射液的I/II期临床试验申请获CDE受理,拟开发用于治疗非肌层浸润性膀胱癌(NMIBC)。FL115是一款白介素15(IL-15)免疫激动剂,已在今年3月份获国家药监局批准开展用于治疗晚期/转移性实体瘤的新药研究。在美国,该新药正在I期试验中,评估治疗晚期实体瘤患者的安全性与初步疗效。
6.石药入局RSV疫苗赛道。石药集团旗下巨石生物的呼吸道合胞病毒(RSV)mRNA疫苗的临床试验申请获CDE受理。RSV是一种非常普遍且具有传染性的呼吸道感染,是导致支气管炎和肺炎的主要原因,每年在全世界范围内影响超过6400万人。国内同类产品星锐医药的STR-V003在海外进展较快,已于本月启动I/II期研究。
国际药讯
1.礼来GLP-1R/GIPR激动剂打鼾III期临床成功。礼来GLP-1R/GIPR双重激动剂Tirzepatide(替尔泊肽)用于治疗中重度阻塞性睡眠呼吸暂停(OSA)合并肥胖的III期SURMOUNT-OSA试验达到了主要和所有关键次要终点。其中,在未接受正压通气(PAP)的患者中,与安慰剂相比,Tirzepatide(10mg或15mg)治疗52周时患者平均呼吸暂停低通气指数(AHI)较基线降低更多(27.4次/小时vs4.8次/小时),降幅更大(55.0%vs5.0%),体重也显著减少(18.1%vs1.3%)。礼来计划递交Tirzepatide相关监管申请。
2.罗氏多发性硬化单抗长期疗效积极。罗氏旗下基因泰克公司CD20抗体Ocrevus(ocrelizumab)皮下制剂用于一年两针治疗复发性或原发进展性多发性硬化(RMS或PPMS)的Ⅲ期临床OCARINA II结果积极。48周随访结果显示,Ocrevus皮下注射在核磁共振成像(MRI)检测的年复发率仅为0.04;有97.2%的患者在治疗期间未发生复发;且Ocrevus皮下注射与Ocrevus静脉输注的安全性相符。目前,Ocrevus皮下制剂的监管申请正接受EMA和FDA的审评。
3.GSK带状疱疹疫苗长期结果积极。葛兰素史克带状疱疹重组疫苗Shingrix(RZV)在Ⅲ期临床ZOSTER-049中获积极长期疗效数据。在接种疫苗第6年至第11年期间,疫苗对50岁及以上成年人的累积保护效力(VE)为79.7%(95% CI,73.7-84.6),对70岁及以上成年人的累积VE为73.1%(95% CI,62.9-80.9);第11年时,对50岁及以上成年人的保护效力达到82.0%(95% CI,63.0-92.2)。随访期间,未发现新的安全问题。
4.诺华硬化症新药长期疗效积极。诺华每月一次皮下注射给药的CD20单抗Kesimpta(奥法妥木单抗)用于一线治疗复发性多发性硬化(RMS)患者的ALITHIOS开放标签扩展研究结果积极。Kesimpta连续治疗长达6年,可使患者复发次数减少44%;核磁共振成像(MRI)病变(Gd+ T1和neT2)分别减少了96.4%和82.7%;以及3个月和6个月确认的残疾恶化(CDW)事件分别减少了24.5%和21.6%。此外,Kesimpta耐受性良好,未发现新的安全信号。
5.赛诺菲FIC硬化症单抗长期疗效积极。赛诺菲潜在“first-in-class”CD40L单抗frexalimab用于治疗多发性硬化(MS)的Ⅱ期试验最新结果积极。数据显示,frexalimab(1200mg和300mg)治疗使96%与87%患者在第48周时没有观察到Gd+ T1脑部病灶;两组患者平均Gd+ T1脑部病灶数分别为0.0(SD:0.2)和0.2(SD:0.5);患者年复发率(ARR)为0.04(95% CI:0.01,0.18);Frexalimab的耐受性通常良好。该新药目前已处于Ⅲ期开发阶段。
6.GSK新型抗生素达III期主要终点。葛兰素史克三氮杂苊烯类II型拓扑异构酶抑制剂gepotidacin治疗非并发性尿生殖道淋病的Ⅲ期临床EAGLE-1结果积极。与头孢曲松+阿奇霉素方案相比,gepotidacin治疗实现微生物学应答的患者比例的统计达到了非劣效性标准(92.6%vs91.2%);gepotidacin的安全性与之前研究一致。此前,该新药治疗非复杂性尿路感染(uUTI)的两项III期研究(EAGLE-2和EAGLE-3)积极数据已发表于《柳叶刀》上。
7.拜耳帕金森基因疗法启动II期临床。拜耳子公司Asklepios BioPharmaceutical(AskBio)宣布其帕金森病基因疗法AB-1005(AAV2-GDNF)已启动II期临床,预计今年晚些时候在美国、欧盟、英国开始招募患者。在Ⅰb期临床中,神经外科医师通过磁共振成像(MRI)监测的对流增强给药方式将AB-1005一次性双侧壳核注射给药,所有患者对AB-1005的神经外科给药方式耐受性良好,目标壳核覆盖率达到63%±2%,且无严重不良事件发生。
医药热点
1.海医二院开通腰腿痛等11个专症门诊。4月11日,海南医学院第二附属医院首批11个专症门诊开诊,设置了眩晕头晕专症门诊、腰腿痛专症门诊、便秘专症门诊等11个专症门诊。专症门诊团队是一个多学科团队,由多个相关专业的专家组成。大部分患者经初诊医生即可完成诊疗,如初诊医生判断症状非本专业病因,导诊可邀请专症门诊团队其他专业医生会诊,如遇疑难病例可发起专症门诊多学科会诊,一站式为患者提供更合理科学的诊疗方案。
2.北京鼓励社会资本投资建设研究型医院。《北京市支持创新医药高质量发展若干措施(2024年)》17日发布,提出将以国家医学中心、研究型病房为核心,以临床需求为导向,创新机制、聚集资源,组建10家以上区域或专科、专病临床研究联合体,并对30家研究型病房示范建设单位进行考核评价及质控管理,提升临床研究质量和效率。北京鼓励社会资本投资建设研究型医院,支持其与京内医疗机构合作,实现优势互补,吸引全球高水平临床试验和国内首创标志性临床研究项目,开展同步多中心临床试验,加速成果转化应用。
3.司美格鲁肽用于减肥不在医保支付范围。4月16日,国家医保局微信公号发布《“减肥神药”到底进没进医保?》,就司美格鲁肽的使用和报销进行提示。2021年4月,司美格鲁肽已有两个适应症在我国获批,分别是“用于成年2型糖尿病患者血糖控制”和“用于伴有心血管疾病的成年2型糖尿病患者以降低相关疾病风险”,当年即通过谈判纳入国家医保药品目录。国家医保局明确,该药医保支付范围限定在与2型糖尿病有关的两种情形,减肥不在支付范围内,医保不能报销。
评审动态
1. CDE新药受理情况(04月18日)
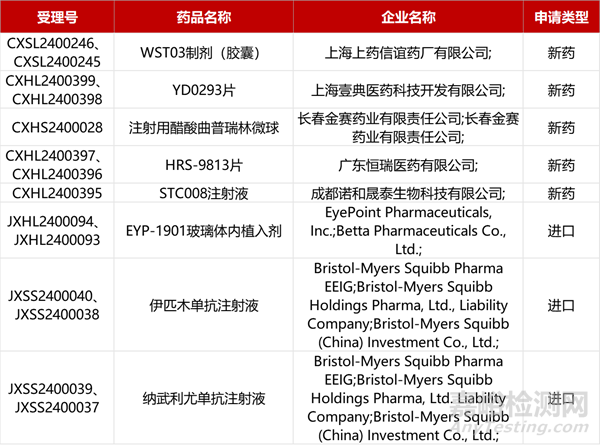
2. FDA新药获批情况(北美04月17日)
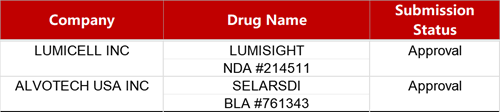

来源:药研发


