您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-12 18:43
摘 要
目的:对我国药品上市许可持有人(MAH)制度实施过程中的关键问题及解决思路进行业内调研,为提出完善我国MAH 制度实施路径的建议提供支持。方法:结合对我国MAH 制度相关法规和实施过程中关键问题的梳理,以及对欧盟、美国、日本等国家和地区MAH 监管体系的深入研究,提取了法规、监管制度及责任赔偿方面的关键问题,设计调研问卷,以医药行业专业人员为目标调研对象开展定向调研,并对调查结果进行分析。结果与结论:调研结果表明,多数调研对象对我国MAH 制度在药品全生命周期各环节落地实施过程中的关键问题与解决思路有一定共识,同时也反映出部分关键问题的解决思路仍需要进一步探索。
Objective: To investigate key issues and management elements of implementing the marketing authorization holder (MAH) system in China and to support related solutions and proposals. Methods: The study combines an analysis of the major issues in implementing relevant laws and regulations of the MAH system in China and in-depth investigation of MAH regulatory systems in Europe, the United States, Japan, and other countries and regions. Key issues in regulations, regulatory systems,and liability compensation are extracted, and a questionnaire survey is designed among pharmaceutical professionals. Results and Conclusion: The results of the survey reflect a consensus among most respondents on key issues and solutions for implementing the MAH system in the entire life cycle of drugs in China. Survey results also show that some key issues still need to be further explored.
关键词
药品上市许可持有人制度;实施路径;关键问题;解决思路;问卷调研
marketing authorization holder system; implementation pathway; key issues; solutions; questionnaire
药品上市许可持有人( marketing authorization holder,MAH)制度是欧盟、美国、日本等医药产业发达国家和地区在药品监管领域的通行做法,采用药品上市许可与生产许可分开管理的方式,由MAH 承担药品全生命周期的主体责任[1]。随着新修订的《药品管理法》的颁布,我国MAH 制度于2019 年12 月1 日正式实施[2]。MAH 制度在鼓励医药领域创新、促进产业资源优化配置、落实各方责任方面起到了积极的作用。我国MAH 制度仍在起步阶段,尽管国家已出台《药品注册管理办法》[3]、《药品生产监督管理办法》[4] 等MAH制度落地实施的配套法规,相当一部分问题已在法规层面得到解决,但是由于MAH 制度涉及药品全生命周期各个环节,目前仍有一些问题缺乏落地实施路径。
沈阳药科大学亦弘商学院组织开展“我国药品上市许可持有人制度实施路径研究”课题研究。本研究通过对我国MAH 制度落地实施过程中的主要问题进行梳理,结合MAH 制度试点期间的经验总结,以及对欧盟、美国、日本等国家和地区MAH 监管体系的深入研究,在此基础上以药品全生命周期为主线,提取MAH 制度实施中的关键问题,设计调研问卷,开展定向问卷调研,并对调研结果进行分析,为提出完善我国MAH 制度落地实施建议提供支持。
1、 资料与方法
1.1 问卷设计
本研究以药品全生命周期为主线,提取我国现有MAH 制度实施中的关键问题,设计问卷进行定向调研。问卷包括4 个部分:基本信息(6 题)、我国MAH 制度全生命周期关键问题(21 题)、责任赔偿专题(5 题)和1 个开放性问题。在问卷编写过程中,研究人员基于调研目的多次对问卷整体结构的合理性、问题和选项设置的科学性等进行测试,并根据测试反馈进行修改完善。
1.2 调研对象与方法
调研对象为我国药品研发、注册、生产、监管等领域从业人员。调研问卷主要通过微信形式发放。本次调研回收问卷共计454 份,有效问卷454 份(有效问卷是指答卷人员工作背景符合目标调研对象的要求,且回答了所有必填问题的问卷)。
2、 调研结果
2.1 基本信息
2.1.1 调研对象的从业情况
问题1 :您从事医药行业的时间?[ 单选题]
调研结果显示,拥有15 年以上医药行业从业经验的调研对象占比达到51.98%,约90% 的调研对象从业超过5 年。调研对象工作年限覆盖较为全面,样本具有代表性。
问题2 :您目前的工作单位属于?[ 单选题]
调研对象中,44.71% 来自药品生产企业,18.28% 来自药品监管机构,17.40% 来自药品研发机构,其他约20% 来自医药合同研发生产组织(CDMO)、医药合同研发组织(CRO)、临床试验机构及其他(包括药品经营企业,销售、教育机构或社团等)。调研对象所属单位覆盖全面,样本具有代表性。
问题3 :您目前所处的工作领域?[多选题]
调研对象中,从事药品生产的比例最高(43.17%),其次是药品注册(不包含上市后变更和再注册,36.56%)、药品研发(32.16%)、药品上市后管理和维护(如上市后研究、变更、再注册等,27.31%) 及药品监管(21.15%), 其他少数调研对象从事药物警戒、经营、市场准入、政策研究等。调研对象从业领域基本涵盖了药品全生命周期管理,样本具有代表性。
2.1.2 调研对象对MAH 制度的总体认识
调研设置了3 个MAH 制度相关的总体问题,了解调研对象对MAH 相关法规、MAH 能力和责任要求的了解程度,并收集调研对象对MAH 制度落地实施中面临问题的总体反馈。
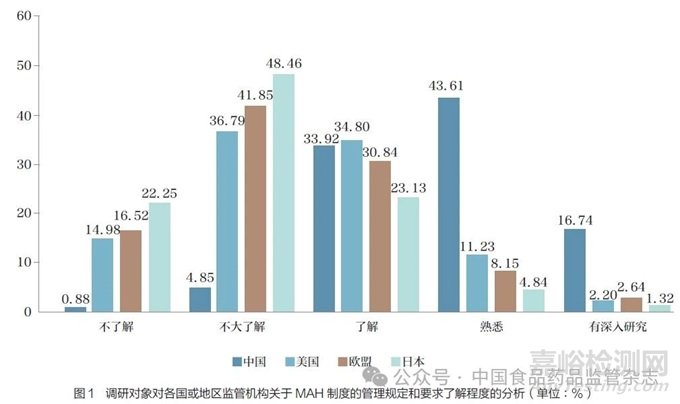
问题4 :伴随2019 年版《药品管理法》实施,我国已全面施行MAH 制度。您是否了解我国以及境外监管机构对MAH 制度的管理规定和要求?[矩阵量表题]
调研结果显示(图1),94.27% 的调研对象反馈了解(包括了解、熟悉和有深入研究)我国MAH 制度管理规定和要求;对境外MAH 制度管理规定和要求了解(包括了解、熟悉和有深入研究)程度从高到低排序依次为美国(48.23%)、欧盟(41.63%) 和日本(29.29%)。按照调研对象所处行业领域进行分层分析显示,不同行业的调研对象对各国或地区MAH 制度管理规定和要求的了解程度无明显差异,尤其在对我国MAH 制度管理规定和要求的了解程度上。
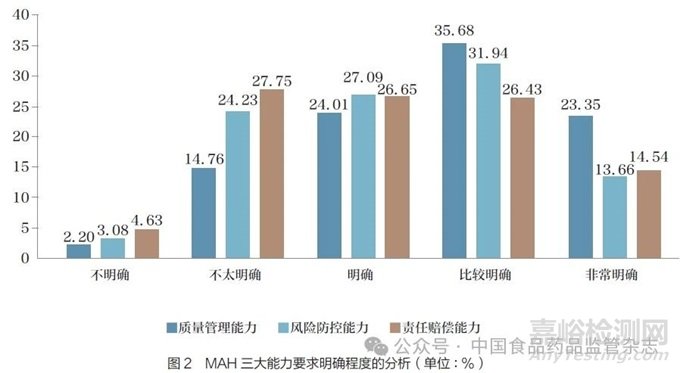
问题5 :根据《药品管理法》的规定,MAH 须具备质量管理、风险防控和责任赔偿三大能力。您认为目前有关MAH 三大能力的要求(尤其是MAH 并非生产企业时)是否明确?[矩阵量表题]
调研结果显示(图2),调研对象认为法规对MAH 质量管理能力要求(尤其是MAH 并非生产企业时)明确(包括明确、比较明确、非常明确) 的占比最高(83.04%),认为对MAH 风险防控能力要求明确( 包括明确、比较明确、非常明确)的占72.69%, 认为对MAH 责任赔偿能力要求明确(包括明确、比较明确、非常明确)的占比最少(67.62%)。调研结果表明,法规对MAH 责任赔偿能力方面的要求仍有待进一步明确。
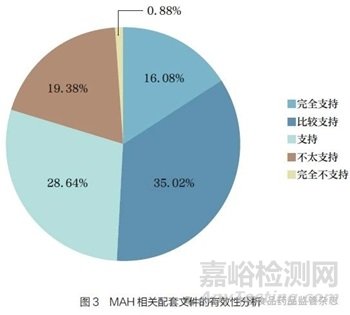
问题6 :根据《药品管理法》的规定,MAH 应对药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告与处理等承担责任。您认为现有MAH 制度的相关配套文件,能否有效支持MAH 上述责任的落地实施?[单选题]
调研结果显示(图3),79.74% 的调研对象认为现有MAH 制度的相关配套文件能够有效支持( 包括支持、比较支持、完全支持)MAH 上述责任的落地实施。有20.26% 的调研对象认为现有配套文件不支持(包括不太支持、完全不支持)MAH 上述责任的落地实施,提示现有配套文件仍有不足,需要完善。
按照调研对象的从业年限进行分层分析发现,从业年限较长的调研对象认为现有MAH 相关配套制度不足以支持(包括不太支持、完全不支持) 其落地的比例较高[ 从业15 年以上约占52%,从业10~15 年(含15 年)约占23%, 从业5~10 年( 含10 年)约占14%]。分析原因可能是由于从业年限较长的调研对象在实际工作中遇到的MAH 相关问题较多。对从事不同领域工作的调研对象分层分析发现,除药品经营和药品市场准入工作领域的结果因两类调研对象样本量较小有所差异,其余领域的结果无明显差异。
2.2 我国MAH 制度全生命周期关键问题
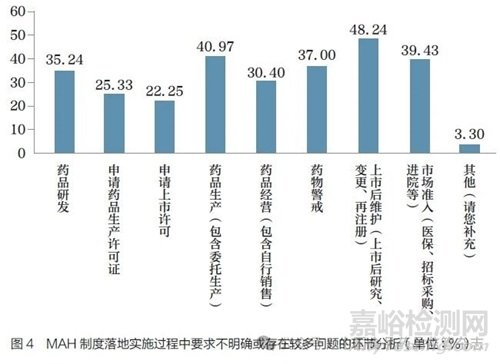
问题7 :对于MAH 制度在我国的落地实施,您认为目前以下哪些环节对MAH 的要求不明确或存在问题相对较多?[多选题]
调研结果显示(图4), 按照比例从高到低排序,MAH 制度落地实施过程中要求不明确或存在较多问题的环节依次是上市后维护(48.24%)、药品生产(40.97%)、市场准入(39.43%)、药物警戒(37.00%)、药品研发(35.24%)、药品经营(30.40%)、申请药品生产许可证(25.33%)及申请上市许可(22.25%)。此外,3.30% 的调研对象选择“其他”,基本为药品研发、生产、上市后等环节的具体问题,如境外MAH境内代理的权责分配、多产地生产和分段生产、变更过程中的主体责任及上市后风险管理计划的实施等。调研结果表明,MAH 制度在落地实施过程中,自药品研发到上市及上市后管理等各个环节均存在一定问题。问卷后续部分围绕各相关环节,有针对地开展调研分析。
2.2.1 药品临床前及临床研究阶段
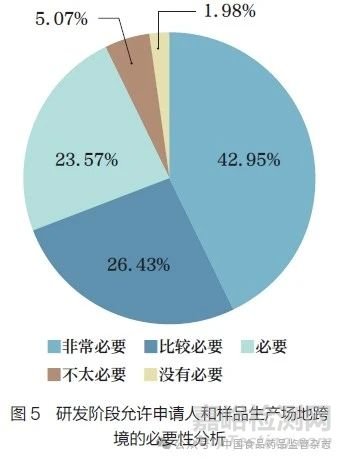
问题8 :为鼓励全球药物同步研发,在临床研究期间,对于创新药IND 申报,您认为允许申请人和样品生产场地跨境(境内申请人、境外生产,境外申请人、境内生产)情形的必要性?[ 单选题]
调研结果显示(图5),92.95% 的调研对象认为有必要(包括必要、比较必要、非常必要)允许创新药临床试验(IND)申请人和样品生产场地跨境(境内申请人境外生产或境外申请人境内生产),反映了行业内该需求的迫切性。按照调研对象所处的工作领域进行分层分析,结果无明显差异。我国目前对IND 申请人和临床样品生产场地的“跨境”尚未建立明晰的申报路径和管理要求。随着新药研发全球化进程的不断加快,全球合作和分工加速了药物创新研发模式的发展,因而临床试验期间对申办者(申请人)和临床研究样品生产场地“跨境”的需求将更加迫切。
2.2.2 申请药品生产许可证
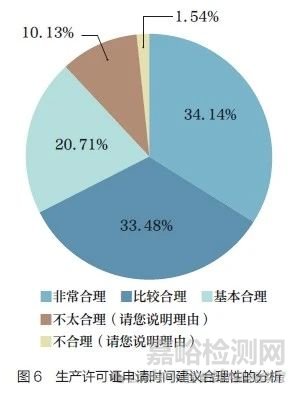
问题9 :《药品注册管理办法》规定,“申请药品上市许可时,申请人和生产企业应当已取得相应的药品生产许可证”。关于申请生产许可证的时间,如建议申请人在药品上市许可批准前申请药品生产许可证,且药品生产许可检查与GMP 符合性检查和(或)药品注册生产现场核查合并进行。您认为此建议是否合理?[ 单选题]
调研结果显示(图6),88.33% 的调研对象认为“申请人在药品上市许可批准前申请药品生产许可证,且药品生产许可检查与GMP 符合性检查和(或)药品注册生产现场核查合并进行”的建议是合理的(包括基本合理、比较合理、非常合理)。对从事不同领域工作的调研对象进行分层分析,结果无明显差异。认为该建议不合理的原因主要涉及MAH办理生产许可证的必要性和建议生产许可证不应在上市申请前获得等。这些反馈提示行业对于MAH 申办生产许可证的要求和流程仍存在不同理解,有待进一步探讨基于风险管理的解决方案。
2.2.3 申请上市许可
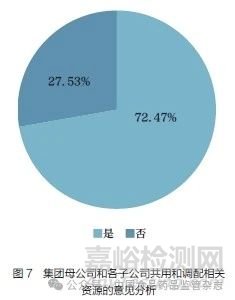
问题10 :对于集团母公司持证某子公司生产或某子公司持证其他子公司生产,且两者均在境内的情形,您认为是否应基于集团公司质量管理体系和人员属于完整体系不可分割的特点,允许集团下质量管理体系、药物警戒体系以及人员配置等在母公司和各子公司多个实体之间共用和调配,而不必要求持证的公司单一实体具备完整体系和完整人员配置?[单选题]
调研结果显示(图7),72.47% 的调研对象认为应允许集团下质量管理体系、药物警戒体系及人员配置等在母公司和各子公司间共用和调配。按调研对象所在工作领域进行分层分析,结果表明,监管领域的调研对象认可集团内资源共用的占比略低(68.75%),其余领域占比无明显差异。允许MAH 集团母公司和子公司之间资源共享可以优化资源,是体现MAH 制度优势的重要方面。同时,母公司和子公司或者各子公司之间体系、资源和关键岗位人员的共用和调配可能增加监管复杂性,需综合考虑提出优化建议。
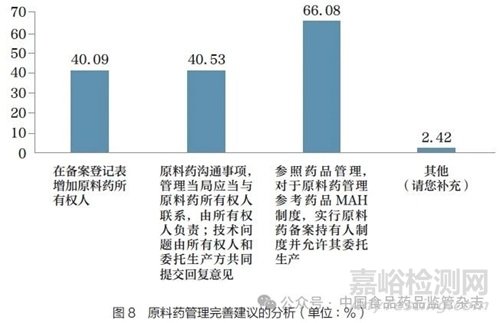
问题11 :依据《药品注册管理办法》和相关法规要求,原料药实行登记备案管理,并与制剂关联审评审批,目前是由原料药生产企业作为原料药登记人进行平台登记和维护。但是由于原料药的实际所有权人无法直接向药审中心递交原料药的登记资料,可能对原料药上市后的责任落实产生一定影响。对于此情形,您认为应从以下哪些方面进行完善?[多选题]
调研结果显示(图8),66.08% 的调研对象支持实行原料药备案持有人制度并允许委托生产;40.53% 的调研对象认为监管机构应当与原料药所有权人联系沟通申报事项,技术问题由所有权人和委托生产方共同提交回复意见;40.09% 的调研对象认为可在备案登记表中增加原料药所有权人。目前,原料药的实际所有权人无法直接向药审中心递交原料药的登记资料,对原料药生产、注册登记及上市后产品维护环节的责任落实均产生一定影响,有待探讨优化原料药管理流程。
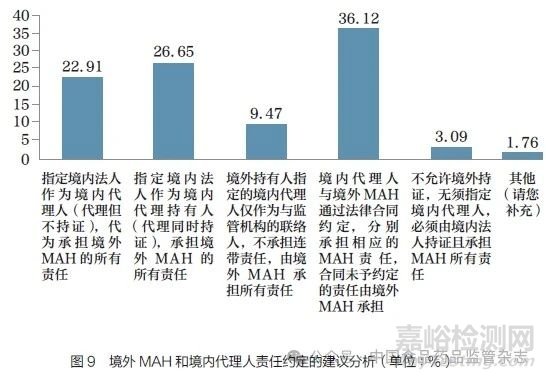
问题12 :我国《药品管理法》规定,境外MAH 指定的境内代理人须履行MAH 义务,并与MAH 承担连带责任。对于境外持证情形下,境内代理人应承担的责任,您认为以下哪种方式更合理?[单选题]
调研结果显示(图9), 对于境外MAH 和境内代理人的责任约定方式, 按照比例从高到低依次为:境内代理人与境外MAH 通过法律合同约定责任(36.12%);指定境内法人代理并持证(26.65%);指定境内法人代理但不持证(22.91%);境内代理人仅作为与监管机构的联络人,不承担连带责任(9.47%);不允许境外持证,必须由境内法人公司持证并承担MAH 所有责任(3.09%)。这一结果反映了调研对象对境外MAH 和境内代理人之间的责任归属方式,尚无统一观点。对调研对象所在工作领域进行分层分析发现,从事药品经营和市场准入的调研对象认为指定境内法人作为境内代理持有人(代理同时持证),承担境外MAH 的所有责任的比例较高。但因这两类调研对象样本量比较小(市场准入22 人,药品经营33人),对结果的解释需慎重。
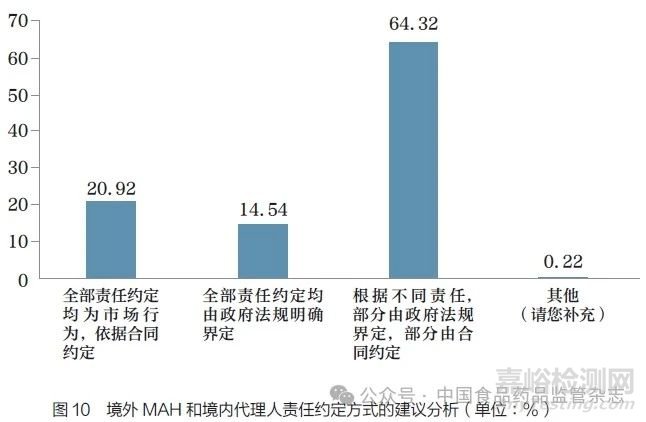
问题13 :在我国对于境外MAH 与境内代理人各自应承担的责任,您认为应采用哪种方式约定?[单选题]
调研结果显示(图10),64.32% 的调研对象认为应通过政府法规和合同两种方式来约定境外MAH 和境内代理人各自应承担的责任;20.92% 的调研对象认为全部责任约定均为市场行为,依据合同约定;14.54% 的调研对象认为全部责任约定均由政府法规明确界定。超过半数的调研对象认为应通过政府法规和合同两种方式来约定境外MAH和境内代理人各自应承担的责任,比例超过单纯使用其中一种手段来约定的情况。这一结果反映了由于境外MAH 与境内代理人的业务模式不同,单一的责任约定方式可能无法满足各相关方的利益诉求,有必要探讨多种方式并存的可行性以确保责任的落实。
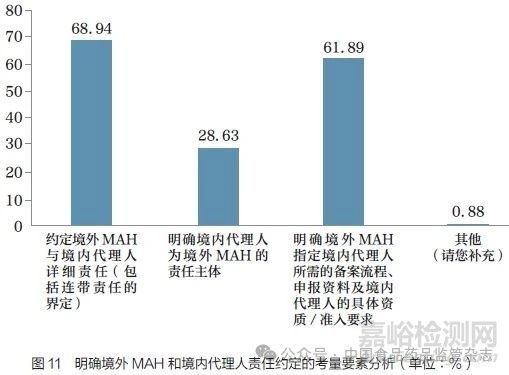
问题14 :为进一步明确境外MAH 与境内代理人的责任,您认为还应考量以下哪些要素?[多选题]
调研结果显示(图11),为进一步明确境外MAH 与境内代理人的责任, 68.94% 的调研对象认为应约定境外MAH 与境内代理人详细责任( 包括连带责任);61.89% 的调研对象认为应明确境外MAH 指定境内代理人所需的备案流程、申报资料及境内代理人的具体资质/ 准入要求;28.63% 的调研对象认为应明确境内代理人为境外MAH 的责任主体。
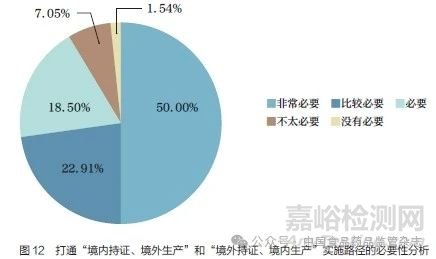
问题15 :尽管目前在法规上对“境内持证、境外生产”和“境外持证、境内生产”两种情形没有限制,但现实情况是“无路可走”。您认为是否有必要在实施层面打通“境内持证、境外生产”和“境外持证、境内生产”的实施路径?[单选题]
调研结果显示(图12),基于“境内持证、境外生产”和“境外持证、境内生产”两种情形在具体实施中存在“无路可走”的困境,91.41% 的调研对象认为有必要(包括必要、比较必要和非常必要)在实施层面打通“境内持证、境外生产”和“境外持证、境内生产”的实施路径。对从事不同领域工作的调研对象进行分层分析发现,调研结果无明显差异。
问题16 :您认为以下哪些措施或手段可以有效控制“境内持证、境外生产”路径实施的风险?[多选题]
调研结果显示(图13),针对有效控制“境内持证、境外生产”路径实施的风险,68.94%的调研对象认为MAH 应当承担药品全生命周期管理的主体责任;50.44% 的调研对象认为应通过接受部分ICH 成员国监管机构及相关国际公认组织对境外生产场地的检查结果实现对生产场地的监管;49.12% 的调研对象认为应加大我国监管机构对境外生产场地GMP 符合性检查和基于风险的注册核查的检查力度;42.95% 的调研对象认为应从监管层面加强MAH 对生产场地的审计、控制的要求;31.94% 的调研对象认为对境外生产场地可结合国情对MAH 设置额外的能力要求。“其他”建议包括以法规形式明确境外生产企业必须在满足所在国法规技术要求的基础上执行我国的法规和要求,发生争议应当按照我国的法律在我国解决。
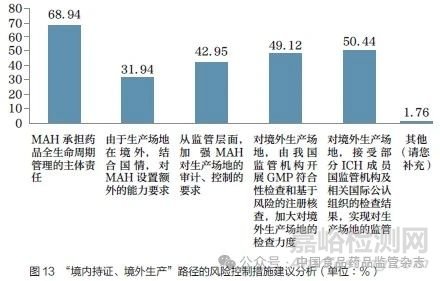
问题17 :您认为以下哪些措施或手段可以有效控制“境外持证、境内生产”路径实施的风险?(多选,最多选择2 项)[多选题]
调研结果显示(图14),为有效控制“ 境外持证、境内生产” 路径实施的风险,65.64%的调研对象认为可对境内生产场地采用与“ 境内持证、境内生产” 相同的场地管理要求;54.19% 的调研对象认为可指定境外MAH 的境内代理人为追责主体;44.93% 的调研对象认为对境外MAH 可采用与“境外持证、境外生产” 相同的管理要求。“其他”建议包括应由境外持证人负全责, 但生产场地应由所在地进行监管, 药品的定价、采购等也应按照境内生产药品进行管理。

2.2.4 药品生产质量管理
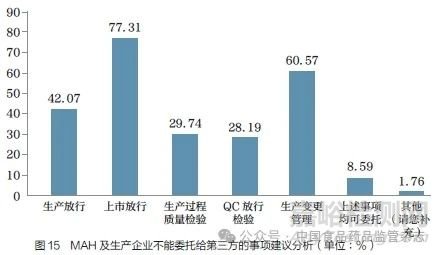
问题18 :根据《药品管理法》的规定,MAH 可以自行生产药品,也可以委托药品生产企业生产。对于委托生产的MAH(B 证MAH),从风险控制的角度,您认为MAH 及生产企业一定不能将哪些有关生产质量管理的事项委托第三方?[多选题]
调研结果显示(图15),认为上市放行不能委托的调研对象最多(77.31%),这与我国目前法规要求一致,反映了法规不允许MAH 委托上市放行的理念被大部分业内人士接受。调研对象选择不能委托第三方的事项还包括生产变更管理(60.57%)、生产放行(42.07%)、生产过程质量检验(29.74%)、QC 放行检验(28.19%)等。值得注意的是,8.59% 的调研对象认为上述事项均可委托。随着我国MAH 制度的成熟,如果MAH 作为责任主体能够完全承担药品全生命周期的风险,那么这个观点可在未来继续探讨。
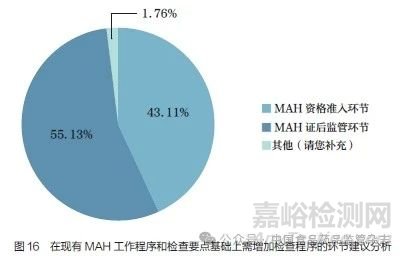
问题19 :国家药监局综合司公开征求《药品上市许可持有人检查工作程序(征求意见稿)》意见,在工作程序和核查要点的基础上,您认为还需要增加哪些环节的检查工作程序?[多选题]
调研结果显示(图16),55.13% 的调研对象认为应增加MAH 证后监管环节的检查工作;43.11% 的调研对象认为应增加MAH 资格准入环节的检查。“其他”建议包括应重点检查质量管理人员的资质和MAH 履责情况、重点加强持C 证企业(受托生产企业)的检查等,这从侧面反映了部分MAH 对受托生产企业的管控较弱。
本题设计是针对2020 年3月国家药监局综合司发布的《药品上市许可持有人检查工作程序(征求意见稿)》[5]。2022 年3 月,国家药监局综合司进一步发布《药品上市许可持有人检查要点(征求意见稿)》[6],要求MAH 应建立覆盖药品研制、生产、销售、使用全过程的管理体系,增加资格准入和证后监管。虽然《药品上市许可持有人检查要点》尚未正式颁布实施,但这些要求将促进本问卷调研所反映问题的解决。
2.2.5 药品经营质量管理
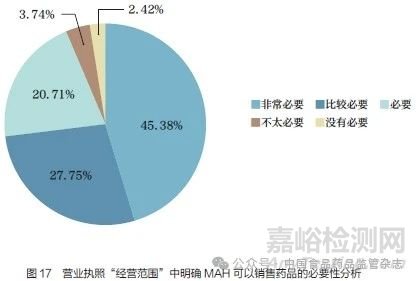
问题20 :自MAH 制度施行以来,全国部分地区已经对研发型MAH 营业执照中的经营范围做了对应调整,但针对MAH 是否可以销售药品,目前各相关方对调整后的表述和理解不太一致。为了更好地发挥MAH 制度的优势,落实MAH 责任,您认为是否有必要,在营业执照的“经营范围”中,明确MAH 可以销售药品并统一表述?[单选题]
调研结果显示(图17),93.84% 的调研对象认为有必要(包括必要、比较必要、非常必要)在营业执照的“经营范围”中明确MAH 可以销售药品并统一表述。这一建议有助于在以MAH 为责任主体的跨省经营活动中采用一致的经营业务范围,并统一对MAH 在经营环节职责的理解。
2.2.6 市场准入(医保、招标采购、进院等)
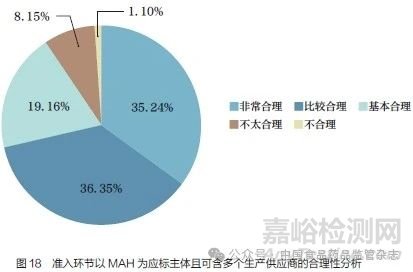
问题21 :在医保招标等环节,对于同一MAH 存在多产地生产或有多家受托企业的情形, 采用以MAH 为应标主体,且同一MAH 可包含多个生产供应商的做法。您认为是否合理?[单选题]
调研结果显示(图18),90.75% 的调研对象认为在医保招标等环节,对于同一MAH 存在多个产地或有多家受托企业情形, 采用以MAH 为应标主体,且同一MAH 可包含多个生产供应商的做法是合理的(包括基本合理、比较合理和非常合理)。从多数调研对象建议以MAH 为应标主体来看,在药品医保招标等环节明确MAH 为应标主体可以进一步强化MAH 在药品全生命周期的主体责任。
2.2.7 药物警戒质量管理
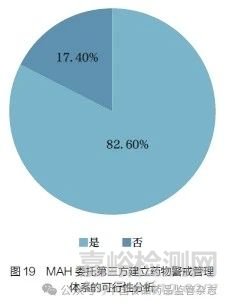
问题22 :您认为MAH 是否可以委托第三方建立药物警戒管理体系?[单选题]
调研结果显示(图19),82.60% 的调研对象认为MAH可以委托第三方建立药物警戒管理体系,17.40% 的调研对象表示不同意。2021 年5 月13 日,国家药监局颁布的《药物警戒质量管理规范》[7](GVP)是新修订的《药品管理法》实施以来首个药物警戒配套文件。GVP 规定,“持有人是药物警戒的责任主体,根据工作需要委托开展药物警戒相关工作的,相应法律责任由持有人承担”“持有人委托开展药物警戒相关工作的,双方应当签订委托协议”。目前GVP 规定可以委托第三方建立药物警戒管理体系。调研结果反映,大部分调研对象认可目前GVP 的规定。
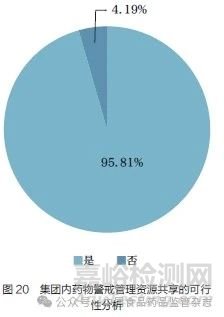
问题23 :您认为集团内各MAH 以及总部和各MAH 间,是否可以共享药物警戒管理资源?[单选题]
研结果显示(图20),95.81% 的调研对象认为集团内各MAH 以及总部和各MAH间可以共享药物警戒管理资源。GVP 规定,“ 集团内各持有人之间以及总部和各持有人之间可签订药物警戒委托协议, 也可书面约定相应职责与工作机制, 相应法律责任由持有人承担”。本调研结果与GVP 的规定一致。
2.2.8 上市后维护(上市后研究、变更、再注册)
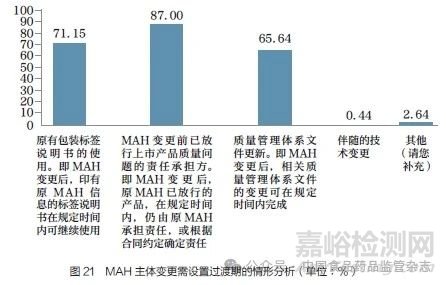
问题24 :MAH 主体的变更意味着责任变更,自批准之日起,变更后的MAH 应当承担所有责任。但是对于一些情形,从操作层面上看,可能需要设定过渡期,以便于MAH 主体的责任衔接。您认为以下哪些情形需要设置过渡期?[多选题]
调研结果显示(图21),87.00% 的调研对象认为MAH变更后原MAH 已放行的产品在规定时间内仍由原MAH 承担责任,或根据合同约定确定责任;71.15% 的调研对象认为MAH变更后印有原MAH 信息的药品标签说明书可在规定时间内继续使用;65.64% 的调研对象认为MAH 变更后相关质量管理体系文件的变更可在规定时间内完成;“其他”建议包括在产品销售环节应设过渡期,变更申请时的验证批次或变更后有效期内的产品可在过渡期内销售。这一结果反映了MAH 变更过程中新的MAH在多方面责任衔接上存在一定挑战, 并提示MAH 主体变更后,为了确保MAH 责任持续落实,应考虑在包装标签说明书的使用、变更前已放行产品质量责任承担、质量管理体系文件更新等方面给予过渡期,同时新的MAH 在变更时应做好准备,确保能够承担变更后MAH 的相应责任。
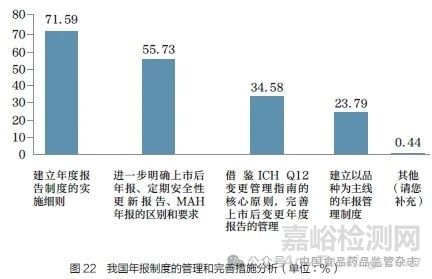
问题25 :您认为下述哪些措施有利于我国年报制度的管理和完善?[多选题]
调研结果显示(图22),71.59% 的调研对象认为应建立年度报告制度的实施细则;55.73% 的调研对象认为应进一步明确上市后年报、定期安全性更新报告、MAH 年报的区别和要求;34.58% 的调研对象认为应借鉴ICH Q12 变更管理指南的核心原则,完善上市后变更年报的管理;23.79% 的调研对象认为应建立以品种为主线的年报管理制度。在本次调研完成后,2022年4 月12 日国家药监局发布《药品年度报告管理规定》[8],基本上明确了年报实施的细则,完善了上市后变更管理,建立了以品种为主线的年报管理制度,要求相对明确。
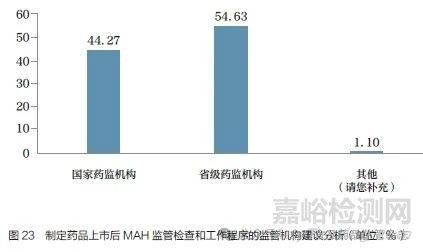
问题26 :关于药品上市后对MAH 的监管检查与工作程序,您认为应由哪级监管机构制定?[单选题]
调研结果显示(图23),54.63% 的调研对象认为应由省级药监局制定监督检查的工作程序。省级药监局制定工作程序对于不涉及跨省的MAH 和生产企业比较便利,企业与省级药监局的沟通比较紧密,能更好地了解相应细则的制定依据,出现问题时企业也能及时反馈。省级药监局制定MAH 上市后监管相关工作程序也是目前我国采用的监管方式,可以满足大部分的企业需求。44.27% 的调研对象认为应由国家药监局制定工作程序,其中从事药品监管工作的调研对象选择由国家药监局制定工作程序的比例较高(63.54%)。“其他”建议包括以国家药监局为主制定监管细则和工作程序,由省级药监局负责属地MAH 管理及日常监督。这些建议也反映了不同省级药监局在上市后监管中要求不尽一致,给跨省管理造成不便。部分调研对象建议允许片区统一管理,如粤港澳大湾区、京津冀、江浙沪等,并在区域内建立专门的审查员队伍。
2.2.9 MAH 监管
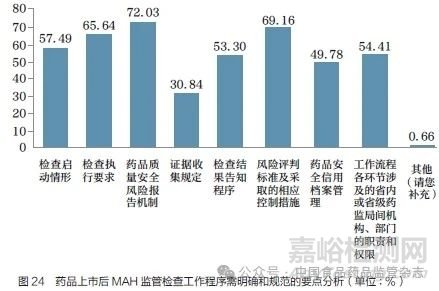
问题27 :若要建立药品上市后对MAH 的监管检查的工作程序,您认为应对哪些方面加以规范和明确?[多选题]
国家药监局综合司于2020年3 月2 日发布了《药品上市许可持有人检查工作程序(征求意见稿)》[5],其中对MAH 检查启动情形、执行要求、证据收集、结果告知、风险评判标准、省级药监局内部和不同省级药监局间的职责等尚不明确。调研结果(图24)反映了行业对以下3 个方面的诉求:①逐步细化对MAH 上市后监管检查的工作程序,包括明确风险评判标准及相应的控制措施(69.16%);明确检查执行要求(65.64%);细化检查启动情形(57.49%);明确检查结果告知程序(53.30%);明确规定证据收集相关程序(30.84%)等。②建立与MAH 监督检查相应的配套措施,进一步完善药品质量安全风险报告机制(72.03%),建立健全药品安全信用档案管理(49.78%)。③明确各省级药监局的职责和权限,54.41% 的调研对象建议明确各环节涉及的省内或省级药监局间机构部门的职责和权限。
本次调研在2021 年9 月完成。上述建议在2021 年5 月发布的《药品检查管理办法(试行)》[9]中已基本涵盖。
2.3 关于责任赔偿的专题调研
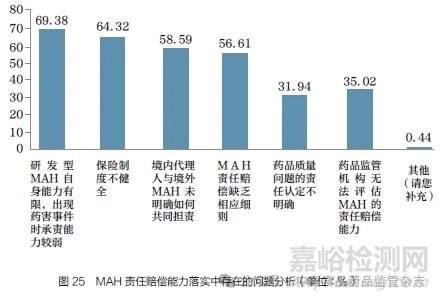
问题28 :对于MAH 责任赔偿能力的有效落实,您认为目前存在哪些突出问题?[多选题]
调研结果显示(图25),69.38% 的调研对象认为研发型MAH 承担药害事件责任的能力较弱;64.32% 的调研对象认为保险制度不健全;58.59% 的调研对象认为境内代理与境外MAH的责任不明确;56.61% 的调研对象认为缺乏MAH 赔偿细则;35.02% 的调研对象认为药品监管机构无法评估MAH 的责任赔偿能力;31.94% 的调研对象认为药品质量问题的责任认定不明确。由此可见,为有效落实MAH责任赔偿能力,我国应从各方面提升,如加强研发型MAH 承责能力、界定境内代理人与境外MAH 的责任、明确药品质量问题的责任认定、出台相应的赔偿细则等。
问题29 :为了落实MAH 的赔偿责任,您认为是否应借鉴国外监管经验,通过司法途径实现?[单选题]
调研结果显示(图26),82.16% 的调研对象认为应借鉴国外监管经验,通过司法途径实现,以更好地落实MAH 的赔偿责任。

问题30 :您认为MAH 的责任赔偿能力可从以下哪些途径实现?[多选题]
本题选项设置参考了其他国家为加强MAH 责任赔偿能力所制定的制度。调研结果显示(图27),支持采用保险机构承保方式来加强MAH 的责任赔偿能力的调研对象比例最高(83.26%),其次是建议通过MAH 自身资产保证(64.32%),支持救助基金(25.11%)和其他企业关联担保(11.89%)的方式比例较少。这反映了我国目前责任赔偿方式的现状,通过保险和自身资产担保是我国目前主要的赔偿方式。“其他”建议包括应设立药品质量安全强制保险制度,对企业无责的严重不良反应或有责任的药害事件的基础赔偿作出统一规定;应检查MAH 保险情况,通过监管手段确保MAH 具有赔偿能力。

2022 年3 月发布的《药品上市许可持有人检查要点(征求意见稿)》提出:“持有人应当具备法律要求的责任赔偿能力,建立责任赔偿的相关管理程序和制度,实行赔偿首负责任制。责任赔偿能力应当与产品的风险程度、市场规模和侵权损害人身伤残赔偿标准等因素相匹配。持有人应当具有责任赔偿能力相关证明或者相应的保险购买意向书、商业保险购买合同等。” 药品不良反应引起的责任赔偿金额巨大,需要全方位、多元化的模式来保证有效赔偿。
问题31 :如在我国引入救济基金制度,您认为救济基金的主导机构应为?[单选题]
调研结果显示(图28),如果在我国引入救济基金制度,35.90% 的调研对象选择政府部门指定的第三方非营利机构作为救济基金的主导机构;29.30%的调研对象选择政府部门作为主导机构;22.03% 的调研对象选择保险公司作为主导机构;12.33% 的调研对象选择社会非营利机构作为主导机构。

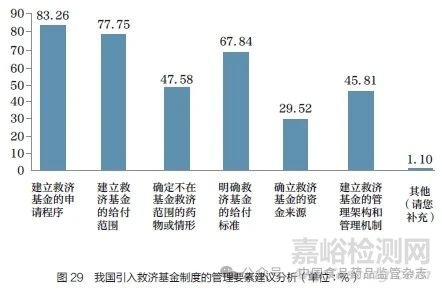
问题32 :如果在我国引入救济基金制度,您认为应该明确哪些管理要素?[多选题,最多选择4 项]
调研结果显示(图29),83.26% 的调研对象认为应建立救济基金的申请程序;77.75%的调研对象认为应建立救济基金的给付范围;67.84% 的调研对象认为应明确救济基金的给付标准;47.58% 的调研对象认为应确定不在救济基金范围的药物或情形;45.81% 的调研对象认为应建立救济基金的管理架构和管理机制;29.52% 的调研对象认为应建立救济基金的资金来源。调研结果提示,我国如果引入救济基金制度,应采取全面措施,建立基金管理架构和管理机制,明确救济基金的申请程序、给付范围、给付标准、资金来源,确定不在救济基金范围的药物及情形等。
2.4 开放问题
问题33 :关于MAH 制度的落地实施,您还有哪些建议?[ 问答题]
此题共收集有效回答49 条,除前述问卷涵盖的内容外,还包括:明确MAH 的准入条件,确保质量管理、风险评估控制、药物警戒、责任赔偿、应急事故处理能力等;全国范围内建立统一标准的政策,确保各省(自治区、直辖市)监管、准入、医保等产业链相关政策的协同配套等。
3、 结语
MAH 制度在我国尚处于起步阶段。从调研结果可以看出,尽管国家药监局和各省级药监局出台了多项法规细则解决了很多问题,但现阶段我国MAH 制度在药品全生命周期管理和监管方面仍存在一些突出的问题, 如MAH 和受托生产企业跨境管理路径尚未建立、委托他人生产的MAH 药品生产许可证申办时间的合理性、原料药管理需要进一步探索合适的方式,经营和准入环节MAH 主体身份的合理体现以及MAH 责任赔偿如何更好地落地等。

来源:中国食品药品监管杂志


