您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-21 11:45
英国东安格利亚大学(UEA) 的研究人员在眼科耗材技术方面取得了重大突破,开发了一种用于 3D 打印眼内植入物的新型树脂。这项创新可以提高用于白内障和屈光手术眼内植入物的开发及生产效率。
前言
2024年5月19日,来自英国东安格利亚大学的研究团队在「Current Eye Research 」发表研究成果「Stereolithographic Rapid Prototyping of Clear, Foldable, Non-Refractive Intraocular Lens Designs: A Proof-of-Concept Study」即「立体光刻快速成型透明、可折叠、非屈光性人工晶状体设计:概念验证研究」。研究团队成员有来自生物科学学院和药学院的研究人员。
总的来说,研究人员开发了一种基于立体光刻技术的工艺,用于生成不具有屈光性能的透明晶状体设计模型,作为概念验证。这一过程有可能促进新型人工晶体的开发,允许无限的设计迭代,并为科学家们探索更广泛的材料提供可能性。研究人员开发了一种含有丙烯酸 2-苯氧基乙酯、聚乙二醇二甲基丙烯酸酯和合适光引发剂的光聚合树脂,用于生产类似透镜的 3D 物体原型,并使用立体光刻 (SLA) 技术成功制造了不具有折射功能且具有环触觉设计的一体式类透镜 3D 物体。根据紫外光谱测定,所得 3D 物体是透明的。乳酸脱氢酶测试证明了晶状体细胞对原型材料的耐受性,并且在体外直接注入人体囊袋模型时,观察到了明显的可折叠性和形状恢复。这项原理验证研究证明了快速原型制作过程对于研究和开发类透镜 3D 物体原型(例如人工晶状体)的潜力和意义。
在看文章前,我们先来理解下什么是Stereolithographic(Stereolithography)。立体光刻技术(SLA,Stereolithography Appearance)是应用最广泛的快速原型技术。它可以生产高度精确和细节丰富的聚合物部件。这是首个快速成型工艺,由 3D Systems公司在发明家 Charles Hull 工作基础上于 1988 年推出。SLA使用低功率、高度聚焦的紫外激光在一桶液体光敏聚合物中逐层勾画出三维物体的连续横截面。当激光勾画层时,聚合物固化,剩余区域保持液态。当一层完成后,平整刀片在表面上移动以使其平滑,然后再勾画沉积下一层。平台下降一个等于层厚度(通常为0.003-0.002英寸)的距离,随后一层形成在先前完成的层之上。这一勾画和平整的过程重复进行,直到构建完成。完成后,部件被提升出液槽并排干。多余的聚合物被拭去或冲洗掉。在许多情况下,通过将部件置于紫外线烤箱中进行最终固化。最终固化后,从部件上切下支撑件,并对表面进行抛光、打磨或其他精加工。
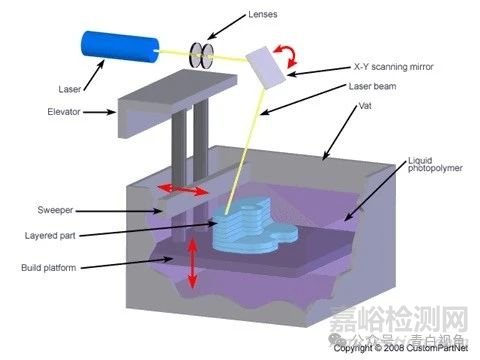
图源:custompartnet
研究介绍
2.1 背景
白内障是一种晶状体混浊,是全世界导致失明的主要原因。1,2超过 50% 的失明是由这种病理引起的,在老年人群中患病率更高。因此,由于发达国家预期寿命的延长,白内障的发病率预计只会上升。1目前,白内障唯一有效的治疗方法是手术。3在白内障手术期间,通过执行撕囊技术在晶状体前囊中形成一个圆形开口(直径约 5 毫米)。然后通过超声乳化术乳化并提取白内障晶状体。4然后将人工晶状体(IOL)植入囊袋内,以恢复自然晶状体的屈光力。5在此过程之后,光线可以自由地穿过透明的植入人工晶状体。6这使得在视网膜中形成高质量的视觉图像并随后提高视力。7,8
IOL 由位于视轴内并提供屈光特性的光学元件和在囊袋内提供支撑和稳定性的触觉元件组成。9目前,人工晶状体的制造使用了多种材料。它们可以是刚性疏水聚合物,例如聚甲基丙烯酸甲酯 (PMMA),也可以是柔性材料,例如丙烯酸树脂、有机硅和水凝胶。10使用具有高折射率的柔性生物材料可以通过较小的切口植入人工晶状体,这对眼睛的破坏较小,并且与较低的术后炎症有关。因此,植入可折叠人工晶状体比植入刚性人工晶状体更可取。9同样,有不同的人工晶状体设计用于植入眼前节的不同部位。这些包括单件或多件配置、板式触觉或开环式以及有角度或平面触觉设计。11,12
IOL 的制造主要采用模压法和车床法。13,14模制人工晶状体是通过将可聚合树脂倒入模具中并加热以引发材料的热聚合来生产的。13另一方面,车床加工涉及生产棒材,这些棒材被切割成盘形结构,然后用车床加工以生产 IOL。15,16一旦形成,人工晶状体就会被抛光,以去除任何可能损害人工晶状体表面光滑度的伪影,同时保留锋利的边缘。13,14虽然利用这些制造技术可以生产出高质量的人工晶状体,但它们也有许多缺点,特别是在制作新的人工晶状体设计原型时。首先,这些方法特别耗时,因为它们需要高要求的清洁程序和多个步骤的执行。17在成型的情况下,由于聚合物从模具中溢出,人工晶状体的边缘可能会形成伪影。如果在植入前不将其移除,可能会对眼内组织造成损害。18另一个问题是与使用专业设备相关的高成本,这些设备经常因损坏和磨损而需要更换。17 这些限制使得人们希望寻求更快且更具成本效益的人工晶状体生产技术。
增材制造允许通过逐层沉积材料直至形成整个结构来制造在计算机辅助设计(CAD)软件上设计的物体。19,20在目前可用的不同类型的增材制造技术中,SLA 通常是制造镜片的首选方法。21该工艺有许多优点,包括高分辨率和制造速度、可使用材料的多功能性以及同时使用它们的可能性。22这些属性使 SLA 成为一种有前途的技术,可加速新型 IOL 原型的生产。
虽然之前的研究已经尝试使用增材制造技术来生产 IOL,但没有一篇研究分析过制造商用模型的结构以及对特定原型的物理化学、机械和生物特性的分析。23–25研究人员在此报告了一种通过SLA 使用内部开发的光聚合配方用于生产和表征类透镜 3D 物体的方法。使用这种材料可以生产出具有此类植入物所需机械性能的透明装置。体外测试了材料的细胞相容性,证明聚合物不会对晶状体上皮细胞引起毒性反应。因此,这项概念验证研究表明,尽管应谨慎选择适当的技术,但可以使用 SLA 所用的材料来生产类似透镜的 3D 物体。此外,还建立了一套表征技术,并适用于使用非专业设备对打印植入物进行分析。研究结果表明,在考虑将其应用于制造屈光性人工晶状体(IOL)之前,该过程还需要改进和额外的测试。然而,它仍然适合生产原型,有可能帮助研究人员开发创新的治疗植入物耗材,以应对特定的临床挑战。
总结来说,白内障作为全球主要的致盲原因,促使了人工晶状体制造技术的发展。传统的模压法和车床法虽然能够生产高质量的IOL,但在制造新设计原型时存在许多局限性。增材制造特别是SLA技术的应用,为快速、成本效益高的IOL生产提供了新的可能性。尽管目前还需要进一步研究和改进,但SLA技术有望在未来的IOL设计和生产中发挥重要作用,促进治疗植入物的创新发展。
2.2 研究内容
2.2.1 材料和方法(略)
2.2.2 结果
2.2.2.1 制作没有折射功能的类似透镜的 3D 物体原型
SLA 成功生产了以标准 IOL 设计为模型的植入式装置。使用 Blender 创建不具有折射功能的类透镜 3D 物体的 CAD 模型。该模型基于带有环形触觉的一体式 IOL;在这种情况下,光学部件的两面都是平坦的(图1)。触觉到触觉的长度为13毫米,光学直径为6毫米,厚度设定为0.9毫米。这些器件的制造采用了由丙烯酸 2-苯氧基乙酯 (POEA) 和聚乙二醇二甲基丙烯酸酯 (PEGDMA) 组成的树脂。进行了一项试点研究以优化树脂的成分。选择含有 93% (w/w) POEA 和 7% (w/w) PEGDMA 的配方来制造植入物。在这些实验中测试的所有配方中,光引发剂与树脂总质量的比例保持在额外的 1% (w/w)。
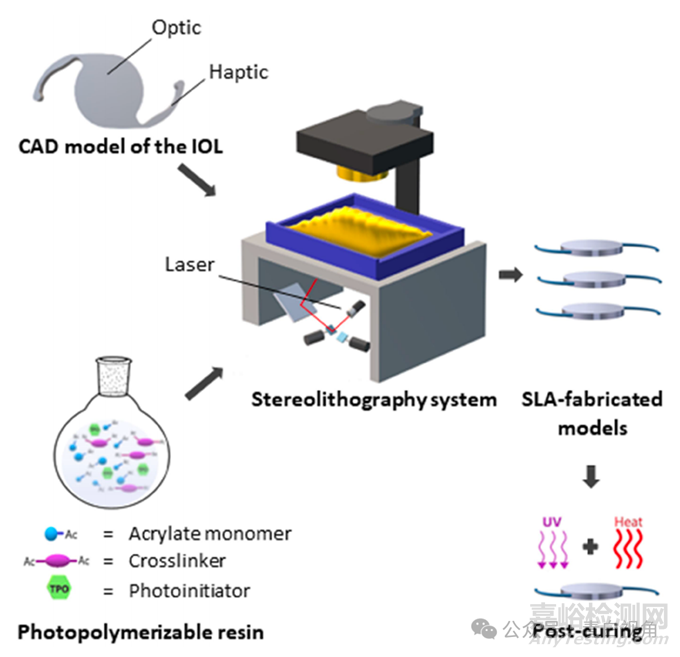
图1:通过立体光刻技术生产不具有折射功能的类透镜 3D 物体的示意图。为此开发并使用了由丙烯酸酯单体和交联剂组成的树脂。
制造完成后,使用标准校准数字卡尺测量植入物的尺寸。打印器件与CAD模型的尺寸对比精度为光学直径94.5%,厚度比CAD模型理论尺寸高64%。这些数据表明,尽管该装置制造成功,但尺寸精度受到影响。
2.2.2.2后固化效率评估
打印的器件经过后固化过程,以去除聚合物结构中残留的任何未反应的单体。通过在 d-氯仿中孵育完全或部分后固化的样品并随后使用以下方法检测浸入溶剂中的单体来监测该过程的效率:1核磁共振氢谱。该实验还用于确定聚合残余单体所需的紫外线照射和加热的最短时间。结果表明,紫外线照射1小时后,未反应分子的数量大幅减少,但随着照射时间的延长,未反应分子的数量并没有进一步减少(图2)。因此,得出的结论是,热后固化对于完成聚合物内残留单体的聚合是必要的。从光谱中可以看出,在真空中加热4小时后没有检测到单体分子。
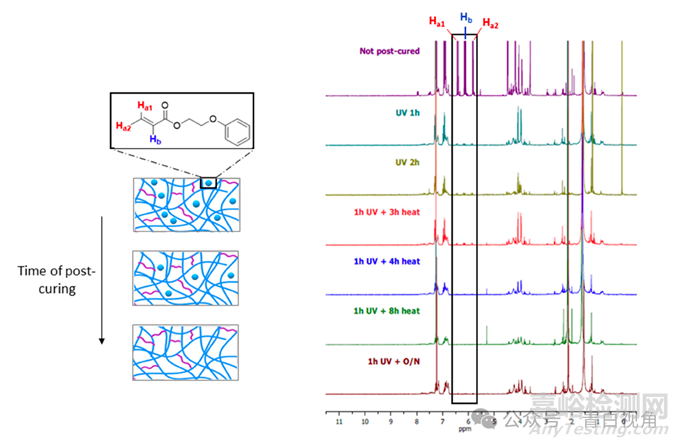
图2:1H NMR 光谱是通过对经过不同阶段的后固化过程(用 405 nm 紫外/可见光照射 1 小时并在 80 °C 下加热)的打印类 IOL 器件的孵化介质进行分析而获得的。4.8-5.2 ppm 处的信号强度(以黑色矩形突出显示)是由从聚合物中浸出的剩余未反应单体的烯基产生的,随着后固化时间的延长而降低。
2.2.2.3 无折射功能的类透镜 3D 物体的物理化学表征
玻璃化转变温度(时间G)的印刷聚合物通过 DSC 进行评估。根据结果(图3(A)), 这时间G形成印刷器件的交联聚合物的温度为 4.85 ± 1.09 °C,这表明该材料在室温下可能是橡胶状且柔韧的。
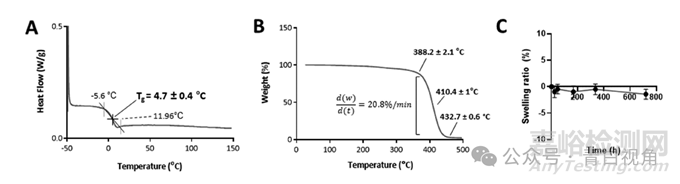
图3:形成 SLA 制造植入物的生物材料的物理化学特性。这时间G是从 DSC 分析的第三个加热循环中获得的,值为 4.7 ± 0.4 °C (n = 3) (A)。聚合物热重分析得出的热分析图显示,它在 388.2 ± 2.1 °C 时开始降解(n = 3) (B)。描绘一个月内溶胀比变化的线图表明,聚合物在这段时间内没有吸收任何水(n = 4) (C)。
通过热重分析(TGA)评估聚合物的热稳定性。据资料显示(图3(B)),交联聚合物在〜382.4±2.17°C开始分解。降解发生在一步中,在~450°C 时完成。最后,通过体外进行膨胀测试来评估植入物在类似于房水的环境中的行为。将打印的装置在 35°C 的 PBS(pH 7.4)中孵育 1 个月,并记录不同点的重量。由于它们的重量在整个分析过程中保持恒定(图3(C)),得出的结论是,由于其高疏水性,该装置不吸收任何水。测量的高水接触角证实了这一点通过座滴技术,其平均值为 82.3 ± 3.2°。这与商业 IOL AcrySof® 的水接触角相当,即 84.4 ± 0.09°。27
2.2.2.4 光学表征
通过测量材料的光学透射率来研究打印的透镜状模型的透明度。分析结果表明,植入物透射了它们所暴露的 80-85% 的可见光(图4(A))。紫外线灭菌导致透光率下降 3%。还通过在网格线背景下对器件进行成像来评估器件的光学特性(图4(B))。这表明,根据透射率测量获得的结果,植入物相对透明并且允许网格线可视化。
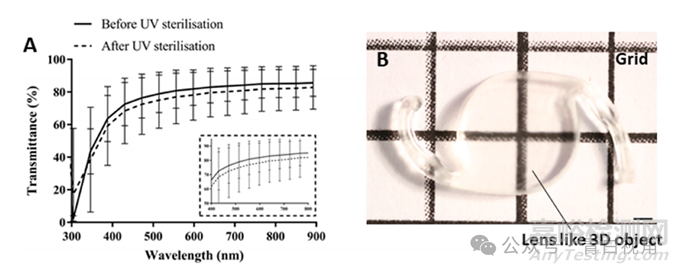
图4:打印的透镜状 3D 物体的光学特性。(A) 灭菌前后装置的光谱透射率。将一组植入物用紫外线照射消毒 1 小时,并将其透光率与未消毒的植入物进行比较。光谱表明,印刷器件允许可见光范围(380-700 nm)内的光透射,并且紫外线灭菌过程使光透射率略微降低约 3%。获得透光率 (%),并针对 300–900 nm 的波长范围进行表示。数据表示为平均值± 标清(n = 9)。(B) 在类似 IOL 的印刷物体后面看到的网格的视觉清晰度。比例尺代表 1 毫米。
2.2.2.5 机械特性
触觉拉伸强度测试表明,干燥时这些结构在与光学部件分离之前承受的力为 0.56 ± 0.07 N并且在 37°C 的 PBS 中孵育后,该值降低至 0.39 ± 0.05 N。在这两种情况下,它们均符合 ISO 11979-3 规定的 0.25 N 最小值。
2.2.2.6 形态学评价
使用扫描电子显微镜(SEM)评估打印的透镜状物体的形态。装置的中心部件保持光滑的圆形形状,并且其上表面相对均匀(图5(A))。同样,也可以观察到触觉的明确定义(图5(B))。触觉部分和光学部分的垂直边缘都是平坦且一致的。然而,垂直边缘和水平表面相交的点在外观上是圆形的,没有形成尖锐的方形边缘,这是一些 IOL 制造商所青睐的特征(图5(C))。
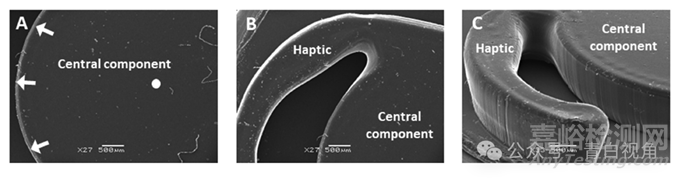
图5:扫描电子显微镜图像显示了打印和后固化的人工晶体植入物的特征。左侧是中心组件的俯视图,白色箭头突出显示外边缘,白色圆圈标记该部分的中心 (A)。中间是触觉部件和中央部件 (B) 之间连接处的俯视图。右侧是中心部分和植入物触觉之一的斜角图像。请注意,该图像捕获了中心组件和触觉 (C) 的垂直边缘。
2.2.2.7 打印植入物的生物相容性
研究了后固化过程对打印类晶状体模型生物相容性的影响体外。未进行后固化或已经历不同阶段的后固化方案的样品与 FHL-124 晶状体细胞共孵育 48 小时体外。在此时间段之后,进行LDH测试。在未使用后固化聚合物孵育的细胞中检测到培养基中 LDH 浓度最高。这些水平与对照显著不同,正如方差分析和 Tukey 测试所证实的那样(p ˂0.05)。图6结果表明,当细胞在经过紫外线后固化的聚合物存在下培养时,LDH 水平显著下降。当装置在经历紫外线照射步骤后在真空中加热时,细胞死亡水平似乎进一步降低,使得细胞死亡与仅细胞对照细胞没有显著不同。还观察到热处理持续时间的增加导致植入物的毒性降低。当聚合物装置在紫外线照射后加热过夜时,检测到最低的细胞毒性。在该实验组中,细胞死亡水平与仅细胞的阴性对照相当。因此,得出的结论是,必须用紫外线照射装置 1 小时并在真空中加热过夜,以尽量减少这些装置引起的毒性。
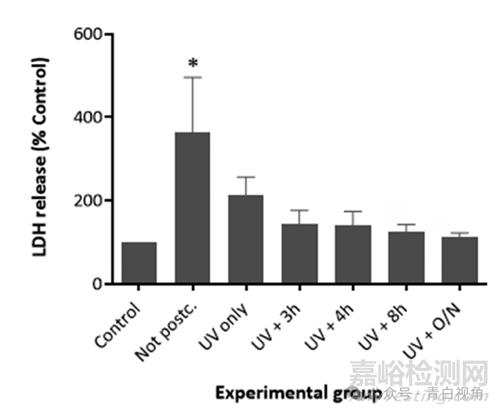
图6:通过使用晶状体细胞系 FHL-124 进行 LDH 测试来分析印刷器件的细胞毒性。结果表明,用紫外线/可见光 (405 nm) 处理镜片并在 80 °C 下加热可降低材料的细胞毒性。仅在后固化聚合物组中观察到细胞毒性显著增加。所有其他处理组中的LDH释放与对照(无聚合物)相当。细胞毒性通过使用市售试剂盒(Roche)在48小时的孵育期后释放的总LDH来评估。数据表示为平均值±SEM(n = 9)并标准化为对照组。* 表示与控制有显着差异(p < 0.05,单向方差分析与 Tukey 检验)。
2.2.2.8 将 SLA 制造的晶状体模型体外植入人体囊袋中
为了模拟临床情景,打印的类晶状体物体被折叠并装入IOL注射系统,然后射入含有PBS的培养皿中(图7)。注射后,折叠的植入物展开并恢复其自然形状,而不影响其结构特性。

图7。数字视频的多个帧显示了从手术注射器中输送类似透镜的 3D 物体。前三张图像 (A–C) 显示了原型(用箭头表示),位于注射器内部并被输送到水介质中。植入物从注射器释放后展开(D,E),直到恢复其原始形状(F)。
已经证明打印设备可以通过临床工具成功递送,下一步是展示打印原型可以植入囊袋(图8)。为此,使用了人类囊袋模型。该系统通过体外进行模拟白内障手术生成。使用标准的IOL注射器成功地将一个打印的类晶状体物体植入囊袋中,且囊袋没有破裂。植入物位置居中,没有引起囊袋的异常变形。
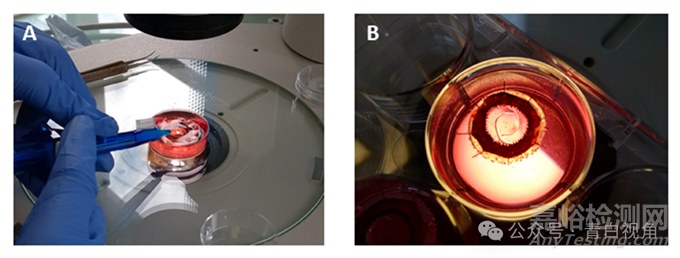
图8:数字图像显示了在体外人类囊袋模型中植入打印的类IOL装置的过程。图像(A)中可以看到植入物递送到囊袋中的过程。一旦植入囊袋,植入物恢复了其原始形状,并且没有引起囊袋的任何变形(B)。
2.2.3 讨论
虽然当前的 IOL 制造技术可以生产出高质量的产品,但原型设计和制造方法还有很大的改进空间。在当前实践中,新颖设计的生产需要制造新模具或其他专业设备,从而产生相关费用和漫长的制造时间。此外,容纳制造设备所需的大空间使得研究人员更难接近。这阻碍了新型人工晶状体的开发,其设计和材料性能的改进可以预防术后并发症。使用 SLA 快速制造 IOL 可以加速原型制作过程,从而无需模制或大量车削程序。虽然之前的研究尝试使用 SLA 来生产 IOL,但这些研究并未提供尺寸精度、机械性能和生物相容性的定量评估。因此,所得植入物的功能并未得到证实。
本研究的原理验证研究旨在展示使用 SLA 技术生产 IOL 原型,以及可打印材料形成可满足某些要求(例如生物相容性和机械强度)的 IOL 的潜力。在考虑进入其应用的进一步阶段之前,研究人员还分析了需要改进的方面。
为了演示该过程,研究人员制作了一个带有光学区域和环形触觉的标准 IOL 设计。研究人员选择 POEA 作为主要单体,PEGDMA 作为交联剂来制造类似 IOL 的植入物。POEA 是合适的,因为它是一种具有相对较高折射率 (1.52) 的芳香族单体,而 PEGDMA 是一种脂肪族双功能交联剂,可掺入混合物中以获得具有合适机械性能的原型。
一旦打印出类似人工晶状体的模型,就会研究理论尺寸和物理尺寸之间的准确性。尽管植入物的所有部件均已成功制造,但打印设备的物理尺寸与 CAD 模型的物理尺寸不同。SLA 制造的模型中心部件直径的平均精度为 94.5 ± 0.4%。然而,该器件的厚度比 CAD 模型的厚度高 64 ± 7.8%。这表明需要进一步优化来限制紫外线对树脂的穿透深度。使用构建平台有利于限制固化深度,但会导致逐层制造,从而影响物体的光学质量。然而,3D 打印行业的持续创新促进了高分辨率打印机的发展,这些打印机的功能使其与光学设备的制造更加兼容。使用此类系统制造人工晶状体,再加上本工作中报告的配方和表征方法,可以加速创建新人工晶状体原型并将其推进临床前测试阶段的过程。
接下来,研究人员对打印的透镜状物体进行后固化过程,以完成任何未反应的单体或聚合物链的聚合,因为这将提高机械强度和生物相容性。通过用紫外线照射器件并在 70°C 的真空烘箱中加热,对器件进行后固化。暴露在紫外线下会激活未反应单体和聚合物链之间化学键的形成。真空下加热加速了这一过程,同时防止了氧气产生的抑制作用。NMR 分析和 LDH 细胞毒性测试表明,确保耗尽未反应单体所需的最佳后固化时间是 UV 照射 1 小时,然后在真空烘箱中孵育过夜。细胞毒性测定表明,未经后固化的聚合物植入物引起的毒性水平显著高于阴性对照,阴性对照不包含任何与细胞接触的装置。另一方面,过夜后固化的植入物引起的细胞死亡水平显著降低,与阴性对照的细胞死亡水平相当。因此,得出的结论是,后固化方案通过消除 SLA 后残留在聚合物内的未反应单体,提高了打印设备的生物相容性。
通过进行物理化学表征来评估所制造的原型在白内障手术中的适用性。通过在35℃(人眼的温度)的水介质中进行溶胀测试来计算平衡含水量。由于其疏水性,类晶状体模型的聚合物结构不吸收任何水。这可能有利于防止某些人工晶状体中出现的反光现象,并有利于晶状体在植入囊袋后保持其尺寸。评估了设备的透明度通过光学成像并通过测量光谱透射率。这表明它们是光学透明的,尽管它们的透明度比 AcrySof ®人工晶状体低约 10%。28然而,值得注意的是,本生产制作没有抛光步骤。
IOL用于白内障手术还需要具备其他特性,包括可折叠/展开并且触觉部分在从光学部分分离前能够承受0.25N的力。这将使植入物能够在通过小切口注入时承受的机械应力。打印样品的DSC分析显示,用于制造人工晶状体(IOL)的聚合物具有4.7 ± 0.4°C的玻璃转变温度(Tg)。确定Tg至关重要,因为它表示聚合物从硬脆状态转变为更柔软和灵活的状态的温度。这种灵活性对于IOL至关重要,因为在白内障手术期间需要将其折叠以便通过小切口插入。Tg的一致性,通过其狭窄的范围得出的建议,确保了聚合物在关键的折叠和插入阶段中将表现出可预测的行为。
此外,DSC曲线提供了-5.6°C的起始温度和11.96°C的结束温度,表明聚合物在远低于室温的温度开始软化,并在正常生理温度以上保持灵活性。这种特性对于手术中IOL的操控至关重要,因为它使得能够轻松处理,而不会影响材料在眼内定位后恢复原状的能力。
通过机械测试,研究人员证实了IOL的触觉部分能够在从光学部分分离之前承受明显高于0.25 N阈值的拉力。这种在热和机械方面的坚固性对于在通过小切口注射期间承受的机械应力至关重要,特别是在乳化技术用于IOL植入的白内障手术中。进一步的化学表征包括TGA,确认了形成植入物的聚合物具有高热稳定性。使用扫描电镜评估了打印设备的形态。通过这种技术获得的图像显示了设备的所有部件都以相对较好的分辨率成功制造出来。通常,设备的表面是光滑平坦的,尽管这些模型中没有形成预防继发性白内障所需的方形边缘。
最后,使用离体人类囊袋模型进行了植入测试,以评估这些设备在注射过程承受的机械应力的抗性。SLA制造的类透镜状物体使用手术注射器注入囊袋。因此,通过临床仪器使用这些设备在人眼中的可植入性得到了证实,因为它们具有在此过程中承受的适当的柔韧性和机械强度。此外,还确认了植入物的尺寸足够适合植入,不会引起囊袋的异常拉伸或变形,这可能会影响其光学性能。
2.3 结论
这项概念验证研究表明,SLA技术可用于直接和快速制造具有相对高精度、良好透明度、可折叠性和生物相容性的类IOL物体。本研究已经证明了可以快速原型化IOL,无需首先开发特定的IOL模具或进行复杂的车削过程。因此,这将促进创造出使用传统制造方法很难原型化的新型IOL设计。这项研究产生的模型具有光学清晰、疏水性,并且满足ISO 11979-3所建立的触觉拉力要求。体外进行的LDH分析确认了与后期固化聚合物设备接触的细胞中不存在毒性反应。本研究还展示了在体外先进人类囊袋模型中制造设备的可折叠性和可植入性。然而,需要进一步研究以提高打印分辨率,以改善尺寸准确性,另外未来需要优化的其他方面还包括工艺的可扩展性和可重复性。
评析
该创新研究将材料科学与医疗诊疗需求相结合,需要广泛的跨专业知识融合来合作开发这些类型的眼科耗材和设备。
上述概念验证论文是UEA关于「快速3D打印技术在人工晶状体设计中的应用」---「基于快速计算机辅助设计、3D 打印配方和打印后精加工工艺的人工晶状体 (IOL) 原型开发新工艺」研究系列中的开篇。接下来,研究团队将在扩大化生产和提高打印分辨率以改善尺寸精度上继续努力。进入到临床试验阶段还需要数年时间。
IOL 的历史和现有制备材料,包括PMMA和硅胶,近年来主要使用丙烯酸脂材料。目前,因具有优良的光学透性、生物相容性以及在眼内的稳定性和安全性,亲水性丙烯酸酯(水凝胶)和疏水性丙烯酸酯是最常用的材料。当前制造IOL的方法使用车削和模具技术。这些方法虽然能生产出高工程质量和高光学质量的设备,但在设计复杂性和定制方面存在固有的局限性。
虽然这项创新技术仍处于早期开发阶段,但具有的优势显著:可以快速设计各种不同的 IOL,快速制造小批量或批量生产的新晶体,缩短产品开发生命周期,并适应不同客户的要求。首先,开发了本身适应3D打印的创新材料,开发了具有更好光学性能的新材料,可以制造不仅能矫正视力还可以增强视力的晶体。其次,3D打印能带来:1)个性化定制:可以根据每位患者的眼部结构和视觉需求个性化定制晶体,可以改善视力矫正和舒适度;2)实现复杂设计:3D打印使生产制造以前难以实现的复杂形状的晶体成为可能,这些设计可以更好地解决更多的视力问题;3)更高效率生产:与传统方法相比,3D打印可更快地设计、测试和制造晶体;4)实现可及性:通过使用3D打印,定制或高质量晶体的生产成本可能会降低,使更多患者负担得起,特别是在经济不发达地区,从而带来更好的公共卫生结果。此外,该创新技术未来与前沿技术的结合将带来更多可能性:1)例如研究人员接下来会将3D打印与先进的成像技术结合,帮助生产适合每个患者眼睛的晶体,减少术后并发症;2)这项新技术通过实现便携式制造来提供偏远和经济落后地区的屈光不正解决方案;3)对高端市场而言,还有潜力支持优质定制晶体的生产,从而提高更高端医疗保健环境下的手术效果,提高患者满意度和手术成功率。
目前该技术已获得了美国专利,并在UEA大学旗下推动创新和商业化研究的大学企业 UEA Enterprise 继续开发。

该研究得到了英国东英吉利大学通过创新发展基金和概念验证拨款、人道研究信托基金以及工程与物理科学研究委员会(EPSRC)的资助,接下来进一步的开发资金由该大学的医学研究委员会(MRC)影响加速账户(IAA)提供资金支持。
目前全球不少高校科研团队对3D打印人工晶体都产生了浓厚的兴趣并在积极攻关相关技术突破。如可定制化的高光学性能且人眼友好的3D打印人工晶体问世,该技术及衍生产品既可下沉市场亦可升维需求,该突破或将彻底改变目前白内障的诊疗现状。
相关参考:
1 Prokofyeva E, Wegener A, Zrenner E. Cataract prevalence and prevention in Europe: a literature review. Acta Ophthalmol. 2013;91(5):395–405. doi: 10.1111/j.1755-3768.2012.02444.x.
2 Wormstone IM, Wormstone YM, Smith AJO, Eldred JA. Posterior capsule opacification: what’s in the bag? Prog Retin Eye Res. 2021;82:100905. doi: 10.1016/j.preteyeres.2020.100905.
3 Toh T, Morton J, Coxon J, Elder MJ. Medical treatment of cataract. Clin Exp Ophthalmol. 2007;35(7):664–671. doi: 10.1111/j.1442-9071.2007.01559.x.
4 Jin C, Chen X, Law A, Kang Y, Wang X, Xu W, Yao K. Different-sized incisions for phacoemulsification in age-related cataract. Cochrane Database Syst Rev. 2017;9:CD010510.
5 Leyland M, Zinicola E. Multifocal versus monofocal intraocular lenses in cataract surgery: a systematic review. Ophthalmology. 2003;110(9):1789–1798. doi: 10.1016/S0161-6420(03)00722-X.
6 Wormstone IM, Eldred JA. Experimental models for posterior capsule opacification research. Exp Eye Res. 2016;142:2–12. doi: 10.1016/j.exer.2015.04.021.
7 Singh B, Sharma S, Bharti N, Samantrey D, Paandey DJ, Bharti S. Visual and refractive outcomes of new intraocular lens implantation after cataract surgery. Sci Rep. 2022;12(1):14100. doi: 10.1038/s41598-022-14315-6.
8 Pedrotti E, Carones F, Aiello F, Mastropasqua R, Bruni E, Bonacci E, Talli P, Nucci C, Mariotti C, Marchini G. Comparative analysis of visual outcomes with 4 intraocular lenses: monofocal, multifocal, and extended range of vision. J Cataract Refract Surg. 2018;44:156–167.
9 Bozukova D, Pagnoulle C, Jérôme R, Jérôme C. Polymers in modern ophthalmic implants—historical background and recent advances. Mater Sci Eng R Rep. 2010;69(6):63–83. doi: 10.1016/j.mser.2010.05.002.
10 Luo C, Wang H, Chen X, Xu J, Yin H, Yao K. Recent advances of intraocular lens materials and surface modification in cataract surgery. Front Bioeng Biotechnol. 2022;10:913383. doi: 10.3389/fbioe.2022.913383.
11 Olson RJ, Werner L, Mamalis N, Cionni R. New intraocular lens technology. Am J Ophthalmol. 2005;140(4):709–716. doi: 10.1016/j.ajo.2005.03.061.
12 Kumari R, Srivastava M, Garg P, Janardhanan R. Intra ocular lens technology–a review of journey from its inception. Ophthalmol Res. 2020;11:1–9. doi: 10.9734/or/2019/v11i330129.
13 Yu N, Fang F, Wu B, Zeng L, Cheng Y. State of the art of intraocular lens manufacturing. Int J Adv Manuf Technol. 2018;98(5–8):1103–1130. doi: 10.1007/s00170-018-2274-5.
14 Yildirim TM, Fang H, Schickhardt SK, Wang Q, Merz PR, Auffarth GU. Glistening formation in a new hydrophobic acrylic intraocular lens. BMC Ophthalmol. 2020;20(1):186. doi: 10.1186/s12886-020-01430-z.
15 Weinschenk JIIII, Deacon J, Sussman GR. Method of producing repositionable intraocular lenses. United States Patent 5,567,365. Allergan, Inc.; 1996. https://patents.justia.com/inventor/joseph-i-weinschenk?page=3.
16 Tripti D, Haldar RS, Geetha S, Niyogi UK, Khandal RK. Materials for intraocular lenses (IOLs): review of developments to achieve biocompatibility. e-Polymers. 2009;9(1). doi: 10.1515/epoly.2009.9.1.1466.
17 Glick RE, Deacon J, Kent BW. Cast molding of intraocular lenses. United States Patent 5,620,720. Allergan, Inc.; 1997.
18 Sarbadhikari KK. Intraocular lens manufacturing apparatus. United States Patent 6,732,994 B2. Bausch & Lomb Incorporated; 2004.
19 Selimis A, Mironov V, Farsari M. Direct laser writing: principles and materials for scaffold 3D printing. Microelectron Eng. 2015;132:83–89. doi: 10.1016/j.mee.2014.10.001.
20 Wang X, Jiang M, Zhou Z, Gou J, Hui D. 3D printing of polymer matrix composites: a review and prospective. Compos Part B Eng. 2017;110:442–458. doi: 10.1016/j.compositesb.2016.11.034.
21 Sun Q, Fang F, Wang W, Yin J, Liu Q, Hao L, Peng Y. Stereolithography 3D printing of transparent resin lens for high-power phosphor-coated WLEDs packaging. J Manuf Process. 2023;85:756–763. doi: 10.1016/j.jmapro.2022.11.026.
22 Chartrain NA, Williams CB, Whittington AR. A review on fabricating tissue scaffolds using vat photopolymerization. Acta Biomater. 2018;74:90–111. doi: 10.1016/j.actbio.2018.05.010.
23 Debellemanière G, Flores M, Montard M, Delbosc B, Saleh M. Three-dimensional printing of optical lenses and ophthalmic surgery: challenges and perspectives. J Refract Surg. 2016;32(3):201–204. doi: 10.3928/1081597X-20160121-05.
24 Li JW, Li YJ, Hu XS, Gong Y, Xu BB, Xu HW, Yin ZQ. Biosafety of a 3D-printed intraocular lens made of a poly(acrylamide-co-sodium acrylate) hydrogel in vitro and in vivo. Int J Ophthalmol. 2020;13(10):1521–1530. doi: 10.18240/ijo.2020.10.03.
25 Kumagai H, Arai M, Gong J, Sakai K, Kawakami M, Furukawa H. Modeling the transparent shape memory gels by 3D printer Acculas. SPIE; 2016. https://www.spiedigitallibrary.org/conference-proceedings-of-spie/9802/1/Modeling-the-transparent-shape-memory-gels-by-3D-printer-Acculas/10.1117/12.2218236.short.
26 Liu CS, Wormstone IM, Duncan G, Marcantonio JM, Webb SF, Davies PD. A study of human lens cell growth in vitro. A model for posterior capsule opacification. Invest Ophthalmol Visual Sci. 1996;37:906–914.
27 Jung GB, Jin K-H, Park H-K. Physicochemical and surface properties of acrylic intraocular lenses and their clinical significance. J Pharm Investig. 2017;47(5):453–460. doi: 10.1007/s40005-017-0323-y.
28 Li X, Kelly D, Nolan JM, Dennison JL, Beatty S. The evidence informing the surgeon’s selection of intraocular lens on the basis of light transmittance properties. Eye. 2017;31(2):258–272. doi: 10.1038/eye.2016.266.

来源:青白视角


