您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-05-28 10:47
当地时间5月,欧盟药品管理局-EMA发布了<药械结合情况下实施MDR和IVDR法规的Q&A>。
含药器械一直是制造商申请MDR或IVDR最不明确的,这个产品到底归谁审核?MDR或IVDR法规下的公告机构?还是药品管理局EMA?还需要其他部门介入吗等等问题。EMA发布本文将旨在为申报方/applicants、上市许可持有人(MAH)和公告机构(NB)提供有关欧洲药品管理局活动范围内各方面的指导,本指南应该和MDR、IVDR、MDCG指南一并阅读。
MDR和IVDR法规包括有关欧洲药品管理局(EMA)、医药产品和医疗器械国家主管当局(NCA)以及 NB 在药械结合器械方面的责任的规定,具体如下:
-对于与医药产品构成一个整体产品的医疗器械(第MDR Article 1(8) and 1(9)),在某些情况下适用新的要求,即提供由医疗器械制造商签发的欧盟符合性声明,或符合性证书(以下称欧盟证书),或根据(EU) 2017/7452 法规指定的NB机构针对相关器械类型出具的意见(Art. 117)
-对于包含具有辅助作用的医疗物质的医疗器械MDR Article 1 (8),NB必须征求NBCA或EMA的科学意见。对于完全属于集中程序/centralised procedure 范围内的医疗产品,或含有人体血液或血浆衍生物的医疗产品,NB 必须征求 EMA 的意见。
-对于由可被人体全身吸收的物质或物质组合组成以达到预期目的的医疗器械,NB 必须征求 NCA 或 EMA 的科学意见(MDR Article 52(11))
-对于辅助诊断,NB 必须征求 NCA 或 EMA 的科学意见(IVDR Article 48(3) and (4))。
本文件涵盖以下方面的指南:
- 与医药产品构成一个整体的医疗器械、
- 在医药产品的辅助包装(联合包装)中包含医疗器械的医药产品、
- 作为医疗器械组成部分的辅助药用物质的咨询程序、
- 辅助诊断的咨询程序
本 "Q&A "提供了法规和程序指导,应与 EMA 关于与医疗器械一起使用的医药产品的质量文件指南一并阅读。本指南描述了根据指令 2001/83/EC 和/或法规 (EC) 726/2004 提交的与医疗器械或器械部件一起使用的医药产品上市许可档案质量部分应提供的信息。本指南重点关注医疗器械或器械部件的特定产品质量方面,这些方面可能会对药品的质量、安全性和/或疗效(以及整体利益/风险的确定)产生影响。
1、医药产品和医疗器械的组合
1.1 同时包含医药产品和医疗器械的产品属于哪个监管框架?Rev. May 2024
A、根据其主要作用方式,将医药产品(或物质)和医疗器械结合在一起的产品受关于医疗器械的第MDR法规或2001/83/EC 指令的监管。根据MDR Articles 1(8)和Articles 1(9) 的规定,某些医药产品和医疗器械的组合受 EMA 或国家医药产品主管部门(NCA)的监管,或需要向其咨询。
MDR Article 1(8) 规定了以药用物质为组成部分的器械的监管框架:
- 如果药用物质的作用与医疗器械的作用相辅相成,则该产品作为医疗器械进行管理,必须打上 CE MARK。对于这些组合,在 NB 颁发欧盟证书之前,必须由某个国家的医药产品主管当局或 EMA(统称为医药当局)就辅助物质的质量和安全性(包括将其纳入器械的益处或风险)提供科学意见。
- 如果药物的作用是主要的,而不是医疗器械的辅助作用,则整体药物器械组合(iDDC)受医药产品框架管辖,在下文的问答中称为 iDDC。在这种情况下,MDR Annex I 的GSPR适用于 iDDC 的器械部分。
MDR Article 1(9) 规定了用于给药的医疗器械的监管框架:
- 如果医药产品和给药器械作为一个单独的整体产品在市场上销售,专门用于给定的组合且不可重复使用,则 iDDC 受医药产品框架管辖。在这种情况下,MDR Annex I 的GSPR适用于器械部分。
- 在所有其他情况下(例如,医疗器械与药品共同包装,或药品的产品信息提及要使用的特定器械,而器械是单独获得的),给药器械受医疗器械框架管辖。这些给药器械必须符合 MDR 的要求,并需要打上 CE MARK。
在本文件中,属于 MDR Article 1(8) 第二分段和Article 1(9) 第二分段范围内,且主要作用方式为药理学、新陈代谢或免疫学作用的整体产品,受医药产品框架监管。
在某些情况下,药品和医疗器械以相同的辅助包装投放市场,但并不构成一个完整的产品,例如,一个装有药品溶液的小瓶和一个(空的)有 CE MARK 的无菌注射器。这些产品被称为带辅助包装器械的药品。这种产品不被视为 iDCC,因为医疗器械属于 MDR Article 1(9) 第一项的范围。此外,当一种医疗器械在一种药品的产品信息中被提及与该药品混合使用,但这两种产品并未在同一辅助包装内投放欧盟市场时,本问答第 3 部分将介绍对这些产品的要求。
值得注意的是,IVD试剂盒不得包括医药产品。如果一个 IVD 或一个 IVD 试剂盒打算与一种医药产品一起使用,而这两种产品是共同包装的,那么与医药产品的组合可能不符合 IVD 试剂盒的条件。每种产品都必须符合相应的法规。
1.2 如何为我的药械结合器械选NB?
Rev. May 2024
A、申请人可查看 NANDO网站,点击 "Legislation’",选择相关指令/法规,根据所需的代码/范围搜索指定的公告机构。
1.3 如何获得有关药药械结合的资格/分类的建议?特别是对于边缘/borderline 产品?
New May 2024
A、边界产品是指不清楚适用哪种监管框架的产品,即它们属于医疗器械框架还是药品框架。
MDR 和药品法规之间的界限对于适用一套适当的要求至关重要。
边界产品的定性/分类(如应作为医药产品还是医疗器械进行监管)由医药产品和/或医疗器械的国家主管当局负责。
MDR 和 2001/83/EC 指令中规定了两个法律框架之间的分界线。MDCG小组发布了:MDCG 2022-5 医疗器械和医药产品之间的界限指南、MDR和IVDR下医疗器械的边界线和分类,(见第 1.1.2 节关于医疗器械和医药产品之间的borderline )。
如适用,应与 NB 商定医疗器械的资格和风险分类。制造商与NB之间关于器械分类的任何争议,应提交制造商注册营业地所在成员国的国家医疗器械主管机构裁决(MDR (Article 51(2) 和 IVDR 47(2) )。
为了促进创新药械结合的开发并推动早期对话,可要求欧洲药品管理局创新工作组 (ITF) 提供非正式意见。
创新工作组(ITF)的非正式意见。虽然 ITF 可以就边缘产品的分类发表科学意见,但申请人/医疗机构有责任在必要时和提交申请前联系国家主管机构,就组合或边缘产品的资格和/或医疗器械的风险分类寻求可能的正式建议。
2、药物与器械的整体组合
2.1 什么情况下我的医疗器械被视为与某种药品
构成一个整体?Rev. May 2024
A、根据 MDR Articles 1(8) 和 1(9),iDDC 有两种类型(另见问题 1.1)。
1.1 一种医疗器械,其组成部分包含一种物质,如果单独使用,该物质将被视为一种药 品,如果该物质的作用是主要的,则该组成部分将作为一种药品受到管制( Article 1(8) second subparagraph )。这方面的例子包括纳入药用产品的可摄入传感器。
2.2 如果用于给药的医疗器械在投放市场时,其两个组成部分(医疗器械和药 品)形成了一个单一的整体产品,专门用于特定的组合,且不可重复使用,则该单 一整体产品应受 2001/83/EC 指令或(EC) No 726/2004条例(如适用)的管制。MDR 第Article 1(9)第二款规定了在投放市场时需要满足的三个累积条件:
i. 在投放市场时,器械和药品构成一个整体、
ii. 该单一整体产品专门用于特定组合、
iii. 不可重复使用。
以下是一些例子:
对于符合上述一个或两个定义的医药产品,整体产品应受 Directive 2001/83/EC 或 Regulation (EC) No 726/2004(如适用)的管辖。然而,就整体产品器械部分的安全和性能而言,应适用MDR法规附件I中规定的GSPR要求。
不可重复使用的整体产品的例子包括预灌封注射器、预灌封笔、预灌封特定药物的雾化器、鼻腔和口腔喷雾器、经皮给药贴片、预灌封吸入器以及与用于给药重组药物的溶剂(如注射用水)共同包装的预灌封注射器。
在某些情况下,主管当局将根据以下要求对组件进行评估:
- 容器封闭系统,例如不带测量功能的滴眼剂喷嘴、用于复方制剂的注射器 (不用于给药目的)或不带测量功能的注射器,专门用于转移到静脉注射袋中;
- 用于制造成品药的赋形剂,如某些植入剂和某些透皮贴剂(使用被动扩散)
注:以上示例仅供参考,但某些器械可能因其附加特性和功能而有不同的分类。如果对您的产品是否符合药用产品、器械或 iDDC 标准有疑问,建议您咨询国家主管机构。
2.2 什么是 Article 117,它对医药产品意味着什么? Rev. May 2024
A、自2021年5月26日起提交的iDDC上市许可申请必须符合Directive 2001/83/EC Annex I section 3.2 point 12的要求,该要求经MDR Article 117 修订。
MDR Article 117 规定,iDDC上市许可卷宗必须包括(如有)器械部分的符合性评估结果(即符合性声明或由NB机构签发的相关欧盟证书)。
如果档案材料不包括符合性评估结果,并且如果器械单独使用,则需要由 NB 出具欧盟证书,那么申请人将需要提供 NB 关于器械部分是否符合MDR Annex I 相关要求的意见,作为上市许可申请的一部分。
Article 117适用于MDR Articles 1(8) 和1(9)第二项所述的 iDDC。
Article 117 不适用于 Regulation (EC) No 1394/2007 Article 2(1)(d) 定义的先进疗法联合用药产品。
在整体性 DDC 的上市许可档案中提交符合 MDR GSPR的证据不适用于 2021 年 5 月 26 日(即 MDR 的适用日期)之前提交的 MAA。
总之,自 2021 年 5 月 26 日起提交的 iDDC 上市许可申请必须证明器械部分符合MDR Annex I 的相关要求,如下表所示。
为确保 iDDC 的安全和有效使用,可能会要求提供更多信息,以支持对医药产品的风险收益评估进行审查。
表 1. 涉及 iDDCs 的上市许可申请的变更摘要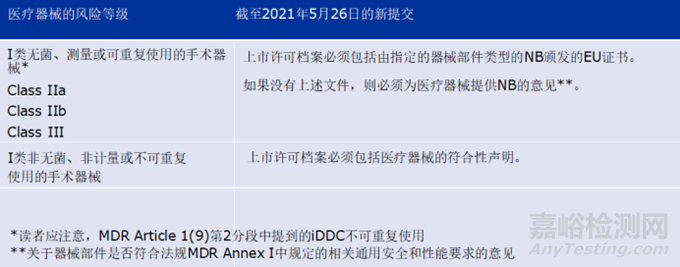
2.3 我需要在 MAA 的哪个阶段提交 NB 意见?
Rev. May 2024
A、EMA/NCA 强烈建议在提交医药产品首次上市许可申请的卷宗时提交符合性声明/欧盟证书/NB意见,以促进程序的顺利进行。如果申请人在提交 MAA 时无法提供所需的文件,则必须先提供相关文件,然后才能就医药产品申请出具意见。申请人应在 EMA/NCA 提交前会议上讨论其提供所需文件的计划。缺少所需文件可能会导致程序中额外的时钟停止。
2.4 能否提供 NB 对部分符合 GSPR 的结论意见?NB意见的范围是什么?New May 2024
A、由于 CHMP 和 NCA 无权评估器械部分是否符合GSPR要求 ,因此不能接受部分符合要求的NB意见。因此,这可能会导致评估问题,在发布有关医药产品的意见之前,需要提供更新的NB意见,确认完全符合相关的 GSPR。
此外,NB 意见的范围应与特定上市许可申请中设备的预期用途相对应。
2.5 MDR Article 117 对根据 MDD 授权的 iDDC有何影响?
Rev. May 2024
A、经 MDR Article 117 修订的 2001/83/EC 指令 Annex I section 3.2 point 12 无意追溯适用于已获授权的 iDDC 或 2021 年 5 月 26 日之前已提交的 MAA。
但是,如果器械在获得上市许可后发生重大变化,如在设计、性能、安全性或器械(部件)的预期用途方面发生重大变化,可能对药品的交付或质量、安全性或疗效产生重大影响,或引入了新的器械,则应作为适当监管程序的一部分,向 EMA/NCA 提交任何所需的符合性声明/欧盟证书/NB 意见(另见 Q2.6)。
至于任何其他变更,卫生部应确定是否会对 iDDC 的交付、质量、安全和/或功效产生潜在影响。如果 MAH 认定变更会影响注册信息,则需要根据变更指南提出变更申请。如果变更对注册信息没有影响,但 MAH 认定对 iDDC 的质量、安全性和/或功效有影响,也必须提交变更申请。
如果器械(部件)的设计、性能或预期用途发生变化,或医药产品发生其他可能影响医疗器械的变化,则 MAH 应评估该变化是否对器械的安全性或性能无重大影响,并提供相关理由,以证明根据 MDR 无需提供通知机构意见、欧盟证书或符合性声明的合理性(视情况而定)。否则,应提供最新或新的符合 MDR 的证明。
如果变更的必要性和/或变更的类别不明确,建议咨询签发上市许可的国家药品主管部门。
根据《EMA Q&A 为集中程序用户提供的授权后程序建议》中提供的建议,鉴于变更程序的时限相对较短,应在提交申请时提供(新的/更新的)欧盟符合性声明/由指NB签发的欧盟证书/医疗器械NB意见书,以避免程序出现任何延误。
Article 117要求适用于所有上市许可的授权后情况,无论在首次获得 MAA 时是否已经符合2001/83/EC 指令Annex I section 3.2 point 12(经MDR Article 117 修正),如果器械发生重大变更,可能对器械部件的安全性或性能或器械的预期用途产生重大影响。MAH和医疗器械制造商之间的合同协议应确保就器械部件的变更进行适当程度的沟通和行动。在两种情况下,必须在医疗产品获得授权后提交(新的或更新的)欧盟符合性声明/由 NB 机构签发的欧盟证书/ NB 机构的意见。
2.6 如果器械(或器械部件)在整体 DDC 首次获得上市许可后发生变化,我是否需要提供由 NB/NB意见颁发的(新的或更新的)欧盟符合性声明/符合性证书? Rev. May 2024
A、Article 117要求适用于所有上市许可的授权后情况,无论在首次获得 MAA 时是否已经符合2001/83/EC 指令Annex I section 3.2 point 12(经MDR Article 117 修正),如果器械发生重大变更,可能对器械部件的安全性或性能或器械的预期用途产生重大影响。MAH和医疗器械制造商之间的合同协议应确保就器械部件的变更进行适当程度的沟通和行动。在两种情况下,必须在医疗产品获得授权后提交(新的或更新的)欧盟符合性声明/由 NB 机构签发的欧盟证书/ NB 机构的意见。
a) 增加或完全更换设备或设备部件
如果更换了器械(或器械部件)或增加了新设备,则必须提供由 NB 颁发的新欧盟合格声明/欧盟证书/ NB 意见,作为变更或延期申请的一部分。
b) 设备或设备部件的变更
如果医疗器械制造商计划引入可能会影响器械部件安全和性能或器械部件预期使用规定条件的变更,则可能出现三种情况:
- 对于仅由制造商的欧盟符合性声明(无 NB 参与)涵盖的器械:器械(部件)制造商负责确保符合 MDR,包括器械(部件)的变更。 如有必要,应相应更新欧盟符合性声明。
- 对于由 NB 签发的 MDR 欧盟证书所涵盖的器械:如果对变更的评估导致根据 MDR 相关附录(Annexes IX, X, XI)中规定的要求签发新的/补充的欧盟证书,则必须作为适当的授权后监管程序的一部分提供欧盟证书。
- 对于持有 NB 意见的器械:如果对变更的评估导致签发新的 NB 意见,则必须提供新的 NB 意见,作为适当的授权后监管程序的一部分。
在欧盟证书的生命周期管理中,NB和设备制造商之间的合同安排涉及通知义务和对设备变更的监督。
对于NB意见,如果NB与 MAH 之间没有合同安排,则由 MAH 负责确定何时需要新的或更新的 NB 意见,以支持器械或其预期用途的变更。MAH 负责就 iDDC 与 EMA 或 NCA 联络。
至于任何其他变更,MAH应确定是否会对iDDC的交付、质量、安全性和/或有效性产生潜在影响。如果 MAH 确定变更会影响已注册信息,则 MAH 必须根据变更指南提交变更申请。如果变更不影响注册信息,但 MAH 认定对 iDDC 的交付、质量、安全和/或功效有影响,则 MAH 也必须提交变更申请。
为了帮助识别预计将对 iDDC 的器械部分提出新的或修订的 NB 意见的情况,我们提供了以下指导,但这并不影响相关产品案例的特殊性,而且对器械是否符合一般安全和性能要求 (GSPR) 的评估仍属于 NB 的职权范围。
如果是欧盟证书或器械制造商符合性声明 (DoC),MAH 应遵循 MDR 要求维护欧盟证书或 DoC。
作为一种指导方法,针对 iDDC 的器械部分,新的或修订的 NB 意见是:
1) 当引入新器械时,需要进行产品线扩展或变更;
2) 当现有设备发生重大变化时,如
- 改变其设计;
- 增加或更换整体装置(部件)
- 改变其性能特征;
- 预期目的发生变化,如病人群体和/或新用户(如家庭与医院环境)和/或新的可用性研究,和/或明显不同的使用说明。
可能对药品的交付或质量、安全性或疗效产生重大影响。
3) 如果药品发生变化,可能会影响器械的性能或安全性,例如采用新的成品配方,导致粘度不同,从而严重影响器械的性能。
如果认为对 iDDC 的器械部分和/或其预期用途的变更或变更组合不需要新的或修订的 NB 意见,申请人应在模块 3.2.R 中提供理由和风险评估。根据器械变更并考虑安全准确的给药和性能,应考虑对 iDDC 的质量目标产品简介 (QTPP)、关键质量属性 (CQA) 和控制策略的影响。
如果对是否需要提供新的或修订的 NB 意见(或 DoC 或欧盟证书)以支持变更或产品线延伸存在疑问,以及如果变更的必要性和/或变更的类别不明确,强烈建议申请人在提交前阶段提前与国家药品主管部门联系。
根据《EMA Q&A 为集中程序用户提供的授权后程序建议》中提供的建议,鉴于变更程序的时限相对较短,应在提交申请时提供由指定通知机构/医疗器械NB意见颁发的(新的/更新的)欧盟符合性声明/欧盟证书,以避免程序出现任何延误。如果在提交申请时未提供,则必须在 CHMP 意见(产品线扩展和 II 型变更)或通知(IB 型变更)之前依法提供。NB 意见应确认完全符合相关 GSPR,并与产品线扩展或变更中声称的 iDDC 器械部分的预期用途相符。
请结合问题 2.7 和 2.8 阅读本问题。
2.7 器械(或器械部件)发生变化后,应如何提交对整体式 DDC 营销授权条款的细微变更?
New May 2024
A、根据 2.5 和 2.6 中解释的一般原则,具体如下:
- 至于任何其他变更,MAH 应确定是否会对 iDDC 的交付、质量、安全性和/或有效性产生潜在影响。
- 如果 MAH 确定变更影响注册信息,则需要根据欧共体变更分类指南提出变更申请。
- 如果变更不影响注册信息,但 MAH 认定对 iDDC 的交付、质量、安全和/或疗效有影响,也必须提交变更申请。
提供以下指导,但不影响器械的GSPRs合规性评估仍然是NB的职权范围。整体组合的MAH总体责任是确保在器械发生重大变化的情况下,整体组合中使用的器械得到最新NB意见或欧盟证书的支持,也请参阅Q 2.6的指导。
对器械(或器械部件)的微小变更,如果不影响器械(部件)的安全性或 性能或器械的预期用途,但仍需要更新MAA中的注册信息,则应根据变更指南提交相应的变更申请。MAH应评估并提供理由,说明更改是否对器械没有重大影响,以证明没有NB意见。否则,应提供遵守MDR 的证明。
下面列出了对千年生态系统评估进行细微修改的一些例子。该清单并非详尽无遗,仅供参考。在以下会导致微小改动的例子中,应根据 MAH 进行的风险评估,提供不包含新的或修订的 NB 意见的理由。在提交时,将对拟议的变更逐一进行评估。如果变更的必要性和/或变更的类别不明确,建议咨询签发 MA 的国家医药产品主管部门。
- 设备(部件)供应商的变更:
根据 QWP-BWP 关于与医疗器械一起使用的医药产品的指南 (europa.eu),应在section 3.2.P.7中说明 iDDC 的器械(部件)供应商。
应提交类别 B.II.e.7 包装部件或装置供应商变更,以增加/删除医疗器械(部件)的供应商。
在增加或更换设备(或设备部件)供应商的情况下,如果 MAH 进行的风险评估认为变化不大,并且除供应商变化外,设备没有其他变化,则可在提交的材料中包含一份声明,说明不需要 NB 意见/欧盟证书/欧盟符合性声明的理由。
如果 MAH 进行的风险评估得出结论认为变化并不显著,而且除了更换供应商之外,器械没有其他变化,则可在提交的材料中包含一份声明,证明没有 NB 意见/欧盟证书/欧盟符合性声明是合理的。
如果器械制造商也在进行灭菌处理,且器械(部件)是作为无菌即用型供应的,则应根据 CMDh Q/A-List 中的问题 3.26,在 B.II.b.1 下提交变更,以便根据 Comm.Reg. (EC) 1234/2008 提交变更(也适用于 CAP)。
•器械(部件)的尺寸变更:
不与药品接触的器械(部分)(即指柄、柱塞杆)的尺寸变更,如果不影响器械的功能或 性能,但仍需要更新注册信息,则可以根据b.iie6作为IA通知提交只要符合EC变异分类指南中规定的所有条件,改变与成品配方不接触的(初级)包装材料的任何部分(如翻盖帽的颜色,安瓿上的色码环,改变针罩(使用不同的塑料))。
与药品接触的器械(部件)(即针头、注射器筒、柱塞……)的尺寸变更需要更新注册信息,应作为B.IV项下的IB或II类变更提交。1取决于改变的关键程度。
- 改变器械(部件)的质量和/或数量组成:
只要符合变异准则中规定的所有条件,与成品配方不接触的(主)包装材料任何部分的变 化(如翻盖的颜色、安瓿上的色标环、针头防护罩的变化(使用不同的塑料))均可作为 IA 通知提交。
对于与药品接触的医疗器械(部件),用同等材料替换某种材料(质或量成分的改变)应按 B.IV.1 分类提交。
如果成分的改变也包括制造商的改变,则应根据关键程度将两者合并为一个变异 B.IV.1.z、IB 型或 II 型提交。
- 器械(部分)灭菌方法的更改:
在灭菌场所不变的情况下,对 iDDC 器械部分灭菌方法的更改应在 B.II.b.3 项下提交。
如果制造商发生变化,则应在 B.II.b.1 项下提交新的灭菌部位和相应的灭菌方法。
值得注意的是,如果现有装置发生了若干变化,导致增加或更换了新的注射器,例如, 变化不仅限于现有注射器的某些装置部件的供应商,而且还引入了其他变化,例如对 现有装置部件的设计和材料进行了更改的替代注射器,则包括制造商变化在内的成分变 化应根据关键性在 B.IV.1.z、IB 型或 II 型中提交。
2.8 我是否需要为整体药械结合中与药品有关的变更(如适应症的扩展、新强度、新剂型)提供新的/更新的 NB 意见? New May 2024
A、药品的变更可能会对器械的安全性、性能或预期用途产生影响。
虽然医药产品的变化可以作为变更或产品线扩展的触发因素,但如果器械的安全性或性能或其预期用途受到影响,该程序可能需要包括新的或更新的欧盟符合性声明/欧盟证书/NB 机构意见。
GSPR 合规性要求"[......]如果器械用于给药,则其设计和制造方式应与相关医药产品相匹配,符合这些医药产品的规定和限制,并确保医药产品和器械的性能符合各自的适应症和预期用途"。
关于为 iDDC 提供新的/更新的 NB 意见的必要性,请参阅问题 2.6 中提供的指导原则。
对于欧盟证书或器械制造商的欧盟符合性声明,MAH 应遵循 MDR 对欧盟证书或欧盟符合性声明的维护要求。
以下指南的提供不影响对器械是否符合一般安全和性能要求的评估仍属于 NB 的职责范围。
以下内容仅作为指导,不影响在提交时对拟议变更逐一进行评估。
值得注意的是,对于国家授权和通过 MRP/DCP 授权的医药产品,产品线扩展可能会导致新的上市授权,因此应与相关成员国确认这是否会引发对新通知机构意见本身的需求。
- 适应症的扩展
在扩展适应症的情况下,例如扩展到另一种情况,如果设备或用户没有变化,则 MAH 应评估新适应症是否对设备的安全性和性能没有重大影响,并提供理由。在这种情况下,可能不需要新的或更新的 NB 意见来支持 MA 的变更。
- 新强度
如果对现有的 iDDC 采用新的强度,且器械未发生变化,则 MAH 应评估新强度是否对器械的安全性和性能无重大影响,并提供理由。在这种情况下,可能不需要新的或更新的 NB 意见来支持变更 MA 的监管程序。
- 新剂型
如果新剂型与引进的器械相结合,则需要提供符合 MDR 的相应证明,具体取决于医疗器械是与药品构成一个整体还是共同包装。
如果新药剂型与已获批准的药品器械结合在一起,则 MAH 应评估新药剂型是否会对器械的安全性和性能产生重大影响。在这种情况下,应提供新的或更新的 NB 意见。如果认为不会对器械的安全性和性能产生重大影响,则应提供正当理由,以支持变更 MA 的监管程序。
- 新的给药途径
如果采用新的给药途径,可能会对设备的安全性或性能产生影响。在这种情况下,可能需要新的或更新的 NB 意见来支持 MA 的变更。
2.9 是否可以提交根据指令(MDD或AIMDD)颁发的 NB 证书,以符合Article 117的规定?
Rev. May 2024
A、持有根据医疗器械MDD或AIMDD颁发的证书的医疗器械,根据MDR Article 120(2), (3a) 和 (3c)的过渡性规定仍然有效,仍可提交以支持经MDR Article 117 修订的2001/83/EC 指令Annex I section 3.2 point 12的要求。
MDR Article 120 3(b)规定了一个过渡期,该过渡期也适用于在 2021 年 5 月 26 日之前根据 MDD指令起草了符合性声明的 I 类器械,对于这些器械,MDR规定的符合性评估程序要求NB首次参与。如果符合MDR Article 120(3c) 规定的条件,可在2028年12月31日前接受符合性声明,以满足经 Article 117修订的2001/83/EC 指令Annex I section 3.2 point 12的要求。
2.10 European Public Assessment Report (EPAR) 将如何反映 NB 的意见? June 2021
A、EPAR 提供有关医药产品的公共信息,包括如何对其进行评估,并反映 EMA / NCA 的科学结论。
EPAR 将总结医疗器械部分的相关信息,这些信息与医疗产品的使用相关,是否提交了符合性声明或欧盟证书或 NB 意见(如适用),作为医疗产品上市许可申请的一部分。将要求申请人/MAH 确定 EPAR 中被视为商业机密的信息,并提出建议,包括删除/替代措辞的理由。NB 意见本身不会单独公布。
2.11. MDR 和Article 117对 2021 年 5 月 26 日或之后通过互认程序提交的 iDDC 上市许可申请有何影响? Rev. May 2024
A、由于相互承认程序(MRP)/重复使用程序(RUP)是在相关成员国申请上市许可的新申 请,档案材料必须符合在申请相互承认程序/重复使用程序时适用的监管要求。如果自最初的国家程序、分散程序或相互承认程序以来要求发生了变化,则需要更新档案材料。但是,如果在 2021 年 5 月 26 日或之后在 MRP/RUP 中提交了 iDDC 申请,那么 MDR 的一般安全和性能要求 (GSPR) 以及经 MDR Article 117修订的 2001/83/EC Annex I section 3.2 point 12适用,并且只有在设备(部件)的设计或预期用途发生重大变更的情况下,或在新设备的情况下,才必须在档案材料中包含适用的证明文件,如符合性声明、符合性证书或 NB 意见。
如果自 MDR 生效以来,RMS 授权的整体 DDC 没有发生与设备有关的重大变化,则可以接受先前根据 MDD 评估的传统设备文件。
如果器械变更触发了提供 NB 意见或欧盟证书或 DoC 的需要,在 MRP/RUP 开始之前,需提交变更申请,添加符合性声明、符合性证书或通知机构意见,以正式更新参考成员国以及(如适用)现有相关成员国的原始卷宗。
在 MRP/RUP 开始之前,申请人应讨论其提供所需文件的计划,并酌情提交现有 MA 的变更。
2.12. MDR Article 117 的要求是否也适用于在欧盟境外使用的医药产品申请(Article 58 or EU-M4all)? Rev. June 2021
A、EMA 的人用医药产品委员会 (CHMP) 根据(EC) No 726/2004 Article 58 评估药品和疫苗,评估标准与拟在欧盟境内使用的药品一样严格。因此,经 MDR Article 117 修订的 2001/83/EC 指令Annex I section 3.2 point 12 的要求也类推适用于 Article 58申请(称为 EU- M4all)。
2.13. 对 UDI(唯一器械标识符)的要求是否适用于包含医疗器械作为组成部分的医药产品?Rev. May 2024
A、属于医药产品立法范畴的 iDDC 无需履行与 UDI 相关的 MDR 义务。因此,与器械部件相关的 UDI 不应适用于此类 iDDC 的包装。MDCG 2019-2 指南中提供了更多信息,介绍了 UDI 规则对MDR法规Article 1(8)、1(9) 和 1(10)所述产品设备部分的应用。
如果 iDDC 的器械部分已获得 CE MARK,则 iDDC 的产品标签应遵循 QRD(文件质量审查工作组)模板中概述的医药产品标签要求。如果 UDI 已直接标注在器械部件上,则无需去除。UDI 不应出现在医药产品的标签或外包装上。
3、在上市药品的辅助包装中含有医疗器械的药品(共同包装)
3.1. MDR 将如何影响共同包装的医疗器械?
Rev. May 2024
A、如果医疗器械(如勺子、量杯、吸入器、垫片)是在上市医药产品的辅助包装中提供的(即共同包装),且与医药产品不构成一个整体产品,则医药产品的上市许可申请人将需要确保其共同包装的医疗器械已根据有关医疗器械的相关法规获得 CE MARK,才能继续将产品投放市场。
- 某些医疗器械可受益于 MDRArticle 120(3a) -(3e)规定的过渡期,该条款允许具有根据MDD或AIMDD颁发的有效合格证书或声明的器械按照延长的过渡期投放市场,直至 2027 年 12 月 31 日或 2028 年 12 月 31 日,具体取决于器械的风险等级,且必须满足相关条件。 自 2021 年 5 月 26 日起,医疗器械制造商将需要遵守 MDR 的某些要求(参见 CAMD MDR/IVDR 过渡分组发布的常见问题解答: 常见问题解答 - MDR 过渡条款;欧盟委员会服务部门关于实施条例 (EU) 2023/607 相关实际问题的问答,以及欧盟委员会网页上的相关 MDCG 指南)。
- 自带 CE MARK的 I 类器械必须在 2021 年 5 月 26 日之前符合 MDR。如果您自行 CE MARK的 I 类设备被 MDR 提升了等级,则适用 MDR Article 120(3b)规定的过渡期。
3.2. 哪些医疗器械标签要求适用于与医药产品 "共同包装 "的医疗器械?
Rev. May 2024
A、共同包装产品需要与构成单一整体产品的整体药物-器械组合区分开来,后者受第 2001/83/EC 指令或 726/2004法规或MDR法规的管辖(另见 Q2.1)。
对于联合包装产品,医疗器械必须符合 MDR 。这包括有关随器械提供的信息的要求,这些要求是 MDR Annex I 中规定的一般安全和性能要求的一部分。
根据MDR法规Annex I Chapter III, 23.1 (b),医疗器械标签上要求的信息(如 CE MARK、器械标识、制造商标识(如适用,还包括授权代表的标识)、批号/序列号、UDI 载体等)应在器械本身或其包装上提供。
与医疗器械共同包装的医药产品的产品信息附件(SmPC、标签和包装说明书)应遵循2001/83/EC指令的要求(参见QRD(文件质量审查)模板),不应包括医疗器械上或与医疗器械一起提供的任何管理信息,如器械制造商/授权代表、CE MARK(包括NB号)、器械符号、UDI或器械警戒报告参考。
根据MDR法规 Annex I Chapter III Section 23.1 (d),如果 I 类和 IIa 类器械无需任何使用说明即可安全使用,则不需要 I 类和 IIa 类器械的使用说明 (IFU),除非Section 23中的其他条款要求提供 IFU。如果需要 IFU,则应与设备一起提供。
使用联合包装器械的相关信息,尤其是对与器械一起使用的医药产品的预期用途所必需的信息,应酌情纳入医药产品包装说明书和SmPC的适当部分(详情请参阅SmPC指南和QRD(文件质量审查)模板)。
根据 MDR Article 16(1)(a),MAH 本身可以是共同包装医疗器械的制造商,也可以承担器械制造商的责任。在这种情况下,MAH 负责在器械生命周期内遵守 MDR,只需提供 MAH 的详细联系信息。
如果 MAH 不是联合包装医疗器械的制造商,则医疗器械制造商仍有责任在器械的生命周期内遵守 MDR,并需要在器械标签和/或 IFU 上标明。
3.2.1 如果共同包装的 I 类和 IIa 类医疗器械在供应时没有独立包装,并且在器械本身上执行标签要求在技术上不可行,那么可以考虑哪些替代解决方案来显示标签要求?
New May 2024
A、根据MDR ANNEX I Chapter III, 23.1 (b) ,医疗器械标签上要求的信息(如制造商标识、批号/序列号等)应在器械本身或其独立包装上提供。不过,根据Annex I section 23.1(d)的规定,共同包装的医疗器械,特别是 I 类和 IIa 类医疗器械(如量勺、量杯或量针筒等定量器械),可以由器械制造商批量提供,没有单独的包装,也不会有自己的包装或 IFU。这些器械本身体积小,直接在器械上标注任何信息可能具有挑战性或在技术上不可行。
考虑到医药产品的产品信息附件(包括 SmPC、标签和包装说明书)不得包括所要求的医疗器械标签信息(见问答 3.2),以下建议的解决方案旨在提供一种可接受的方式来包括后一种信息。
A. 在医药产品包装内提供一份单独的、额外的宣传页,根据 MDR 提供医疗器械管理信息。此方案将导致二次包装中包含两份单独的单张,即药品包装单张(PL)和包含医疗器械管理信息的单张。建议加入另一份单张的对照索引,以避免两份单张中的一份被忽略。
如果几种器械与医药产品共同包装,则不宜采用上述方案。在同一包装内有几份不同器械的说明书可能会使最终用户感到困惑。
B. 将包含医疗器械管理信息的说明书附在药品包装说明书上,并作为一个折叠部件放在药品的辅助包装内。为实施这一方案,生产商应考虑以下几点:
- 包含医疗器械管理信息的说明书应与药品包装说明书有明显的区别。具体做法是在印刷好的包装单张末尾增加一个可撕下的部分,以显示包含医疗器械管理信息的单张。
- 与医疗器械共同包装的药品的产品信息附件(SmPC、标签和包装说明书)应遵循 2001/83/EC 指令的要求,不应包括 MDR 规定的器械的任何管理信息。
- 包含器械管理信息的部分应使用相关的小标题,例如标题为"<器械名称>特定信息",以明确说明其目的。
C. 将包含特定设备信息的折叠式小册子/贴纸直接贴在设备上,或贴在每个设备的包装上(如有)。
在加入折叠式小册子/贴纸时,应考虑以下几点:
- 折叠式小册子上的信息应不可擦除、易于辨认,且预期使用者或患者可清楚理解;(MDR Article 10(11) );
- 应解决信息可能丢失的风险(贴纸可能松动);
- 粘合剂应在产品的整个生命周期(如运输、冰箱或冰柜储存期间)内发挥作用。
3.3. 作为共同包装医疗器械档案的一部分,我是否需要提交合格声明/欧盟证书?Rev. May 2024
A、在组合产品投放市场之前,申请人/MAH 有责任确保与医疗产品共同包装的医疗器械符合 MDR 附件 I 中规定的适用一般安全和性能要求,并符合 MDR 的全部内容。对于 2021 年 5 月 26 日后提交的与医疗器械共同包装的医药产品的上市许可,应提供器 械已满足相关要求的证据,如欧盟符合性声明或欧盟证书(如适用),或其他适当的文件,如确认符合相关 GSPR 的摘要信息。
对于 2021 年 5 月 26 日之前提交或批准的与医疗器械共同包装的医药产品的上市许可,如果档案中包含符合性证书或符合性声明,则无需提交上市许可变更,以符合 MDR 的新欧盟证书或符合性声明取代之前的符合性证据。
3.4 如果我的联合包装器械被提升了类别,并且首次需要由 NB 认证机构进行认证,我需要采取什么行动(如果有的话)?Rev. May 2024
A、如果医药产品与根据MDD 不需要进行NB 评估但现在根据MDR 需要进行NB 评估的医疗器械共同包装,则在 2028 年 12 月 31 日之前有一个过渡阶段,如果该医疗器械继续符合MDD 的要求,则可以继续投放市场,前提是该医疗器械的设计和预期用途没有重大变化,并且符合MDR Article 120(3c)规定的其他条件。不过,MDR中有关医疗器械上市后监督、市场监督、警惕性和经济运营商注册的要求将适用。
4、医疗器械中辅助药用物质的磋商程序(Art 1(8))
4.1 对于已根据医疗器械MDD进行过咨询的辅助药用物质,需要进行哪种类型的咨询程序?Rev. May 2024
A、根据 MDR Article 52(9) ,如 MDCG Guidance 2020- 12 所阐明,对于已根据MDD或AIMDD进行咨询的辅助医疗物质,作为 MDR 规定的符合性评估的一部分,NB 通知机构需要请求与医疗产品主管当局进行咨询。
可以利用即将发生变更的机会(即对辅助用药物质的变更触发了后续咨询意见的需求),根据 MDR 要求提供意见。请参考下表,确定应提交完整的初次咨询意见还是后续(变更)咨询意见。
本指南仅适用于 EMA 咨询。 关于国家主管当局的医药产品咨询,请参阅其国家指南或与国家主管当局联系。
表 1. EMA 就 MDR 下的辅助药用物质进行的咨询,其中已根据MDD或AIMDD指令进行了咨询
5、辅助诊断的咨询程序
5.1. 辅助诊断需要进行哪种类型的咨询程序New May 2024
A、辅助诊断是一种体外诊断检测,通过确定患者适合或不适合接受治疗,支持安全有效地使用特定医药产品。
IVDR Article 2(7) 对辅助诊断定义如下: "辅助诊断 "是指对安全有效使用相应医药产品至关重要的设备,以便:
(a) 在治疗前和/或治疗期间,确定最有可能从相应药品中获益的患者;或
(b) 在治疗前和(或)治疗过程中,确定因使用相应药品治疗而可能增加严重不良反应 风险的患者;
MDCG 2020- 16 Annex II提供了一个流程图,用于确定体外诊断检测是否符合IVDR中辅助诊断的定义。
IVDR规定,辅助诊断须由NB机构进行符合性评估,并由医药产品主管部门就该器械与相关医药产品的适宜性进行咨询。
在签发欧盟证书之前,NB 必须就辅助诊断是否适用于相关药品征求 EMA 的科学意见,条件是
- 该药品完全属于药品授权集中程序的范围,或
- 该药品已通过集中程序获得授权,或
- 已通过集中程序提交了该药品的上市许可申请。
在其他情况下,NB 可以向国家医药产品主管部门或 EMA 征求意见。
关于 NB 向 EMA 征求科学意见的咨询程序,有一份程序指南。该指南附有一份关于实际安排的问答 (Q&A) 文件,以及一份关于涉及伴随诊断 (CDx) 的医药产品开发和评估的常见问题。

来源:北京倍力医疗技术服务有


