您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-30 18:09
前言
双抗(BsAb, bispecific antibodies)是双特异性抗体或双功能抗体的简称,是一种可以同时特异性结合两种抗原或同一抗原上的两个不同表位的人工抗体。在传统单抗的基础上,很多双抗进行了结构改造和修饰,保留了Fc片段,因而具有Fc介导的功能,如较长的血清半衰期,能发挥抗体依赖性细胞介导的细胞毒作用(ADCC)、补体依赖的细胞毒作用(CDC)和抗体依赖的细胞介导的细胞吞噬作用(ADCP)。部分双抗基于一些抗体片段进行重组但不含Fc片段,具有较短的半衰期,相对分子量较小,但在肿瘤组织的渗透性较高,具有较低免疫原性等特点[1],如blinatumomab在动物体内的半衰期为1-3 h,在人体的半衰期为2 h左右。本文将简介双抗药物的作用机制,并通过已上市双抗药物的申报资料[2],总结双抗类药物的药代动力学特征及及研究方法。
双抗药物的作用机制
截至目前,全球已获批13款双特异性抗体药物,如表1所示。目前已获批的13款双抗药物中,10款双抗均用于肿瘤的治疗,其余3款中emicizumab用于A型血友病、faricimab用于眼科疾病、bimekizumab用于银屑病的治疗。从作用机制来看,双抗的生物学功能主要包括如下类型[3]:
a、桥连细胞:如blinatumomab,桥连T细胞和肿瘤。
b、桥连受体:如amivantamab,同时靶向肿瘤表面的EGFR和c-Met受体,可以同时特异性阻断多条信号通路,以抑制蛋白或新生血管的生成。
c、桥连因子: 如emicizumab,通过同时桥联结合凝血因子IXa和凝血因子X,从而仿真FVⅢ的生理功能,促进凝血酶的产生。
表1. 已上市的双特异性抗体药物
*2017年退市。
#不含有Fc结构域
NSCLC: non-small cell lung cancer,非小细胞肺癌;wAMD: Wet age-related macular degeneration,湿性年龄相关性黄斑变性;DME: Diabetic macular edema. 糖尿病性黄斑水肿。DLBCL:diffuse large B-cell lymphoma,弥漫性大B细胞淋巴瘤。MM:multiple myeloma,多发性骨髓瘤。
友芝友生物制药在Antibody Therapeutics发表综述文章[4],将双抗的作用机制分为如下6种:
通过双抗招募T细胞对靶标细胞进行杀伤(图1B)。
双免疫检查点阻断。将双免疫检查点阻断剂整合到一种抗体中,同时抑制两个免疫检查点,增强免疫细胞对肿瘤细胞的击杀(图1C)。
通过双抗同时抑制两个信号通路(图1D)。
通过双抗进行共同定位阻断,抑制肿瘤细胞两个信号通路,提高抗肿瘤活性,获得比单一疗法更好的效果。图1E)。
双抗作用于同一个抗原的不同表位,增强抗体对肿瘤抗原的相互作用(图1F)。
肿瘤靶向调节免疫性双特异抗体—双抗结合肿瘤表面抗原后,通过另一个可以调节免疫细胞的靶点进行免疫细胞的调节,增强治疗效果(图1G)。

图1. 双抗的作用机制[4]
已上市双抗药物的药代动力学特征及药代动力学相关信息
1、临床前动物选择
抗体类药物的临床前动物种属选择一般根据药效实验决定,通过体外实验测试药物和靶点的亲和力或体外活性测试以决定相关动物种属。不同于单靶点的单抗药物,双抗需要选择与两个靶点高亲和力的相关动物种属,这为双抗药物的临床前动物选择可能带来挑战。如blinatumomab仅与大猩猩和人种属的CD19和CD3显示出亲和性,与食蟹猴、恒河猴、非洲绿猴、松鼠猴、狒狒、比格犬、大鼠、小鼠的CD19和CD3均无结合或弱结合。由于与啮齿动物没有亲和力,blinatumomab使用了鼠源的替代药物开展啮齿动物的相关研究。Mosunetuzumab的相关大动物种属为食蟹猴,但没有相关的啮齿动物,采用的是huCD20/CD3转基因小鼠开展相关研究。种属选择符合ICH S6指导原则的要求。
2、剂量线性
与单抗药物类似,双抗药物体现出与化学小分子药物不同的剂量线性特征。如amivantamab的剂量≥20 mg/kg/week时,在食蟹猴体内系统暴露量呈现线性,当剂量< 20 mg/kg/week呈现非线性PK,可能与靶点介导的药物处置TMDD(target-mediated drug disposition)有关。Glofitamab体内的清除率与剂量和循环系统的B细胞数量相关,表明TMDD也参与了药物消除。
3、性别差异
在已上市的双抗药物中,开展了性别差异比较的实验结果均显示没有性别差异。
4、给药途径与吸收
大部分通过IV、SC或IM等注射途径给药,用于眼科疾病的faricimab通过玻璃体注射(IVT)给药。通过非IV给药途径的生物利用度一般或良好,如elranatamab在SC给药后生物利用度为56%;emicizumab在SC给药后生物利用度为80%-93%,在腹部、上臂和大腿皮下不同部位进行SC给药后没有明显差异。
5、分布
已上市双抗均没有开展分布研究,和单抗类似,由于这些双抗分子量较大,一般认为分布在循环系统和细胞外液中。
6、消除
和单抗一样,已上市双抗药物均没有开展代谢和排泄的相关研究,一般认为其经体内蛋白水解而消除。
7、生物分析[5]
双抗类药物生物分析主要通过配体结合分析(Ligand binding assay)平台进行分析,考虑到双抗本身的结构,通常可采用总抗体(Total),游离X(Free X),游离Y(Free Y)和完整抗体(Intact)这四类检测形式(Assay format)。这里用配体作为捕获或检测关键试剂示例,也可以适用抗独特性抗体(Anti-idiotype antibody)作为关键试剂。需要根据双抗药物的靶点信息、抗体结构、研究阶段等选取合适的检测形式以及关键试剂。FDA指导原则[5b]推荐使用多个不同检测方法共同表征双抗药物的结构完整性和代谢情况,但是也需要注意方法之间的桥接和干扰,确保定量数据之间可以互相参考。
值得注意的是,对于特定类型的双抗药物,例如前药双抗(BsAb prodrug),这类药物通常结构复杂,具有遮蔽肽(Masking peptide)等结构,在体内的代谢形式包括了完整形态以及X活性形态,Y活性形态以及X和Y活性形态等。由于结构复杂,因此需要检测的分子类型较多,很难通过经典的配体结合来进行分析,更适合使用基于免疫富集的LC/MS平台进行分析,通过检测特征性肽段(surrogate peptide)来评估双抗药物的完整性。

图2. 双抗生物分析检测形式示意图
8、免疫原性及生物分析
由于双特异性抗体的分子结构非自然存在,增加了其产生免疫原性的可能性,同时降低了药物的安全性和疗效,还可能导致通过形成抗药抗体,诱发严重的药物相关毒性反应或过敏反应。但根据目前上市双抗的临床资料来看,形成抗药抗体的几率较低。如emicizumab在临床研究中发现了4名患者产生了ADA,约占为2.8%。在食蟹猴的MTD研究中所有的食蟹猴在给药168-336 h后,虽然glofitamab均出现了很强的ADA效应(12/12),但在临床研究中产生ADA的几率仅为1.1% (5/448)。Blinatumomab在临床研究中<1%的患者产生ADA。Mosunetuzumab的临床研究中评估了418名患者的免疫原性,均没有检测到ADA,可能与药物的作用机制有关,因为mosunetuzumab活化T细胞杀伤B细胞导致B细胞耗竭。
通常需要根据研究阶段选择双抗类药物的免疫原性研究内容[6],例如在早期临床前研究阶段,进行总抗药抗体(ADA)的分析可辅助PK/TK数据的解读;在新药临床试验申请(IND)阶段需要增加免疫毒性以及免疫细胞分型的分析;在临床研究阶段需要根据实际情况进一步完善免疫毒性或者中和抗体(Nab)的分析。
对于最常见的总抗药抗体的分析,通常使用经典的桥接法的ADA检测形式(图3),使用筛选、确证和滴度三步法进行ADA的半定量分析。
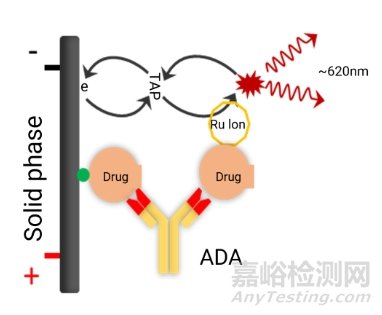
图3. ADA桥接法检测形式示意图
9、细胞因子释放综合征(CRS)
上市的双抗药物以CD3靶点居多,CD3较高的亲和力可导致双抗在尚未结合肿瘤细胞时就活化T细胞,诱发IFN-γ、IL-6、TNFα、IL-2、IL-2R和IL-8等细胞因子快速剧烈地释放,引发细胞因子风暴。另外,双抗的Fc结构域与其他效应细胞表面的FcR结合,也可能会诱发细胞因子风暴。Catumaxomab结合至免疫细胞和肿瘤细胞后将启动前炎性因子和细胞毒性细胞因子的释放,约90%的患者出现发热、恶心、呕吐和寒战等细胞因子释放综合征症状。在临床研究中,为了控制疼痛和发热,在catumaxomab给药之前先用对乙酰氨基酚处理。尽管进行了预防性用药,但仍有较大比例的患者出现了3级以上的不良反应。由于副作用较大,catumaxomab于2017年官宣退市。
Glofitamab在给药前用obinutuzumab预处理以降低外周B细胞数量,从而降低CRS风险,由于可能的严重副作用,glofitamab批准上市时加了黑框警告。elranatamab也可引起CRS,因此临床上推荐逐步增加剂量以降低CRS风险,elranatamab批准上市时加了黑框警告。
对于CD3靶点的双抗在开展非临床PK实验时,建议逐步增加剂量开展PK实验,低剂量给药后观察几天,待动物没有明显的临床反应再逐步增加剂量。
10、药物相互作用[7]
2023年6月FDA发布了治疗性蛋白的药物相互作用的指导原则,指出一些促进细胞因子释放的药物,如blinatumomab会导致促炎细胞因子(例如IL-6)水平增加而下调细胞色素P450(CYP450)酶的表达,从而降低作为CYP450底物的药物的代谢并增加其暴露水平。由于多数上市的双抗有诱导细胞因子释放的风险,在临床上合并用药的情况下,对于CYP450的底物可能需要监测其浓度变化情况,并根据需要对用药剂量进行调整。
Mosunetuzumab在FDA的上市申请资料里包括了基于IL-6和CYP3A4相互作用的生理学药代动力学(PBPK)建模研究,表明mosunetuzumab引起的细胞因子释放对细胞色素P450酶表达或活性风险较低。咪达唑仑的浓度-时间曲线下面积(AUC)和最大浓度(Cmax)比值在合用与不合用mosunetuzumab 的情况下预测值分别为1.37和1.17。因此mosunetuzumab与CYP3A底物的小分子药物合用时,不建议调整其剂量。
11、首次人体剂量预测
曾经靶向CD28的T细胞激动剂TGN1412的临床经验值得汲取[8]。CD3高的亲和力也可能会导致双抗过度活化T细胞,引发细胞因子风暴。不合适的临床剂量也可能导致严重的临床事故。安全起见,CD3靶向的双抗在首次临床剂量设计时推荐使用MABEL的方法[9]。例如glofitamab首次人体剂量采用的就是MABEL的方法。
结语
相比于单抗,双抗由于能同时靶向两个靶点,有更好的特异性,降低脱靶毒性等优势,已成为抗体药物研发的新方向。同时,三抗、多特异性抗体以及双抗ADC等新的药物形式也陆续涌现,这也将为病患提供更多和更优的治疗选择。目前药明康德DMPK已服务十余家客户的双抗项目,团队具有丰富的PK项目和生物分析经验,希望能助力双特异性抗体类新药的开发和研究。
参考文献:
[1] Labrijn AF, Janmaat ML, Reichert JM,et al. Bispecific antibodies: a mechanistic review of the pipeline. Nat Rev Drug Discov, 2019, 18, 585-608.
[2] 上市双抗药物的pharmacology review.
[3] NMPA, 2022年11月《双特异性抗体类抗肿瘤药物临床研发技术指导原则》。
[4] Zhang J, Yi J, Zhou P. Development of bispecific antibodies in China: overview and prospects. Antib Ther. 2020, 3, 126-145.
[5] (a) Lee J W, Kelley M M, King L, et al. Bioanalytical Approaches to Quantify “Total” and “Free” Therapeutic Antibodies and Their Targets: Technical Challenges and PK/PD Applications Over the Course of Drug Development[J]. Aaps Journal, 2011, 13, 99-110. (b) FDA guidance, 2021年5月,Bispecific Antibody Development Programs.
[6] Gorovits B, Wakshull E, Pillutla R, Xu Y, Manning MS, Goyal J. Recommendations for the characterization of immunogenicity response to multiple domain biotherapeutics. J Immunol Methods. 2014, 408, 1-12.
[7](a)FDA guidance, 2023年6月,Drug-Drug Interaction Assessment for Therapeutic Proteins Guidance for Industry. (b) Lee J, L Zhang, AY Men, LA Kenna, and SM Huang, CYP-Mediated Drug-Therapeutic Protein Interactions: Clinical Findings, Proposed Mechanisms and Regulatory Implications, Clin Pharmacokinet, 2010, 49, 295-310. [c ] Le Vee, M., Lecureur, V., Stieger, B. & Fardel, O. Regulation of drug transporter expression in human hepatocytes exposed to the proinflammatory cytokines tumor necrosis factoralpha or interleukin-6. Drug Metab. Dispos. 2009, 37, 685–693.
[8] Goodyear M. Learning from the TGN1412 trial. BMJ. 2006, 332, 677-678.
[9] Trivedi A, Stienen S, Zhu M, et al. Clinical Pharmacology and Translational Aspects of Bispecific Antibodies[J]. Clinical and Translational Science, 2017, 10, 147-162.

来源:药明康德DMPK


