您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-31 08:39
1、背 景
核苷由杂环碱基和糖组成。核苷酸有一个额外的磷酸基团。核苷、核苷酸和五种天然核苷基的结构在图1中显示。寡核苷酸是通过磷酸二酯基团连接在一起的核苷的线性聚合物。磷酸二酯连接一个核苷的3′-羟基到下一个核苷的5′-羟基。
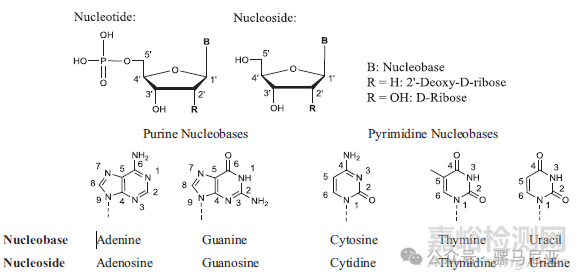
图1:核苷酸、核苷和碱基的结构和编号。
传统上固相合成使用基于CPG的载体;目前已经有更新的交联 polystyrene 和methacrylate载体投入使用。载体可以预先装载一个单体,也可以使用通用型(UnyLinker)的不装载单体,结构可以参考图2.

图2:(a)预装载了一个核酸单体(b)universal UnyLinker™ solid support
载体表面的羟基或氨基功能团通常通过spacer和linker与第一个单体选择性地结合。长链spacer会使末端功能团与表面保持距离,减少空间位阻。linker对合成中使用的试剂的化学稳定性很重要,因为寡核苷酸链通常在其3′端锚定,必须在合成过程中保持与载体相连。大多数linker能抵抗酸性和温和碱性条件,并在碱性环境中可裂解。这允许在不影响linker的情况下移除酸敏感DMTr基团。
亚磷酰胺单体固相合成的基石,在固相合成中,5′-羟基、杂环氨基和2′-OH,以防止合成过程中的副反应。单体结构及常见保护基团见图3。保护基团被设计为在不同的pH值下选择性地移除。保护基团的选择性移除暴露了所需的功能团,并确保了反应选择性的控制。由于主要的5′-羟基是比次级的3′-羟基更好的亲核试剂,在标准单体中,磷酰胺基团位于3′位置,合成方向为3′-5′。然而,在某些情况下,例如寡核苷酸的合成后偶联,反向合成即从5′到3′方向的合成是可取的。在这种情况下,使用位于5′位置的亚磷酰胺基团的反向胺化物。
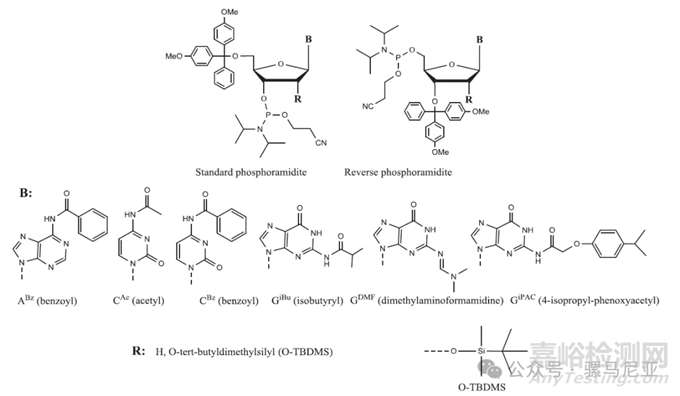
图3:亚磷酰胺和通常用于核碱基及2′-OH的保护基团的结构。在标准和反向亚磷酰胺单体中,5′-OH和3′-OH分别用DMTr保护。
碱基修饰影响碱基配对,核糖的修改影响结合亲和力和核酸酶稳定性,而磷酸二酯主链的修改调节分子对核酸酶的稳定性。锁核酸(LNA)在构象上受限,形成A型双链,因此对互补的单链RNA和DNA具有更高的结合亲和力。相比之下,未锁核酸(UNA)非常灵活,用于调节双链特性;硫代寡核苷酸显示出改善的酶稳定性,并增加了与血浆蛋白的结合,从而导致肾排泄的减少。然而,它们对RNA的结合亲和力减弱,组织半衰期仍不够理想。引入2′修饰可以解决这些问题中的一部分,提供额外的核酸酶保护,并增强效力和药代动力学属性。硫代主链、2′-F和2′-OMe是最常见的修饰。
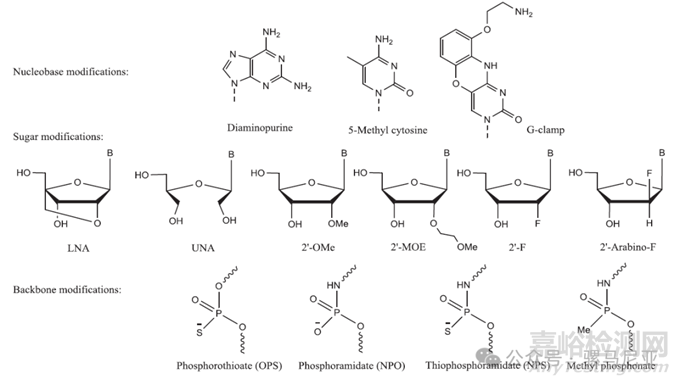
图4:一些碱基、糖和磷酸链的修饰。
Oligo的合成主要由图5四个循环组成:
1. 用酸移除5′-OH上的DMTr保护基团,使羟基可用于偶联反应;
2. 通过将核苷磷酰胺连接到5′-OH上来延长寡核苷酸链;
3. 偶联反应后新加上的核苷酸通过亚磷酯键(磷为三价)与 前一个的寡核苷酸链相连,此亚磷酯键不稳定,易被酸、碱水解,因此需将此处三价磷氧化为五价的磷。;
4. 未反应的5′-OH基团被盖帽以防止在接下来的偶联循环中延长。盖帽可以在氧化/硫化前后进行。
此循环重复进行,直到组装出所需长度的寡核苷酸。随后从载体上裂解寡核苷酸,并去除保护基团以完成合成。然后对粗制样品进行纯化,以达到所需的纯度。

图5:oligo固相合成的步骤示意图,一般从3’向5’方向合成。
2、相关杂质
在寡核苷酸合成中,最终产品的质量主要取决于亚磷酰胺、固相载体和其他试剂的质量。由于固相合成的重复性质,起始材料的质量更为重要,这是由于起始物料中即使少量的杂质也会在最终产品中产生大量的杂质。SM的杂质可以是反应性的或非反应性的,关键的或非关键的。反应性但非关键性杂质在偶联步骤中发生反应,但在纯化过程中被移除,对产品质量没有影响。关键性反应性杂质最终会出现在最终产品中,应在起始材料阶段进行控制。非反应性SM杂质在合成的洗涤步骤中被移除,对最终产品质量没有影响。
2.1 脱DMTr步骤:
常用二氯乙酸(DCA)释放DMTr阳离子,产生橙色。随后留下一个自由的5′-羟基作为后续反应位点。在脱DMTr过程中的颜色变化可以用于间接监测偶联效率。在载体上,新循环中的亚磷酰胺单体与表面上潜在可用的功能团的反应会导致寡核苷酸缺失第一个残基或产生(n-1)副产物。这种杂质不容易通过样品纯化去除,因此在载体的制造过程中盖帽载体的反应位点非常重要。
在酸处理脱去DMTr时,碱基部分会形成脱嘌呤杂质,脱嘌呤化的程度取决于碱基的保护基团,有些保护基团导致的脱嘌呤化比其他保护基团更多。
在通用载体中由DMTr保护的OH基团是次级羟基(图2b),它的反应性低于与预装单体的5′-羟基(见图2a),脱保护需要更长的酸接触时间,其与进入的磷酰胺反应速率也较慢,这可能导致(n-1)杂质的形成。延长首次脱保护和偶联时间是减少此类杂质的好方法。
商用DCA溶液(在二氯甲烷或甲苯中)可能含有低水平的三氯乙醛,三氯乙醛与寡核苷酸的末端自由羟基反应形成半缩醛,该半缩醛对进入的磷酰胺具有反应性。它产生一个寡核苷酸杂质,其质量比全长产品(FLP)高出147 Da,如图6所示。
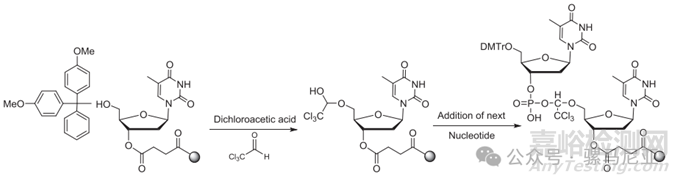
图6:二氯乙酸中存在的三氯乙醛杂质在合成的脱DMTr步骤中反应,形成的杂质比全长产品(FLP)的质量高出147 Da。
未经过优化的DCA接触时间会导致产量损失和(n-1)杂质的形成。在任何一个脱保护不完全的周期中,仍被保护的5′-羟基不会参与合成周期中的任何步骤,从而减少产量。在随后的脱保护中,错过一个周期,一些或所有仍被保护的羟基被脱保护并参与链延长,导致(n-1)杂质。
另一方面,过度酸性暴露会导致脱嘌呤杂质的产生,即嘌呤碱基与其脱氧核糖部分之间的N-糖苷键的断裂(见图7),在酸性条件下加速,并在长2′-脱氧寡核苷酸序列的合成中容易被观察到。酸的类型、浓度和接触时间在去嘌呤过程中也起着重要作用。
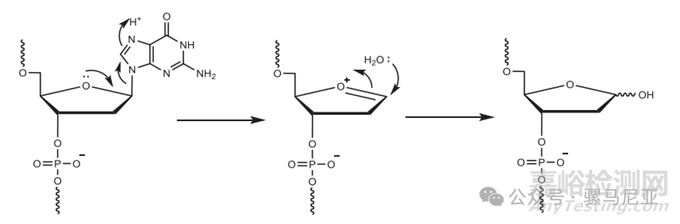
图7:酸性条件下脱嘌呤的机理
2.2 偶联步骤
为了使合成成功,每个循环中都需要高的偶联效率,随着寡核苷酸长度的增加,偶联次数的增加,总收率会迅速下降。失败序列,即比FLP短的寡核苷酸,是偶联步骤中最常见的杂质。
盖帽步骤通过乙酰化未反应的基团来防止失败序列的链延长。在脱保护过程中去除乙酰基,导致失败序列的长度从比FLP短一个核苷酸的(n-1)到仅有一到两个核苷酸长。在没有有效盖帽的情况下,它们将增长并最终形成(n-1)杂质。对(n-1)杂质的序列分析表明,它包含了所有可能的(n-1)序列,其中在3′-5′合成中,3′端的截断核苷酸的频率高于5′端。
高分子量杂质(标记为[n + 1]、[n + 2]等)是另一类杂质。它们源于活化剂的酸性,活化剂是一种弱有机酸,通常是四唑,与进入的磷酰胺混合,以提高偶联步骤的效率。活性磷酰胺随后在亲核取代反应中与生长中的寡核苷酸的5′-羟基反应,活化剂的酸性可以部分去除磷酰胺溶液中的DMTr基团,导致二聚体的形成,二聚体磷酰胺的后续偶联会导致长链体杂质。
长链体形成的程度还取决于寡核苷酸的核碱基组成(dG > dA > dC > T)、接触时间和活化剂的酸性。
在储存或合成过程中碱基保护基团的丢失也会导致分支杂质的形成,未保护的外环氨基会与进入的磷酰胺反应,形成两个分支链,如果这种情况发生在载体的残基上,所得产品的质量将是预期质量的两倍。
2.3 氧化/硫代步骤
偶联后形成的三价磷在随后循环中在脱保护的酸性条件下不稳定,因此应氧化为稳定的五价磷。最常用的氧化剂是碘在四氢呋喃/吡啶/水的溶液。偶联步骤对湿度敏感,系统中任何来自氧化剂的残留水分必须在下一个偶联前用乙腈洗去。
或者通过将一个硫原子转移至三价磷并将其转换为五价磷来形成一个硫代磷酸酯键。PADS和ADTT是两种常见的硫化试剂。当合成同时含有磷酸二酯(PO)和硫代磷酸二酯(PS)的寡核苷酸时,一个周期中使用的氧化试剂可以将前几周期形成的一些PS键转化为PO,导致杂质的质量比FLP低16 Da。
不完全氧化/硫化是含有DMTr-磷酸酯部分的两类杂质的原因,随后脱保护产生的DMTr阳离子可以与不完全氧化产生的磷酸酯三酯中间体反应,形成含有对酸稳定的DMTr基团的寡核苷酸(见图9)。第一类杂质由一组失败序列组成,由于5′-末端DMTr-C-磷酸单酯,其质量比预期高366 Da。第二类包含具有内部DMTr-C-磷酸二酯部分的失败序列,其质量比预期高出286 Da。

图 9. 由于氧化/硫化不完全而形成的DMTr杂质。杂质的质量比失效序列高 366 Da,或比全长产物 (FLP) 高 286 Da。
在由于氧化不完全引起的链断裂的另一种机制中,磷酸酯三酯导致H-磷酸酯将继续进行链延长。在断裂和脱保护(C&D)步骤中,H-磷酸酯键被降解,产生表现为失败序列的降解产物。
2.4 盖帽步骤
盖帽反应通过使用两种试剂Cap A和Cap B来乙酰化反应性官能团,防止在不希望的位点发生延长。Acetic anhydride in 2,6‐lutidine/ THF是最常见的Cap A试剂,而Cap B是如N‐methylimidazole in THF这样的碱,并作为乙酰化反应的催化剂。
在实践中,盖帽可以在氧化步骤之前或之后进行。在某些情况下,先盖帽,随后进行氧化,然后进行第二次盖帽可能会改善合成产率。
乙酰酐盖帽试剂可以将保护的鸟嘌呤核碱基转化为乙酰化的二氨基嘌呤,其质量比预期高出41 Da(图10),优化投放试剂的体积和试剂接触时间可以显著减少杂质。
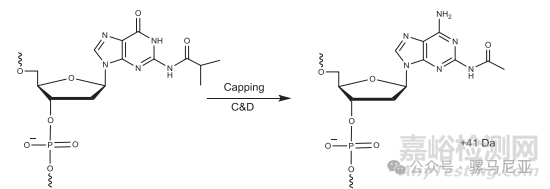
图 10. Conversion of protected guanine to N2 ‐acetyl‐2,6‐diaminopurine during capping.
在合成结束时,DMTr基团可以被移除或保留在寡核苷酸上以便于其纯化,用碱处理载体,通常是浓氨水或氨水/甲胺(AMA)的混合物,使寡核苷酸从载体上断裂并脱除碱基的保护。快速且干净地从载体上移除寡核苷酸很重要,否则,由于连接物移除不完全,会检测到比FLP更大质量的杂质。
根据使用氨水还是AMA,不完全的断裂会导致杂质的质量比FLP高出261或275 Da(如果与支持体的连接是硫代磷酸酯,则杂质的质量会高出16 Da)。在较高温度下用氨水或AMA长时间孵育会将它们转化为最终产品。

图 11. 从 UnyLinker 中完全(a)和不完全(b、c)裂解寡核苷酸。不完全裂解产生的杂质质量比全长产物(FLP)高 261 或 275 Da
当附着在固体支持体上的寡核苷酸是RNA时,已失去TBDMS保护基团的RNA的自由2′-OH与支持体上的羟基竞争攻击磷,2′-OH的反应生成一个带有3′-末端磷酸基的寡核苷酸。一旦形成末端磷酸基,从寡核苷酸中去除它很困难,这将导致杂质。
UnyLinker也可能包含一种可以并入寡核苷酸的二聚体杂质。这导致形成与产品相关的杂质高于FLP分子量442、460和478 Da(硫代磷酸酯连接继续高出16 Da)。
在RNA中,去除iBu保护基(G的保护基)(最难去除的之一)需要在55°C下孵育几个小时,对于富含dG的序列则需要更长时间。iBu的不完全脱除将导致一种杂质,其质量比FLP高出70 Da。使用AMA脱保护可以缩短反应时间,但增加了生成质量比FLP高出14 Da的杂质的可能性。
图12显示甲胺可以与cytidines中的C-4反应,生成N‐4‐methyl cytidine。在胞嘧啶上使用乙酰基保护基团可以减少这种杂质。

图12. 甲胺与胞嘧啶残基(此处显示为带苯甲酰保护基团)在氨解过程中的反应生成N-4-甲基胞嘧啶,其质量比胞嘧啶高14 Da。
在更苛刻条件guanosine脱保护条件下,也可能在硫代磷酸酯寡核苷酸中引起PS至PO的转化。最佳孵育时间是足以完全去除鸟苷的保护还必须将PS至PO的转化降至最低(孵育时间取决于序列)。
磷酸上去除的氰乙基保护基形成丙烯腈,这是一种高度活性的试剂。它与不同的碱基形成加合物;guanosine的N‐7,thymidine and cytidine的N‐3,以及adenosine的N‐1和N‐6。一旦与DNA中的核苷碱基反应,氰乙基随后可以水解为羧酸,导致氰乙基化和羧乙基化加合物的混合物。然而,在寡核苷酸合成中,已显示丙烯腈对胸腺嘧啶的N‐3位置更具反应性,这导致比FLP质量高出53 Da杂质(图13)。在氨解之前用的二乙胺或三乙胺的ACN溶液清洗与寡核苷酸结合的载体将防止这种杂质的形成。
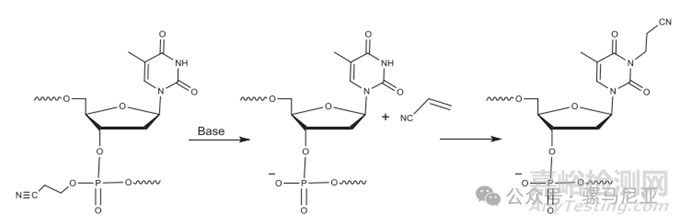
图 13. Reaction of acrylonitrile with thymine nucleobase.
在脱保护过程中发生的脱嘌呤(图7)不会干扰后续的偶联和链延长,然而,氨解过程中的氨处理将导致在脱嘌呤位点处寡核苷酸的断裂。醛式互变异构体与半缩醛处于平衡状态,与氨反应,通过β-消除引起链断裂(图14)
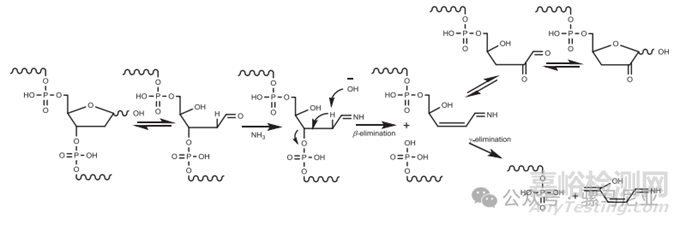
图14. Cleavage of apurinic sites during cleavage and deprotection (C&D).
在脱嘌呤位点的链断裂给寡核苷酸的DMTr ON纯化带来了挑战。在正常的纯化中,FLP将有一个5′-末端DMTr,而失败序列的产品将有一个末端5′-羟基,使用反相柱在氨解后容易分离,然后通过酸处理在柱上移除5′-DMTr。在氨解过程中脱嘌呤位点的断裂形成含有末端三苯甲基DMTr的短链,与FLP一起纯化容易导致与FLP产品共流出。在氨解之前用盐酸赖氨酸溶液处理将在脱嘌呤位点切断寡核苷酸并移除含有DMTr的5′-末端。仍附着在支持体上的剩余3′-端部分不含DMTr,容易从的FLP中分离纯化出来。
氨解的碱性条件可以在脱氨基过程中将cytidine和adenosine中的外环胺变为羰基。deamination在细胞中自然发生;由脱氨基酶催化,但在生理条件下也可以非酶促地发生。非酶催化的脱氨基作用由酸和碱催化,在高温下加速。cytosine和5‐methylcytosine残基的deamination发生得比adenosine快。deamination杂质与母分子之间只有一个质量单位的差异。
RNA在氨解的碱性条件下稳定性较低,且需要额外步骤去除2′-OH保护基团,这两者都可能导致在DNA中未观察到的额外杂质。RNA中2′-羟基的最常见保护基是叔丁基二甲基硅烷(TBDMS)。TBDMS的不完全去除将导致在RP-HPLC中在母峰之后洗脱的杂质,其质量比FLP高出114 Da。TEA-3HF 等有机氟盐中的氟离子可用于 TBDMS 的脱保护。否则,2′-羟基暴露在碱性条件下很可能导致链断裂。这将导致形成环状磷酸盐、5′-2′异构化和 3′-截短序列。5′-3′ 与 5′-2′连接的异构化的分子量是不变的,但 5′-2′异构化杂质可通过色谱法与母体分离。
在用甲胺对RNA进行氨解时,与uracil碱基的副反应可导致质量比FLP低52 Da和95 Da的杂质(图15)
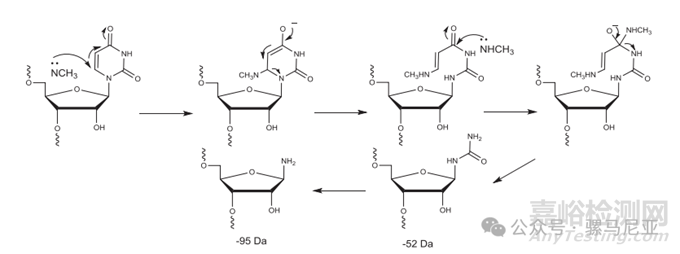
图 15. 甲胺与尿嘧啶碱基的反应。
2′-F修饰的寡核苷酸具有增加的结合亲和力,但已与非特异性结合到细胞蛋白和毒性相关,氟的独特性质可能导致在其他修饰的寡核苷酸中未见的杂质。2′-F修饰的寡核苷酸在苛刻的C&D条件下可能导致HF的丢失,这之后是水分子的添加。最终结果是2′-F被羟基替换,并伴随着2′位置的立体化学反转。
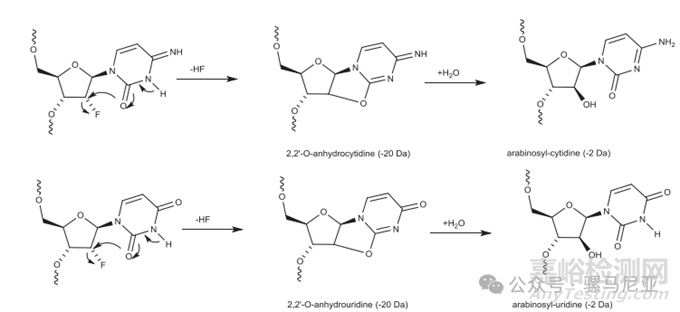
图 16. 2’-F-cytidine and 2’-F-uridine的HF消除
2.5 降解产物
第一种降解途径是脱嘌呤,其速率依赖于pH值,在DNA中,鸟嘌呤的掉落速率稍高于腺嘌呤。在低pH值、高温、有亲核试剂存在的情况下,脱嘌呤速率加快。双链DNA的脱嘌呤速率大约是单链DNA的四分之一。脱嘧啶作用的速率要慢得多,大约是脱嘌呤速率的5%(Shapiro, 1981)。由于存在2'-OH,RNA的脱嘌呤速率比DNA慢约500倍。该过程产生一个嘌呤碱基和一个缺失碱基的寡核苷酸。缺失碱基的核糖与其互变异构的开环醛形式处于平衡状态,该形式不稳定并会导致β-消除和磷酸二酯键的断裂。
在无碱基RNA位点发生的链断裂可以通过β-消除机制(如图14所示)或2',3'-环磷酸机制(如图17所示)实现。在弱酸性条件下,β-消除机制更占主导地位,而在碱性条件下,2',3'-环磷酸形成是主要机制。相反,DNA链断裂主要通过β-消除发生。无碱基RNA比无碱基DNA更稳定;无碱基RNA的总体链断裂速率比无碱基DNA慢16.8倍。核苷间的断裂和磷酸基迁移比RNA中的糖解过程更快。
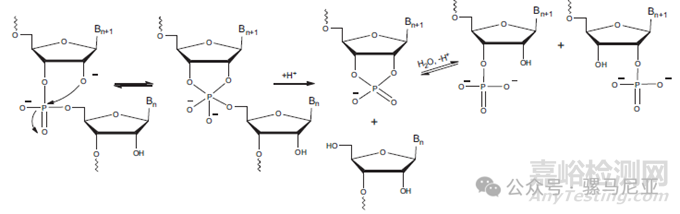
图17:碱性条件下RNA的水解
胞嘧啶转化为尿嘧啶是第二种降解途径,在碱性条件下发生得更快。腺苷的Deamination也可能发生,但速度慢50倍
在RNA中,磷酸二酯键的直接水解是第三种降解途径。在酸性和碱性条件下,RNA链断裂都可能发生。在碱性溶液中,磷酸二酯键会形成2'-3'环磷酸中间体,这些中间体水解成2'和3'磷酸的混合物(图17)。由于2'-OH基团作为内部亲核试剂,RNA中的磷酸二酯键水解速度比DNA快得多。
在酸性条件下,非桥接磷氧被质子化,随后2'-羟基基团攻击磷形成环磷酸(图18)。环磷酸可以在不发生键断裂的情况下转化为2'-磷酸异构体,也可以被切断形成两个片段。酸水解可以用于RNA的序列测定。
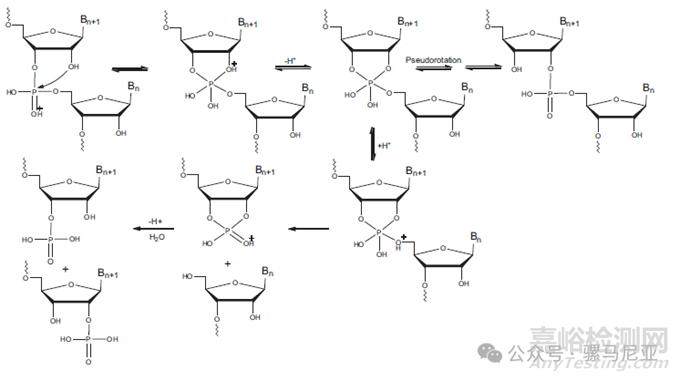
图18:酸性条件下RNA的水解
2.6 强降解产物
A. 酸降解
糖苷键对酸水解的敏感性取决于核糖的2'-位修饰。含有脱氧核苷酸和2'-MOE或2'-OH以及2'-修饰核苷酸(2'-OMe、2'-F)混合物的寡核苷酸,在pH 2-3下于室温处理几小时,并不会导致核苷间连接的断裂或形成较短的寡核苷酸。相反,观察到的是DNA碱基中的腺嘌呤和鸟嘌呤丢失,并伴随着水分子的加成。2'-OH、2'-MOE、2'-OMe和2'-F修饰的残基对酸处理具有显著的抗性。
B. 碱降解
与引起脱嘌呤作用的酸性条件不同,DNA在碱性条件下更稳定。然而,在高pH值和高温下,DNA会降解成多种产物。在1M NaOH和70°C下,腺苷的碱水解会导致开环、脱嘌呤和腺嘌呤的丢失,而鸟苷在这些条件下更稳定。无碱基位点在碱性条件下比在酸性条件下更容易断裂,导致形成较短的片段。在碱性条件下,另一个反应是胞苷的deamination。此外,在强碱性条件下,胞苷会以较慢的速度发生开环。
与在碱性条件下相对稳定的DNA不同,由于2'-OH的反应性,RNA在高pH值下不稳定。链断裂仅发生在未修饰的核糖核苷酸残基上,而2'-修饰的核酸不受影响。
C. 氧化
电子丰富的核苷碱基是氧化剂的主要目标;它们很少导致链断裂,但涉及热或碱的后续环境会导致脱糖基、β-消除和链断裂。糖也易受氧化攻击,随后直接引发链断裂。核苷碱基对氧化剂的反应不同,因此,与糖基目标相比,核苷碱基的反应更具位点特异性。
硫代磷酸酯H₂O₂溶液敏感,其骨架被氧化成磷酸二酯键。多个连接可以被氧化,产生的产物统称为PO杂质,它们常在IP-RPHPLC分析中与主峰共洗脱。
此外,含有2'-脱氧和2'-F修饰残基的寡核苷酸在氧化条件下导致脱氧核苷酸处的核苷间裂解,形成在IP-RP中早洗脱的峰。丢失鸟嘌呤碱基并伴随链断裂更为常见。在色谱图中还检测到多个难以分辨的峰,其质量比FLP高16 Da,对应于氧加到鸟嘌呤上形成8-氧鸟嘌呤。脱氧鸟苷比其他核苷酸更容易被氧化;鸟嘌呤首先被氧化成8-氧鸟嘌呤,形成更好的离去基团。8-氧鸟嘌呤及其互变异构体的结构如图19所示。
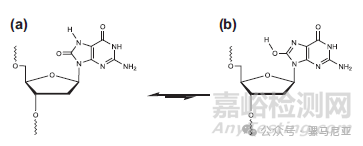
图19:8-氧鸟嘌呤及其互变异构体
D. 高温
随着温度的升高,所有可能的降解途径都会加速。图20显示了冷冻干燥形式的gapmer对照样品和高温降解样品的叠加UV色谱图和主峰的质谱图。将样品在80°C下孵育29天,导致大量的脱嘌呤和脱氨基反应。还观察到由无碱基位点断裂形成的较小片段。在IP-RP色谱图中,主峰前洗脱的大多数降解产物是由无碱基位点断裂形成的较小片段。检查主峰的质谱图显示,在主峰下有几个降解产物。

图20:gapmer对照样品和高温降解样品的叠加UV色谱图
首先,PO杂质的轻微增加表明高温导致硫代寡核苷酸的去硫反应。鸟苷和腺苷的脱嘌呤以及水的加成是第二种降解产物,在高温降解样品中含量较高。此外,在主峰下检测到一个质量比FLP高80 Da(图20中-4电荷状态信号为1724.1 m/z)的杂质,这在对照样品中不存在。该杂质的拟议结构如图21所示。这是当5-甲基胞嘧啶或胞嘧啶残基与4-氧代戊醛(一种可能的脱嘌呤副产物)反应时形成的。
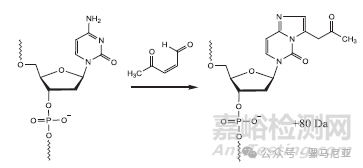
图21:在高温降解条件下胞嘧啶残基与 4-氧代戊醛的反应。
色谱图主峰后区域的检查显示存在几个组分。它们是由FLP与已脱嘌呤的分子反应形成的。这些杂质的形成机制如图22所示。一个链的外环氨基与第二链的无碱基位点反应将两条链连接起来。此处所推测结构仅基于分子量的一致性。
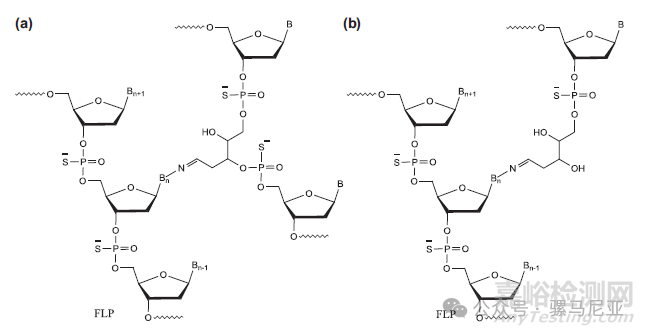
图22:核碱基Bn与另一链的无碱基位点相连,Bn可以是胞嘧啶或鸟嘌呤。
(a)由于腺嘌呤或鸟嘌呤的丢失, FLP与另一链的无碱基位点相连。(b)FLP与另一链的3'-末端相连,该链从3'末端丢失了4或5个核苷酸(n-4或n-5)
一个含有2'-F和2'-OMe修饰的固体粉末形式的高温降解双链RNA样品,在氮气吹扫下,与氧气吹扫的样品和未吹扫的样品表现出类似的降解。这表明降解机制不依赖于氧气。观察到的降解产物比母体少20和2 Da。它们对应于从一个2'-F修饰残基上失去HF,然后加水形成阿拉伯糖基核苷酸(图16)。溶液中降解样品检测到的降解产物与固体粉末形式样品的降解产物相同。
E. 光照降解
将gapmer寡核苷酸在固体粉末形式下用UV照射,会导致早洗脱组分和晚洗脱峰的增加,类似于图20中观察到的情况。主峰的质谱分析显示,PO杂质显著增加。降解样品与在暗处保存的对照样品的UV色谱图之间最明显的区别是出现了一个洗脱时间更晚且质量是FLP两倍的峰。该杂质的拟议结构是一个通过嘧啶的链间光环加成反应将两条单链融合在一起的光二聚体,如图23所示。
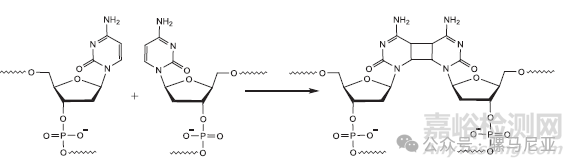
图23:寡核苷酸暴露在紫外线下形成的光降解二聚产物。
在光解应激下,样品的水溶液与固体粉末样品相比,降解谱图有一些不同。溶液中的样品在IP-RP色谱图中显示出更多的早洗脱峰。核苷间连接的断裂在溶液中比在固体形式下发生得更快。虽然PO杂质的增加保持不变,但在溶液中脱嘌呤更为普遍。光解脱嘌呤的机制尚不确定,但脱嘌呤种的质量与失去鸟嘌呤并伴随一个质子或水的加入一致(未观察到腺嘌呤的丢失)。主峰的质谱图还显示两个组分,质量比FLP高32Da和低20Da。
另一个序列中不含鸟苷的gapmer的光解降解没有显示出这些杂质,表明它们与鸟苷残基有关。鸟嘌呤碱基比其他碱基更容易被氧化。提出的假设是这些降解产物是由鸟嘌呤碱基转化piroiminodihydantoin和oxaluric acid(图24)

图24:质量分别比鸟嘌呤高 32 Da 和低 20 Da piroiminodihydantoin和oxaluric acid的结构。
在光解应激下的溶液样品的UV色谱图中,还存在一个洗脱时间较晚的峰,其质谱比固体样品中观察到的更加复杂。虽然形成了相同的光二聚体,但存在其他未鉴定的产物,这表明光照可能涉及多种高分子量产物的形成机制。
常见杂质和降解物相对于全长产品的平均质量和exact mass差异。
|
Δ Mass (Ave.) |
Δ Mass (Mono.) |
Problem |
Affected Locations |
|
-0.98 |
-0.984 |
Deamination |
C |
|
-1.99 |
-1.9957 |
Arabinosyl-C, arabinosyl-U |
2′F-C, 2′F-U |
|
14.03 |
14.0156 |
Reaction with methylamine |
C |
|
-16.07 |
-15.9772 |
PS-PO conversion |
Backbone |
|
-20.01 |
-20.0062 |
Loss of HF |
2′F-C, 2′F-U |
|
41.05 |
41.0266 |
Acetylated diaminopurine |
G |
|
42.04 |
42.0106 |
+Acetyl |
C |
|
-52.03 |
-51.9949 |
Reaction with methylamine |
U |
|
53.06 |
53.0265 |
+Cyanoethyl |
Backbone |
|
70.09 |
70.0419 |
+Isobutyryl |
G |
|
79.98 |
79.9663 |
+PO (phosphate) |
5′ or 3′ terminal |
|
80.08 |
80.0262 |
Reaction with 4-oxo-pentanal |
C |
|
-95.06 |
-95.0007 |
Reaction with methylamine |
U |
|
96.05 |
95.9435 |
+PS (phosphothioate) |
5′ or 3′ terminal |
|
104.11 |
104.0262 |
+Benzoyl |
A |
|
114.26 |
114.0865 |
+Tert-butyl dimethylsilyl |
Ribonucleotides |
|
-117.12 |
-117.0439 |
Depurination |
A |
|
-133.11 |
-133.0388 |
Depurination |
G |
|
-135.13 |
-135.0545 |
Depurination (gas phase) |
A |
|
147.39 |
145.9093 |
+Chloral |
Backbone |
|
-151.13 |
-151.0494 |
Depurination (gas phase) |
G |
|
261.13 |
261.0038 |
Incomplete cleavage from UnyLinker |
5′ or 3′ terminal |
|
275.15 |
275.0195 |
Incomplete cleavage from UnyLinker |
5′ or 3′ terminal |
|
286.37 |
286.1358 |
DMTr-C-phosphonate |
Backbone |
|
302.37 |
302.1307 |
+DMTr |
Any nucleotide |
|
366.35 |
366.1021 |
DMTr-C-phosphonate |
Backbone |
|
±313.21 |
±313.0576 |
±dA |
A |
|
±329.21 |
±329.0525 |
±dG |
G |
|
±289.18 |
±289.0464 |
±dC |
C |
|
±303.21 |
±303.0620 |
±dMeC |
MeC |
|
±304.19 |
±304.0460 |
±dT |
T |
|
±329.21 |
±329.0525 |
±rA |
A |
|
±345.21 |
±345.0474 |
±rG |
G |
|
±305.18 |
±305.0413 |
±rC |
C |
|
±319.21 |
±319.0569 |
±rMeC |
MeC |
|
±306.17 |
±306.0253 |
±U |
U |
|
±343.24 |
±343.0682 |
±2′OMe-A |
A |
|
±359.23 |
±359.0631 |
±2′OMe-G |
G |
|
±319.21 |
±319.0569 |
±2′OMe-C |
C |
|
±333.24 |
±333.0726 |
±2′OMe-MeC |
MeC |
|
±320.19 |
±320.0410 |
±2′OMe-U |
U |
|
±331.20 |
±331.0482 |
±2′F-A |
A |
|
±347.20 |
±347.0431 |
±2′F-G |
G |
|
±307.17 |
±307.0369 |
±2′F-C |
C |
|
±321.20 |
±321.0526 |
±2′F-MeC |
MeC |
|
±308.16 |
±308.0210 |
±2′F-U |
U |
|
±341.22 |
±341.0525 |
±LNA-A |
A |
|
±357.22 |
±357.0474 |
±LNA-G |
G |
|
±317.19 |
±317.0413 |
±LNA-C |
C |
|
±331.22 |
±331.0569 |
±LNA-MeC |
MeC |
|
±318.18 |
±318.0253 |
±LNA-U |
U |
|
±387.29 |
±387.0944 |
±2′MOE-A |
A |
|
±403.29 |
±403.0893 |
±2′MOE-G |
G |
|
±363.26 |
±363.0832 |
±2′MOE-C |
C |
|
±377.29 |
±377.0988 |
±2′MOE-MeC |
MeC |
|
±364.25 |
±364.0672 |
±2′MOE-U |
U |
|
442.27 |
442.0419 |
UnyLinker dimer |
5′ or 3′ terminal |
|
460.29 |
460.0525 |
UnyLinker dimer |
5′ or 3′ terminal |
|
478.3 |
478.063 |
UnyLinker dimer |
5′ or 3′ terminal |

来源:骡马尼亚


