您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-01 18:04
摘要:文章分析了目前美国的孤儿药认证和获批情况。从1983年1月4日到2023年6月30日,FDA共授予了4 868个通用名药物6 749个孤儿药认证,其中700个药物已获得FDA批准上市。这些获批的孤儿药来自328家企业,其中大型跨国药企在孤儿药开发中发挥着重要作用。在获批孤儿药的适应证中,仅269种被Orphanet数据库收录,覆盖率不足5%。获批孤儿药的种类较多,以化学药为主,其中寡核苷酸等多种新型孤儿药也获批上市;另外,在生物药中,细胞和基因治疗是近年来出现的新类别。总体而言,美国孤儿药政策促进了药物的研发,我国在制定相关政策时可借鉴美国的研发管理经验,要从罕见病患者角度出发,确保药物研发满足真正的临床需求。
罕见病(rare disease)是发病率极低的一类疾病统称。目前还没有统一的界定罕见病的标准,一些国家和地区以发病率或患病人数作为界定标准[1]。20世纪70年代,大约只有10种可以治疗罕见病的药物[2],在美国这类药物被称为孤儿药(orphan drug,在我国被称为罕见病药物)。1983年美国颁布了《孤儿药法案》,首次明确了孤儿药的定义和相关的激励政策;而在此之前,几乎没有制药企业愿意投身于孤儿药的研发[2]。因此,美国是最早对孤儿药研发和创新提供政策保障的国家[3]。
近年来我国陆续出台了多项促进罕见病药物研发和注册的相关政策[4]。本研究通过分析美国FDA历年批准的孤儿药,进一步为激励和促进我国罕见病药物的研发提供参考。
1、 美国孤儿药的认证
美国联邦法规第21章中规定,对于用来预防、诊断或治疗患病人数少于20万的疾病的药物,可授予孤儿药认证。申请人可在药物研发的任何阶段申请孤儿药认证,也可对已获批上市、但未批准罕见病适应证的药物申请孤儿药认证。2017年,FDA颁布了《FDA孤儿药现代化计划》,提出了孤儿药认定申请需在90天内完成审查的要求[5]。FDA下设孤儿药产品发展办公室(Office of Orphan Products Development,OOPD),负责促进新型罕见病治疗手段的研发,并对孤儿药的认证申请进行审批[6]。
获得孤儿药认证的药物可以获得一系列的优惠政策,包括7年的市场独占期、临床开发费用退税、免除上市申请费和获得临床试验资助等。另外,开发儿童孤儿药的企业,可能获得优先审评券,审评周期从10个月缩短为6个月[7]。对于孤儿药的审评,FDA虽然未设定专门的通道,但FDA已设定的4种加速通道(优先审评、突破性治疗、加速审评和快速通道)均可适用[7]。
2、 美国孤儿药研发和获批情况
本研究以FDA孤儿药数据查询网站(https://www.accessdata.fda.gov/scripts/opdlisting/oopd/)为数据来源,收集自1983年1月4日《孤儿药法案》颁布至2023年6月30日期间获得孤儿药认证和批准上市的所有数据,并进行分析。在此期间,FDA共授予了6 749个孤儿药认证(4 868个通用名),覆盖了583种适应证。其中,来自328家企业的700个孤儿药,已获得FDA批准上市,覆盖了442种罕见病适应证。上市孤儿药的全球销售额数据均来自于Cortellis数据库(https://access.cortellis.cn/login?app=cortellis)。
2.1 获批孤儿药数量
1983年1月4日至2023年6月30日,每年获批的孤儿药数量呈上升趋势(图1)。其中,2020年有48个,是历年最多,未受到新型冠状病毒感染疫情影响。(注:不同企业的同一通用名药物计为不同药物,相同企业的同一通用名药物计为同一药物,获批药物的年份按同一药物的首次孤儿药适应证批准时间计算。)
2020年,FDA药品评价与研究中心(Center for Drug Evaluation and Research,CDER)的新药办公室改组,成立罕见病中心,并设立了罕见病和医学遗传学部,从而整合各罕见病药物的审评专家资源、促进罕见病相关政策的制定和规划。因此,2020年的孤儿药申请数量(753项)达到历史新高,且所有申请均在90天内完成了审查[8]。2022年,FDA批准的37个创新药物中,54%是孤儿药,其中12个是首创新药[9]。
2.2 获批孤儿药的企业情况
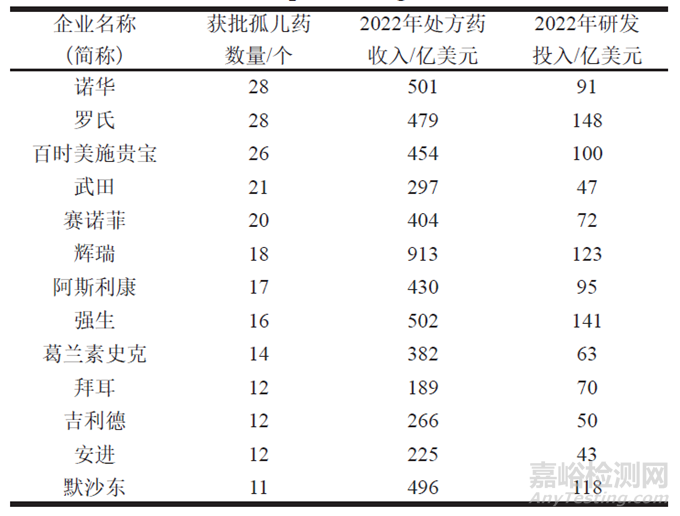
据美国《制药经理人》杂志2023年公布的全球制药企业处方药销售排名榜,前20名大型跨国药企(muti-national company,MNC)中[10],有13家企业获批的孤儿药数量超过10个(表1)。这些企业2022年的处方药销售总额超过200亿美元,公司研发费用超过40亿美元。
MNC之外的其他企业,获批孤儿药相对分散,比如247家企业都只有1个孤儿药获批。根据Evaluate Pharma数据库预测,2026年全球销售额前10的孤儿药有9个将来自于MNC[11]。
2.3 获批孤儿药的开发路径分析
企业在孤儿药适应证的开发策略上,主要采取3种路径[12]。(1)开发策略1类,最初以罕见病适应证开发,先获得孤儿药认证,非罕见病适应证晚于罕见病适应证获批。(2)开发策略2类,获批的适应证全部为罕见病。(3)开发策略3类,最初开发并获批的适应证为非罕见病,之后申请孤儿药认证,并获批罕见病适应证。

图1 批准孤儿药的年度数量(自1983-01-04至2023-06-30)
Fig.1 Annual Numbers of Approved Orphan Drugs(from 1983-01-04 to 2023-06-30)
表1 获批孤儿药数量超过10个的企业名单
Tab.1 List of Companies with over than 10 Approved Orphan Drugs
在700个获批孤儿药中,开发策略2类的药物最多,有587个,占83.9%。以非罕见病适应证拓展的第3类药物最少,仅33个,但其中有3个被列入了2022年畅销药物前10名,年销售额均超过了90亿美元。例如,修美乐(阿达木单抗)是2022年孤儿药中销售额最高的药物,它最初获批的适应证是类风湿关节炎,之后拓展了多种罕见病适应证和非罕见病适应证。据统计[13],阿达木单抗销售额中仅2%来自于孤儿药适应证。开发策略1类产品中值得一提的是程序性死亡受体(PD-1)药物帕博利珠单抗,2022年销售额超过200亿美元,2014至2023年共获批了17个罕见病适应证。
2.4 获批孤儿药的适应证情况
在获批孤儿药覆盖的442种适应证中,大多数(262种)适应证只有1个获批药物,164种适应证有2~9个获批药物,仅17种适应证有11个以上获批药物。在442种适应证中,仅269种被Orphanet数据库收录,对比已收录的超过6 000种罕见病,覆盖率还不到5%。
FDA规定除某种特定罕见病之外,如果申办者能够证明药物仅治疗非罕见疾病的部分人群(即“孤儿药亚组”),即使该非罕见疾病的患病人数大于20万,该药物仍有可能获得孤儿药资格。非罕见疾病的“孤儿药亚组”是由药物的某些特性决定的,如其作用机制、毒性特征或先前治疗方案等,致使药物只能在亚组中使用,而“孤儿药亚组”之外的其他非罕见疾病患者是不适用的。
2000年5月,首个基于“孤儿药亚组”的肿瘤靶向药物吉妥珠单抗获批,这也是首个获批的抗体偶联药物,被用于治疗CD33阳性的急性髓系白血病[14]。截至2023年,共47个药物通过“孤儿药亚组”途径被认定为孤儿药并获批。随着精准治疗日益受到关注,许多疾病亚型或者疾病细分领域的药物被认定为孤儿药,这意味着非罕见病疾病的一部分可被认定为罕见病。一些抗肿瘤药物,通过针对特定基因突变或基因高表达的人群,将孤儿药适应证缩小在一些常见肿瘤的亚组人群,并实现了商业上的成功。例如,2014年获得孤儿药认证、治疗表皮生长因子受体(EGFR)T790M突变的非小细胞肺癌的小分子靶向药物奥希替尼,于2015年获批,上市仅7年,其2022年全球的年销售额超过54亿美元,成为全球销售前20名的药品之一。又如1999年获批治疗人表皮生长因子受体2(HER-2)阳性乳腺癌适应证的曲妥珠单抗,于2009年获得HER-2阳性胃癌的孤儿药认证,并获批上市,在2018年的峰值销售额超过74亿美元。
2.5 获批孤儿药的产品类型分析
获批的孤儿药涵盖多种分子类型(表2),其中化学药有463个,生物药有237个。化学药中包括传统的小分子药物(451个)和寡核苷酸类药物(12个)。寡核苷酸类药物由短链核苷酸组成,可以通过精准抑制某些基因而阻止错误蛋白质的表达,达到治疗疾病的作用[15]。获批的寡核苷酸孤儿药有反义寡核苷酸(ASO)和小干扰RNA(si RNA)。
获批孤儿药中的生物药涵盖了多种分子类别,如表2所示。其中,细胞和基因治疗是近年来获批的新型孤儿药类别。自2017年以来,FDA共批准11个细胞治疗孤儿药,其中大部分都是治疗血液肿瘤的嵌合抗原受体T细胞免疫治疗(CAR-T疗法),可有效延长多发性骨髓瘤、急性淋巴细胞白血病等多种疾病患者的生存期[16]。基因治疗是利用载体将遗传物质引入靶细胞,通过修复缺陷基因达到治疗和预防的目的,分为传统基因治疗和基因编辑疗法两大类[17]。FDA共批准了8个治疗罕见病的基因治疗药物,覆盖了地中海贫血症、血友病、遗传性视网膜营养不良等[18]。
表2 获批孤儿药的产品类别
Tab.2 Classifications of the Approved Orphan Drugs

3、 讨论
Evaluate Pharma数据库预测,2028年全球罕见病市场规模将达到3 000亿美元,占全球处方药市场规模的20%[11],大部分销售额将来自于“重磅炸弹”的抗肿瘤药孤儿药。因此,在评审孤儿药时更应综合考虑患者未满足的临床需求,引导企业去开发无药物治疗的罕见病领域。在考虑孤儿药的激励措施时,保证孤儿药价格只运用于对应的适应证,不拓展到其他普通疾病;且在取得商业成功后,享受的相关福利应以一定形式返还,让罕见病患者真正获益。
获批的700种孤儿药仅覆盖了442种罕见病适应证,其中还包含了很多非罕见病的亚组疾病,真正意义上的罕见病覆盖更少,表明罕见病仍是全球共同的重要公共卫生议题。WELLMAN-LABADIE等[19]对FDA的孤儿药认定标准提出了质疑,建议应审慎考虑抗肿瘤药的孤儿药资格认定。
凭借强大的资金实力,MNC逐渐成为孤儿药开发的主力军。2017年1月,强生以300亿美元收购瑞士罕见病药物研发企业爱可泰隆(Actelion),覆盖了肺动脉高压等罕见病领域[20];2018年5月,武田宣布以620亿美元收购英国罕见病药物研发企业夏尔(Shire),并剥离部分处方药业务,更专注包括罕见病在内的核心领域[21];2020年12月阿斯利康以390亿美元收购亚力兄(Alexion)制药,进军罕见病领域[22];2022年12月,安进以283亿美元收购了Horizon Therapeutics[23]。由此可见,罕见病已成为多家MNC的核心战略领域之一,未来将成为拉动业绩的新增长点。
4、 小结
在我国,将罕见病作为医学新领域,仅有10多年的历史[24]。近年来,鼓励罕见病药物研发和注册的相关政策相继发布,如临床急需药物清单、优先审评审批、接受药品境外临床试验数据等法规和指导原则,都有益于鼓励企业自主研发罕见病药物,推动了我国罕见病创新药的发展,缩短了境外罕见病新药在国内上市的时间,提高了罕见病患者的药物可及性[4]。
在政策的推动下,我国的罕见病药物研发受到了更多的关注。在药物临床试验登记与公示平台(http://www.chinadrugtrials.org.cn)的检索结果表明,2012至2022年登记的261个罕见病治疗药物的临床试验中,有超过一半的申办方为国内企业,且数量逐年增加[25]。
但是,我国未从国家层面颁布罕见病相关法律,统一罕见病的定义和流行病学标准,并明确对企业的激励政策。通过总结前述美国孤儿药的研发管理经验,建议在制定中国孤儿药研发激励政策时更加注重从罕见病患者的角度出发,引导企业在有临床需求的罕见疾病领域展开研发,确保患者真正获益。
参考文献
[1] TAMBUYZER E, VANDENDRIESSCHE B, AUSTIN C P,et al.Therapies for rare diseases: therapeutic modalities,progress and challenges ahead [J].Nat Rev Drug Discov,2020, 19(2): 93-111.
[2] RHEE T G.Policymaking for orphan drugs and its challenges [J].AMA J Ethics, 2020, 17(8): 776-779.
[3] 黄方如, 邵文斌.中国罕见病药物可及性报告2019 [EB/OL].(2019-02-28)[2023-07-29].https://www.iqvia.com/zh-cn/locations/china/library/brochures/viewpointissue-42.
[4] YANG Y, KANG Q, HU J, et al.Accessibility of drugs for rare diseases in China: policies and current situation [J].Intractable Rare Dis Res, 2019, 8(2): 80-88.
[5] 王 雪, 刘丽华, 张 绮, 等.浅析美国罕见病治疗药物激励政策发展及对我国的启示[J].中国临床药理学杂志,2020, 36(12): 1768-1772.
[6] Food & Drug Administration.FDA’s office of orphanproducts development(OOPD)-an overview and update [EB/OL].(2022-03-01)[2023-08-23].https://www.fda.gov/about-fda/fda-pharmacy-student-experientialprogram/fdas-office-orphan-products-development-oopdoverview-and-update.
[7] 杜 涛, 龚兆龙, 高 翼.美国孤儿药开发的政策、策略与实践[J].药学进展, 2015, 39(8): 566-570.
[8] Food & Drug Administration.Rare disease day 2021: FDA shows sustained support of rare disease product development during the public health emergency [EB/OL].(2021-03-01)[2023-08-23].https://www.fda.gov/news-events/fda-voices/rare-disease-day-2021-fda-shows-sustainedsupport-rare-disease-product-development-during-public.
[9] Food & Drug Administration.New drug approvals for 2022 [EB/OL].(2023-09-19)[2023-07-29].https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecularentities-and-new-therapeutic-biological-products/novel-drugapprovals-2022.
[10] CHRISTEL M.2023 Pharm exec top 50 companies [EB/OL].(2023-06-11)[2023-07-29].ht tps : / /www.pharmexec.com/view/2023-pharm-exec-top-50-companies.
[11] SENIOR M, HADJIVASILIOU A.Orphan drug report 2022 [EB/OL].(2022-04-27)[2023-07-29].https://www.evaluate.com/thought-leadership/pharma/orphan-drug-2022-report.
[12] 田 苗, 田 红, 解学星, 等.罕见病用药现状分析 [J].现代药物与临床, 2014, 29(7): 701-707.
[13] AHIP.The rise of orphan drugs [EB/OL].(2019-09-10)[2023-07-29].https://www.ahip.org/resources/the-riseof-orphan-drugs.
[14] FU Z, LI S, HAN S, et al.Antibody drug conjugate: the“biological missile” for targeted cancer therapy [J].Signal Transduct Target Ther, 2022, 7(1): 93.[15] ROBERTS T C, LANGER R, WOOD M J A. Advances in oligonucleotide drug delivery [J]. Nat Rev Drug Discov,2020, 19(10): 673-694.
[16] CAPPELL K M.KOCHENDERFER J N.Long-term outcomes following CAR T cell therapy: what we know so far [J].Nat Rev Clin Oncol, 2023, 20(6): 359-371.
[17] 李玉欢, 李 伟.罕见病的基因治疗研究进展[J].罕少疾病杂志, 2023, 30(3): 109-112.
[18] BENNETT J, MAGUIRE A M.Lessons learned from the development of the first FDA-approved gene therapy frug,voretigene neparvovec-rzyl [J].Cold Spring Harb Perspect Med, 2023, 13(5): a041307.
[19] WELLMAN-LABADIE O, ZHOU Y.The US orphan drug act: rare disease research stimulator or commercial opportunity? [J].Health policy, 2010, 95(2/3): 216-228.
[20] Johnson & Johnson.Johnson & Johnson to acquire actelion for $30 billion with spin-out of new R&D company [EB/OL].[2023-08-22].https://www.jnj.com/mediacenter/press-releases/johnson-johnson-to-acquire-actelion.
[21] THE WALL STREET JOURNAL.At Takeda, M&A integration on a global fast track [EB/OL].(2021-12-11)[2023-08-22].https://deloitte.wsj.com/articles/at-takeda-ma-integration-on-a-global-fast-track-01639165761.
[22] AstraZeneca.AstraZeneca to acquire Alexion, accelerating the company’s strategic and financial development [EB/OL].(2020-12-12)[2023-08-22].ht t p s : / /www.astrazeneca.com/media-centre/press-releases/2020/astrazeneca-to-acquire-alexion.html#!.
[23] AMGEN.Rule 2.7 announcement: amgen inc to acquire horizon therapeutics plc [EB/OL].(2022-12-12)[2023-08-22].https://www.amgen.com/newsroom/pressreleases/2022/12/rule-2-7-announcement-amgen-inc-toacquire-horizon-therapeutics-plc.
[24] 人民网.《中国罕见病定义研究报告2021》发布 [EB/OL].(2021-09-13)[2023-08-22].http://health.people.com.cn/n1/2021/0913/c14739-32225468.html.[25] WU X, XU W, YU M.Clinical trials of orphan drugs in China over the decade 2012-2022: opportunities and challenges [J].Pharmacol Res, 2022, 182: 106349.

来源:中国医药工业杂志