您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-04 08:32
随着最近的科学进步,如结合组合化学的高通量筛选;靶蛋白的X射线衍射和计算化学,我们现在对小分子如何与靶结合有了更多的了解。因此,识别具有治疗潜力的“苗头化合物”变得更加容易。
与此同时,使用蛋白质组学、基因组学甚至基因编辑等一系列新方法发现和验证的可药用靶点数量也大幅增加。人们认识到,使用此类发现工具通常会识别出更高比例的亲脂性、高分子量和难溶性分子,这些分子不符合5规则。尽管对行业来说是积极的,但这些变化增加了研发管道中出现物理化学性质较差(低溶解性、高logP、高分子量)的候选药物的数量。
因此,在药物研发过程中,由于口服生物利用度不足,失败的风险更高,这意味着治疗和经济潜力的损失。据报道,大约40%的商业药物属于难溶性药物。将这一趋势扩展到那些仍在开发中的化合物,80%至90%的化合物“不易溶解”。
药物的溶解性,渗透性以及稳定性影响着口服药物吸收和药物体内暴露量,进而导致药物的疗效问题。对于药物制剂开发来说,药物吸收渗透性和稳定性问题,更多的通过化合物改造策略去解决,而水溶性差的化合物对于制剂开发虽然是一个巨大的挑战,但也不是无计可施。
如诸多增溶策略频频上场去解决药物难溶性问题,如涉及改变API的化学形式,如通过
(1)成盐;
(2)共晶;
(3)前药或者配方方法;
(4)助溶剂、潜溶剂和增溶剂;
(5)胶束体系;
(6)颗粒尺寸减小;
(7)包合作用;
(8)固体无定形分散体,其通过诸如热熔挤出(HME)、喷雾干燥分散体(SDD)、共沉淀或脂质制剂。
在探索提高溶解度和口服吸收的各种策略中,创建过饱和制剂配方已被证明是一种有效的方法。在过饱和状态下,当制剂暴露于胃肠液中,药物浓度超过平衡溶解度。原则上,高药物浓度会增加口服吸收。
众所周知,药物多以被动扩散的方式跨越小肠上皮细胞磷脂双分子层,该跨膜方式遵循Fick第一定律,药物跨膜的速率和药物在胃肠道吸收部位的药物浓度密切相关;即使对于药物为外排底物的情况下,饱和的胃肠道药物浓度可以通过饱和外排载体,提高药物吸收量。
然而,由于药物在高浓度过饱和下是一种热力学亚稳态,构成了沉淀的驱动力,药物具有在被吸收之前有可能在体内快速沉淀的趋势,导致生物利用度降低。
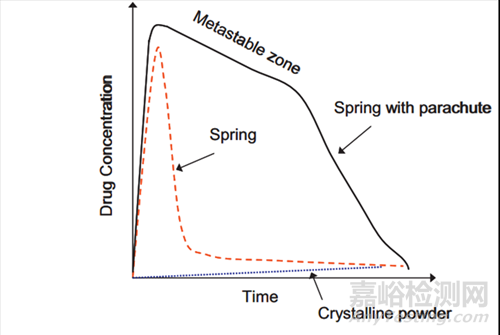
图1.弹簧-降落伞现象示意图
过饱和给药系统在提高药物生物利用度方面的临床效益将在很大程度上取决于诱导过饱和状态的稳定性,取决于药物的沉淀动力学。因此,在设计过饱和制剂时,通过防止药物在吸收前沉淀,将药物在体内保持在过饱和浓度是至关重要的。
对过饱和度、沉淀和可能的沉淀抑制进行适当评估是过饱和给药系统有效开发和优化的关键。沉淀抑制剂已被广泛探索用于将药物维持在过饱和状,它们可以在一段时间内抑制或延迟药物沉淀,从而允许足够的吸收以提高口服生物利用度。
当暴露于胃肠道的水性环境时,过饱和制剂能够诱导过饱和的药物浓度。必须产生并保持过饱和状态,药物才能在所需的时间内被吸收。制剂性能取决于许多因素,包括所使用的加工技术、化合物的物理化学性质以及形成和维持过饱和药物溶液的趋势。过饱和状态的产生和维持的概念通常由“弹簧和降落伞”理论描述(图1)。
1、弹簧(Spring)
药物热力学不稳定的过饱和溶液通常由能量较高的药物形式(“弹簧”)产生。可诱导产生过饱和溶液的制剂通常分为两类:(1)高浓度溶液和(2)由于形态、粒度和/或润湿性的变化而形成的高能和/或快速溶出的固体形式(表1),包括无定形形式、结晶盐形式、共晶、纳米颗粒、潜溶剂系统、固体分散体和脂质制剂。
表1.水溶性较差化合物的超饱和配方
其中,固体分散体制剂已被广泛用于提高水溶性差的药物的口服生物利用度。采用这些方法开发的几种产品已在商业上取得成功。原则上,结晶药物转化为无定形形式,无定形药物分散到一种或多种聚合物的亲水性载体基质中,或完全溶解在聚合物基质中。
此类聚合物的实例包括聚乙烯吡咯烷酮(PVP)、聚乙烯醇(PVA)、聚乙二醇(PEG)、纤维素衍生物和表面活性剂,如Pluronics、TPGS和十二烷基硫酸钠(SDS)。
无定形药物比结晶态药物具有更高的溶解度,从而改善了水溶性差的化合物的口服吸收。亲水性载体在提高药物溶出的润湿性和表面积以及稳定亚稳态方面发挥着重要作用。当制剂暴露于胃肠道时,正确选择聚合物可以在体内产生过饱和药物浓度,并抑制随后的沉淀。具有纳米结构的固体分散体可以通过增加表面积进一步增加药物的表观溶解度。
除了固体分散方法外,脂质制剂通常用于制备过饱和制剂。一般来说,药物完全溶解在各种油中,如甘油三酯和混合甘油酯。一旦这种制剂暴露在水性环境中,就会产生过饱和的药物浓度,并且药物在胃肠道内长时间保持在溶液中。从将药物溶解在可油中的最简单配方,到油、表面活性剂(水溶性或水不溶性)和亲水性溶剂的组合,脂质配方表现出不同的药物沉淀倾向。
2、降落伞(Parachute)
为了从过饱和状态中获益以增加吸收,药物必须长时间保持高浓度。这可以通过使用沉淀抑制剂(“降落伞”)暂时抑制药物沉淀来实现。过饱和度(S=CB/CS*,其中CB是总溶质浓度,CS*是溶剂中溶质的饱和浓度)是沉淀的驱动力——过饱和度越高,沉淀就越快。
已经探索了大量辅料作为沉淀抑制剂,通过干扰成核和/或晶体生长来抑制和/或延缓药物沉淀过程。这些辅料包括纤维素聚合物、表面活性剂和环糊精等。体外方法通常用于筛选此类沉淀抑制剂,沉淀抑制剂的制剂开发可以从早期发现到批准后进行改进。
设计和开发过饱和制剂的关键是确定“弹簧”和“降落伞”的最佳组合。弹簧和降落伞理论的一个代表性例子已经使用的固体口服制剂来改善塞来昔布的口服吸收。结合结晶成盐(弹簧)和沉淀抑制剂(降落伞)提供了增强的溶出特性和更高的口服生物利用度。
狗PK(药代动力学)研究表明,含有TPGS/羟丙基纤维素(HPC)或PluronicF127/HPC的塞来昔布制剂能够在狗体内快速吸收,提供完全(100%)的生物利用度,而商业制剂仅显示40%的生物利用率。
3、总结(Summary)
在药物的各种给药途径中,口服给药是最常用的。它具有成本效益,对患者来说很方便,从而使患者的依从性非常高。各种剂型可用于口服递送,包括固体制剂如胶囊和片剂,以及液体制剂如溶液、混悬剂和糖浆。活性药物成分(API)要发挥其药理作用,必须从制剂中释放出来,并从胃肠道(GI)吸收到系统循环中,在系统循环中输送到其生理目标。
药物生物利用度取决于其在胃肠道环境中溶解并穿过肠膜的能力。正是从这两个参数(溶解性和渗透性)中产生了生物药剂学分类系统。药物溶解性对于口服制剂生物利用度的限制因素逐渐成为制剂开发的热点和难点。
增溶策略如弹簧般,通过药物快速溶出或提高表观溶解度的方式,使药物在胃肠道吸收部位以过饱和药物溶液的形式存在,但是如何维持药物过饱和时间,提高药物在吸收窗的持续时间将是增溶制剂发挥作用的关键环节。通过添加沉淀抑制剂,药物饱和浓度如降落伞般慢慢降低。弹簧-降落伞的联合之下,药物吸收获得提高,进而破除难溶性药物的吸收禁锢。
编者按:
面对新发现的可药用靶点所带来的物理化学性质挑战,我们需要不断创新和完善药物制剂开发策略。通过合理运用过饱和制剂配方、增溶策略以及其他先进的制剂技术,我们有望突破难溶性药物的吸收壁垒,创造出更加安全、高效的治疗选择。
参考文献
1.Price DJ, Ditzinger F, Koehl NJ, Jankovic S, Tsakiridou G, Nair A, Holm R, Kuentz M, Dressman JB, Saal C. Approaches to increase mechanistic understanding and aid in the selection of precipitation inhibitors for supersaturating formulations - a PEARRL review. J Pharm Pharmacol. 2019 Apr;71(4):483-509. doi: 10.1111/jphp.12927. Epub 2018 May 16. PMID: 29770440.
2.Xu, Sen and Wei-guo Dai. “Drug precipitation inhibitors in supersaturable formulations.” International journal of pharmaceutics 453 1 (2013): 36-43 .

来源:药渡


