您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-04 20:41
摘 要: 建立顶空进样-气相色谱测定维生素D滴剂中甲醇、乙醇、异丙醇、正丁醇、二氯甲烷、丙酮、乙酸乙酯、丁酮、苯、甲苯、2-乙烯苯、正己烷12种溶剂残留量的分析方法。采用CD-624毛细管色谱柱分离,平衡温度为80 ℃,平衡时间为30 min,分流比为3∶1,用氢火焰离子化检测器检测,以色谱峰面积内标法定量。12种残留溶剂在0~10 mg/kg范围内,线性相关系数均大于0.999,方法检出限为0.3~0.5 mg/kg,定量限为0.6~1.0 mg/kg。样品加标回收率为83.57%~97.80%,测定结果的相对标准偏差均小于10%(n=6)。该方法简单、快速,可满足维生素D滴剂中溶剂残留量的检测。
关键词: 顶空-气相色谱法; 维生素D滴剂; 溶剂残留
维生素D对钙、磷代谢及小儿骨骼生长有重要影响。维生素D缺乏时,儿童可患佝偻病,骨骼出现畸形、骨质松软、多汗以及婴儿手足抽搐等症状,成人可患骨软化病[1]。维生素D滴剂在预防和治疗维生素D缺乏症,如佝偻病等方面发挥着重要作用,已成为在小儿营养补充方面的常备药品[2]。
药品的包装材料通常采用高分子材料和金属薄膜等,这些材料在生产过程中容易残留一些溶剂,另外药品包装材料在印刷过程中也会由油墨引入一些溶剂,同时在药品制剂生产过程中添加的各种药用辅料也可能引入溶剂,这些沸点较低的溶剂通常易挥发,有可能直接向药物中迁移,对人体健康造成损害。为保证药品质量,作为药品生产的最后一环,必须对成品药中残留溶剂进行监控[3‒4]。
维生素D滴剂的主要辅料之一为植物油,植物油在生产过程中可能会带入有害的溶剂残留成分,同时维生素D滴剂的外包装材料一般为胶囊壳,内容物大部分为脂溶性成分,因此,胶囊壳中有害溶剂残留也易迁移至维生素D滴剂中。维生素D滴剂中的溶剂残留对人体健康存在潜在的危害,如致癌性、神经毒性或致畸性等,而维生素D滴剂的主要消费人群为婴幼儿或儿童,因此,维生素D滴剂中溶剂残留污染问题需引起广泛关注。
目前,对于食品[5‒7]、化妆品[8‒12]或原料药[13‒16]等产品中溶剂残留量的检测报道较多,但针对维生素D滴剂中溶剂残留检测方法尚未见报道。笔者建立了顶空进样-气相色谱同时测定维生素D滴剂中甲醇、乙醇、异丙醇、正丁醇、二氯甲烷、丙酮、乙酸乙酯、丁酮、苯、甲苯、2-乙烯苯、正己烷12种溶剂残留量的分析方法,该方法具有快速、灵敏、重现性好等特点,能够满足维生素D滴剂中溶剂残留量定性定量分析要求,可为保障维生素D滴剂的质量安全提供技术保障。
1、 实验部分
1.1 主要仪器与试剂
气相色谱仪:7890B型,配火焰离子化检测器(FID),美国安捷伦科技有限公司。
顶空自动进样器:7697A型,美国安捷伦科技有限公司。
纯水/超纯水一体化系统:Milli-Q Direct-Q8型,美国密理博公司。
电子分析天平:BSA224S型,感量为0.1 mg,德国赛多利斯公司。
丙酮、正己烷、乙酸乙酯、异丙醇、乙醇、丁酮、甲醇、三氯甲烷、正丁醇、N-甲基吡咯烷酮:均为色谱纯,上海安谱实验科技股份有限公司。
苯、甲苯、2-乙烯苯:均为色谱纯,中国医药集团有限公司。
3-甲基-2-戊酮标准品:100 mg,标准物质编号为715884,坛墨质检科技股份有限公司。
维生素D滴剂样品:市售。
实验用水为超纯水。
1.2 溶液配制
3-甲基-2-戊酮内标溶液:100 μg/mL,准确称取3-甲基-2-戊酮标准品10 mg于100 mL容量瓶中,以N-甲基吡咯烷酮溶解并定容至标线。
12种溶剂系列混合标准工作溶液:准确称取甲醇、乙醇、异丙醇、正丁醇、二氯甲烷、丙酮、乙酸乙酯、丁酮、苯、甲苯、2-乙烯苯、正己烷各10 mg于100 mL容量瓶中,以N-甲基吡咯烷酮溶解并定容至标线,得到各组分质量浓度均为100 μg/mL的混合标准储备溶液。用微量注射器分别迅速加入0、10、20、40、50、100、200 μL混合储备标准液于7只10 mL顶空瓶中,分别加入2.0 g空白维生素D滴剂和20 μL 3-甲基-2-戊酮内标溶液,涡旋混匀,溶解后密封,得到各组分质量分数均分别为0、0.5、1.0、2.0、2.5、5.0、10 mg/kg的系列混合标准工作溶液。
1.3 仪器工作条件
1.3.1 顶空进样瓶
平衡温度:80 ℃;定量环温度:100 ℃;传输温度:110 ℃;循环时间:28 min;平衡时间:30 min;进样时间:1.00 min;进样体积:500 μL;样品瓶气压:100 kPa。
1.3.2 气相色谱仪
色谱柱:CD-624毛细管柱(30 m×0.25 mm,0.25 μm,上海安谱实验科技股份有限公司);进样口温度:250 ℃;分流比:3∶1;升温程序:初始炉温为50 ℃,保持1 min,以5 ℃/min升温至200 ℃,再以10 ℃/min升温至250 ℃,保持4 min;检测器:火焰离子化检测器(FID); FID温度:280 ℃。
1.4 实验方法
将维生素D滴剂样品混合均匀,准确称取2.0 g于10 mL顶空瓶中,加入3-甲基-2-戊酮内标溶液20 μL,立即密封,采用顶空-气相色谱法测定,以色谱峰面积内标法定量。
2、 结果与讨论
2.1 色谱柱选择
分别选用HP-5柱(30 m×0.25 mm,0.25 μm)、CD-624柱(30 m×0.25 mm,0.25 μm)、HP-1701柱(30 m×0.25 mm,0.25 μm) 3种常见色谱柱进行试验。结果表明,CD-624柱能较好地分离12种待测溶剂;HP-5柱对甲醇、乙醇、异戊醇、正丁醇等极性化合物的分离效果较差;HP-1701柱对乙酸乙酯和丁酮的分离效果不佳。同时,柱箱升温程序对各组分分离度也存在一定影响。经过多次试验发现,依据1.3.2色谱条件,12种溶剂均能获得良好的分离效果,12种溶剂混合标准溶液色谱图如图1所示。
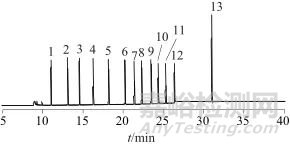
图1 12种溶剂混合标准溶液色谱图
Fig. 1 Chromatograms of mixed standard solution of 12 solvents
1—甲醇; 2—乙醇; 3—异丙醇; 4—正丁醇; 5—二氯甲烷;6—丙酮; 7—乙酸乙酯; 8—丁酮; 9—苯; 10—甲苯;11—2-乙烯苯; 12—正己烷; 13—3-甲基-2-戊酮
2.2 分流比选择
从理论上来说,分流比越小,灵敏度就越高,但乙酸乙酯与丁酮色谱保留时间接近,容易相互干扰,从而影响分离效果。通过试验发现选择3∶1的分流比,一方面可以减少两者进入色谱柱产生的干扰,另一方面保证了检测的灵敏度。
2.3 平衡温度选择
采用2.0 g空白维生素D滴剂内容物作为基质,加入一定量的12种溶剂混合标准溶液,混匀,分别设定平衡温度为40、50、60、70、80、90、100 ℃,考察12种溶剂的色谱峰面积,结果如图2所示。由图2可以看出,随着平衡温度的升高,12种溶剂的色谱峰面积均有所增加。根据拉乌尔定律,随着平衡温度的升高,组分的饱和蒸汽压也逐渐变大。当平衡温度达到80 ℃时,12种溶剂的色谱峰面积均基本趋于平稳,同时考虑到温度过高可能会导致样品中其他杂质成分气化或升华进入色谱系统,从而干扰目标物的测定,综合考虑,选择平衡温度为80 ℃。
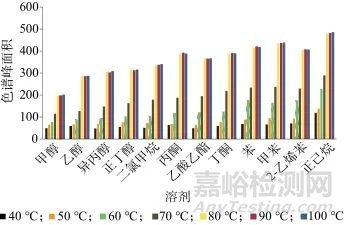
图2 不同平衡温度时12种溶剂的色谱峰面积
Fig. 2 Chromatographic peak areas of 12 solvents at different equilibrium temperatures
2.4 平衡时间选择
采用2.0 g空白维生素D滴剂内容物为基质,加入一定量的12种溶剂混合标准溶液,混匀,在平衡温度为80 ℃条件下,分别设定平衡时间为10、20、30、40、50 min,考察12种溶剂的色谱峰面积,结果如图3所示。由图3可以看出,随着平衡时间延长,12种溶剂的色谱峰面积均有所增加,当平衡时间为30 min时达到动态平衡状态,继续延长平衡时间,12种溶剂的色谱峰面积均无明显增加。同时,平衡时间过长可能导致杂质峰增加,综合考虑,选择平衡时间为30 min。
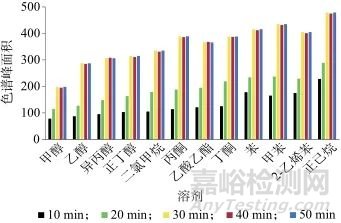
图3 不同平衡时间时12种溶剂的色谱峰面积
Fig. 3 Chromatographic peak areas of 12 solvents at different equilibrium times
2.5 线性方程与检出限
取12种溶剂系列混合标准工作溶液,分别置于10 mL顶空瓶中,按照1.4实验方法分析,分别以12种溶剂质量分数与内标质量分数比为横坐标x,以12种溶剂色谱峰面积与内标色谱峰面积比为纵坐标y,绘制标准曲线。以3倍信噪比(S/N=3)计算检出限,以10倍信噪比(S/N =10)计算定量限,结果见表1。由表1可知,在0~10 mg/kg范围内,12种溶剂线性相关系数均大于0.999,方法检出限为0.3~0.5 mg/kg,定量限为0.6~1.0 mg/kg。
表1 12种溶剂质量分数线性范围、线性方程、相关系数及检出限
Tab. 1 Linear range of mass fraction,linear equation,correlation coefficient and detection limit of 12 solvents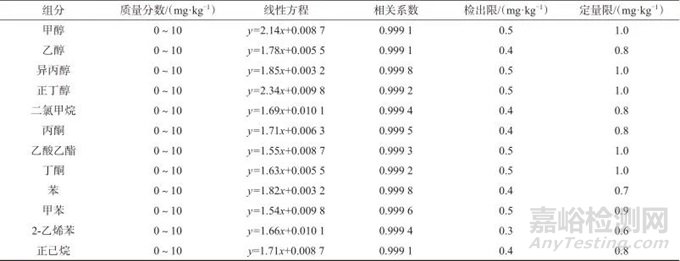
2.6 加标回收与精密度试验
取未检出12种溶剂残留的空白维生素D滴剂样品,加入20 μL 3-甲基-2-戊酮内标溶液,再分别按照1.0、2.0、10 mg/kg 3种加标水平,加入12种溶剂混合标准溶液,每个加标水平平行测定6次,计算各种溶剂的回收率及相对标准偏差,以考察方法的精密度及准确度,空白样品、加标样品色谱图如图4所示,试验数据列于表2。结果表明,12种溶剂加标回收率为83.57%~97.80%,测定结果的相对标准偏差均小于10%。
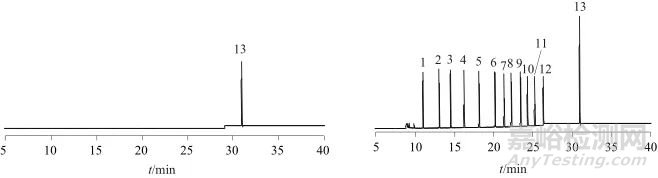
图4 空白样品溶液和加标样品溶液色谱图
Fig. 4 Chromatograms of blank sample solution and spiked sample solution
(a) 空白样品溶液色谱图 (b) 加标样品溶液 ;1—甲醇; 2—乙醇; 3—异丙醇; 4—正丁醇; 5—二氯甲烷; 6—丙酮; 7—乙酸乙酯; 8—丁酮; 9—苯; ;10—甲苯; 11—2-乙烯苯; 12—正己烷; 13—3-甲基-2-戊酮
表2 加标回收与精密度试验结果
Tab. 2 Results of spiked recoveries and precision test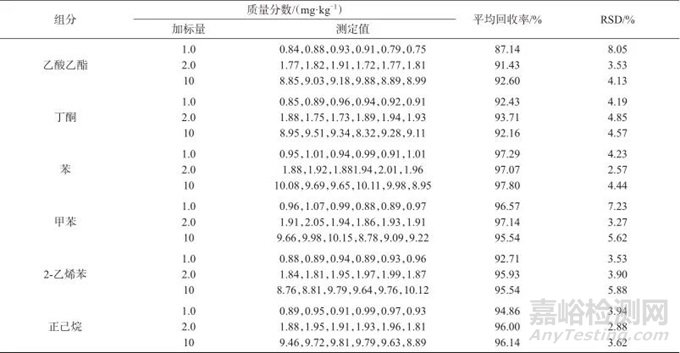
3、 结语
通过考察色谱柱型号、平衡时间、平衡温度以及分流比等参数条件,建立了顶空-气相色谱法同时测定维生素D滴剂中12种溶剂残留。该方法具有简单、快速、重现性好等特点,可用于维生素D滴剂中多种溶剂残留量的快速定量检测,为保障维生素D滴剂的质量安全提供技术支持。
参考文献
1 刘凤凤,陈防群,梁颖.维生素D、血钙、硒水平对学龄儿童生长发育的影响及可能机制分析[J].中国妇幼保健,2023,38(14): 2 632.
LIU Fengfeng,CHEN Fangqun,LIANG Ying. Effects and possible mechanisms of vitamin D,blood calcium,and selenium levels on the growth and development of school-age children[J]. China Maternal and Child Health,2023,38(14): 2 632.
2 王星星,程卫光.布拉氏酵母菌联合维生素D治疗对佝偻病儿童临床疗效、生长发育及骨代谢指标的影响[J].临床研究,2023,31(7): 47.
WANG Xingxing,CHENG Weiguang. Clinical efficacy,growth and development,and bone metabolism indicators of children with rickets treated with the combination of Bladder's yeast and vitamin D[J]. Clinical Research,2023,31(7): 47.
3 王宏亮.药物中苯残留原因及控制策略浅析[J].药学与临床研究,2022,30(5): 447.
WANG Hongliang. Analysis of causes and control strategies for benzene residues in drugs[J]. Pharmaceutical and Clinical Research,2022,30(5): 447.
4 牛思青. LF1原料药有关物质和有机溶剂残留量检查以及稳定性研究[D].太原:山西医科大学,2020.
NIU Siqing . LF1 active pharmaceutical ingredient related substance and organic solvent residue detection and stability study[D]. Taiyuan:Shanxi Medical University,2020.
5 潘亮,冯强,曾文祥,等.顶空-气相色谱质谱法检测出口姜黄色素中四种溶剂残留[J].中国口岸科学技术,2021,3(10): 99.
PAN Liang,FENG Qiang,ZENG Wenxiang,et al. Detection of four solvent residues in exported turmeric pigment by headspace gas chromatography-mass spectrometry[J]. China Port Science and Technology,2021,3(10): 99.
6 徐飞燕,雷超.食品及食品包装材料溶剂残留的研究[J].食品安全导刊,2021(21): 148.
XU Feiyan,LEI Chao. Research on solvent residues in food and food packaging materials [J]. Introduction to Food Safety,2021(21): 148.
7 李德国,刘杨,闫爱华,等.气相色谱法测定植物油中溶剂残留量[J].粮食科技与经济,2020,45(10): 100.
LI Deguo,LIU Yang,YAN Aihua,et al. Determination of solvent residues in vegetable oils by gas chromatography[J]. Journal of Grain Science and Economics,2020,45(10): 100.
8 蒋凯,薛晓康,李晓宇.化妆品中36种挥发性有机溶剂残留的测定[J].应用化工,2019,48(3): 728.
JIANG Kai,XUE Xiaokang,LI Xiaoyu. Determination of 36 volatile organic solvent residues in cosmetics[J]. Applied Chemistry,2019,48(3): 728.
9 高家敏,曹进.化妆品和药品残留溶剂测定方法差异的探讨[J].中国药师,2017,20(9): 1 643.
GAO Jiamin,CAO Jin. Exploration of differences in determination methods for residual solvents in cosmetics and drugs[J]. Chinese Pharmacist,2017,20(9): 1 643.
10 周相娟,聂鲲,钟丽君,等.顶空-气相色谱-质谱法测定化妆品中14种有机溶剂残留[J].中国卫生检验杂志,2014,24(6): 773.
ZHOU Xiangjuan,NIE Kun,ZHONG Lijun,et al. Determination of 14 organic solvent residues in cosmetics by headspace gas chromatography-mass spectrometry[J]. Chinese Journal of Health Inspection,2014,24(6): 773.
11 黄荣,叶峻,傅小红.化妆品及其原料中有毒残留物检测方法研究进展[J].日用化学工业,2014,44(1): 39.
HUANG Rong,YE Jun,FU Xiaohong. Research progress on detection methods for toxic residues in cosmetics and their raw materials[J]. Daily Chemical Industry,2014,44(1): 39.
12 蒋凯,薛晓康,李晓宇.化妆品中36种挥发性有机溶剂残留的测定[J].应用化工,2019,48(3): 728.
JIANG Kai,XUE Xiaokang,LI Xiaoyu. Determination of 36 volatile organic solvent residues in cosmetics[J]. Applied Chemistry,2019,48(3): 728.
13 邵昉,耿文飞,李晓露,等.顶空气相色谱法测定非达霉素原料药中残留溶剂[J].化学与生物工程,2019,36(8): 65.
SHAO Fang,GENG Wenfei,LI Xiaolu,et al. Determination of residual solvents in non damycin raw materials by headspace gas chromatography[J]. Chemical and Bioengineering,2019,36(8): 65.
14 张琳,任文杰,刘葵葵,等.气相色谱法测定甲氧苄啶原料药中的6种残留溶剂[J].食品与药品,2023,25(3): 225.
ZHANG Lin,REN Wenjie,LIU Kuikui,et al. Determination of six residual solvents in trimethoprim raw materials by gas chromatography [J]. Food and Drug,2023,25(3): 225.
15 邵昉,李丽红,李晓露,等.顶空气相色谱法测定替考拉宁纯化中10种树脂残留溶剂[J].化学与生物工程,2019,36(1): 64.
SHAO Fang,LI Lihong,LI Xiaolu,et al. Determination of 10 resin residual solvents in the purification of teicoplanin by headspace gas chromatography[J]. Chemical and Bioengineering,2019,36(1): 64.
16 杨敏,闫翠勤,徐艳梅,等.气相色谱法检测阿普米司特原料药中有机溶剂残留[J].中国药业,2024,33(1): 59.
YANG Min,YAN Cuiqin,XU Yanmei,et al. Detection of residual organic solvents in Apulist API by gas chromatography[J]. China Pharmaceutical,2024,33(1): 59.

来源:化学分析计量


