您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-06 08:09
随着食品工业的蓬勃发展,市厂上的饮品种类逐渐多样化。需要注意的是许多饮品中都含有一定含量的乙醇。特别是生活节奏加快,人们在选择饮品时可能会忽略低含量乙醇饮品与药物同时服用带来的潜在风险。为了减少此类情况对人们身体健康的不良影响,早在2014年,EMA发布的“MR制剂药代动力学和临床评价指南(草案)”中就指出[1]:对于口服仿制缓控释制剂,应进行乙醇溶液中释药行为的体外研究。2019年FDA发布的“新药上市申请(NDA)或新药临床试验申请(IND)生物利用度研究一般考虑”[2]中也提出,含乙醇饮料会影响缓控释制剂中活性物质的释放,导致药物加速释放和系统暴露量的变化,建议在开发口服固体缓控释制剂时采用体外试验来研究体内乙醇剂量倾泻(ADD)的可能性。我国国家食品药品监督管理局也发布了相应的药品研究的指导原则——《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则》[3]。
为了仔细透彻的了解次指导原则的内容,我们必须首先来了解几个概念:
(1)口服调释制剂(Oral modified-release formulations):与普通口服制剂相比,通过技术手段调节药物的释放速率、释放部位或释放时间的一大类制剂。主要包括微孔膜包衣缓释制剂、肠溶包衣缓释制剂、缓释胶囊和小丸脉冲释药系统等。
(2)乙醇剂量倾泻(Alcohol-induced dose-dumpling, ADD):含乙醇饮料与药物同服引发的调释制剂剂量突释现象。
(3)体内生物等效性:在同样试验条件下试验制剂和对照标准制剂在药物的吸收程度和速度的统计学差异。当吸收速度的差别没有临床意义时,某些药物制剂其吸收程度相同而速度不同也可以认为生物等效。
那么我们接下来探究一下乙醇对药物释放的影响。众所周知,含乙醇饮料可能导致药物加速释放和系统暴露量变化,引起药物的安全性和有效性风险。所以,采用体外试验来研究乙醇在体内导致药物剂量倾泻的可能是非常有必要的。那么,如何设计合适的体外试验来评估乙醇对于药物的突施的风险呢?指导原则中给出了基础的研究方法。主要步骤如图所示:
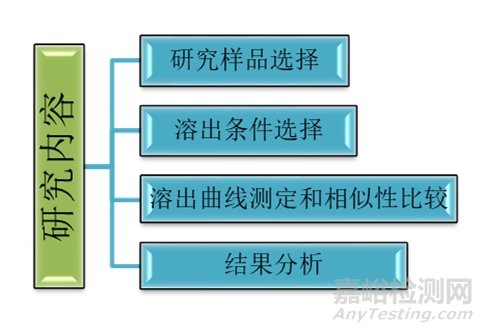
一、研究样品的选择
对于样品的选择,主要对样品的批量、规格和批次提出了要求。如:用于乙醇剂量倾泻溶出试验的样品应采用注册批样品(工艺验证3批,每批10万片),前期的研究阶段的数据也可一并提供;样品规格一般采用与参比制剂相同的规格,如果存在不同规格的参比制剂,应采用与仿制制剂相同规格的参比制剂和样品进行乙醇剂量倾泻的研究,必要时也可进行全规格研究;再就是对于批次的选择,最好仿制制剂和参比制剂均选用多批次试验,研究批次需选用代表性批次,如工艺验证批次或者生物等效性批次。
二、溶出条件选择
对于溶出条件的选择,我们应考虑的问题包括溶出试验装置和搅拌速度、推荐的乙醇浓度、溶出介质选择等,具体要求如下。

对于介质的选择,如果最佳溶出介质为0.1 moL/L的盐酸,我们则需要提供仿制制剂在含有上述浓度乙醇的0.1 moL/L盐酸(pH 1.2)中的溶出曲线。如果最佳溶出介质不是0.1moL/L盐酸,则需要提供仿制制剂在含有上述浓度乙醇的0.1moL/L盐酸和最佳溶出介质中的溶出曲线。如果没有确定最佳溶出介质,则需要提供仿制制剂在含有上述浓度乙醇的3种生理相关pH介质(即pH 1.2、4.5和6.8)中的溶出曲线。如果药物溶出无pH依赖性,则需要提供仿制制剂在含有上述浓度乙醇的0.1 moL/L盐酸中的溶出数据。对于DR(迟释)制剂(肠溶衣)产品,提供仿制药在含有上述浓度乙醇的0.1 moL/L盐酸中的溶出数据即可。
三、溶出曲线测定和相似性比较
1、应使用12个剂量单位(n=12)在多个时间点的溶出度数据,以获得完整的溶出曲线。时间点通常为每15分钟取样1次,通常共计2小时。
2、应比较溶出曲线的形状,特别是前2 h的,以确定是否保持了缓控释制剂的释放特性。
3、应使用相似因子(f 2)评估溶出曲线之间相似性(或缺乏相似性,使用不含乙醇的介质为参照)。若f 2法不适用,可采用其方法并应提供科学依据。将介质中添加乙醇时测得的样品(参比制剂和仿制制剂)的平均溶出量与未添加乙醇时的平均溶出量进行比较,标准偏差参比制剂与仿制制剂相差不应过大。
四、结果分析
我们需提供完整的数据报告,其中应包括在体外评估乙醇诱导的剂量倾泻试验期间收集的完整数据(包括单个数据、平均值、标准偏差、对比图、f 2值等)并对不同浓度乙醇介质中的剂量倾泻情况进行总结。从而评估是否需要进行仿制制剂与含乙醇饮料同服的体内生物相关性研究。
体内ADD是复杂的多因素事件,多种因素均可能产生影响。所以体外试验的结果虽然不一定能够完全真实的反应体内真正的释药行为,但确实可以一定程度上有效的预测该药物在体内发挥作用的路径。但是千人千面,不同的剂型对于ADD试验的反应也不尽相同,因此需结合具体产品情况进行相应研究。
参考文献
[1]EMA.Guideline on the pharmacokinetic and clinical evaluation of modified release dosage forms[EB/OL].(2014-11-20)[2021-07-13].
[2] FDA.Guideline for industry: bioavailability and bioequivalence studies submitted in NDAs or INDs – general considerations[EB/OL].[2021-07-13].
[3] 国家食品药品监督管理局.化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则.2022

来源:药事纵横


