您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-06-06 08:36
欧盟MDR法规要求制造商在整个产品生命周期内证明其医疗器械的安全性、性能和受益,作为临床评价的一部分。这一证据还需要临床数据。因此,制造商必须在整个产品生命周期内收集和评估这些临床数据。这种不断更新临床评价的过程被称为上市后临床跟踪,即PMCF。
【PMCF定义】
MDR附录XIV Part B关于PMCF的定义如下:
“PMCF应被理解为更新MDR附录第61条和附录XIV Part A中提及的临床评价的连续过程,并应在制造商的上市后监督计划中加以解决。”
也就是说,PMCF是临床评价持续更新过程,而PMCF计划应作为PMS计划的一部分。
【PMCF评价对象】
进行PMCF时,制造商应主动收集和评价带有CE标志的器械按其预期用途投放市场或投入使用,在人体内或人体上使用的临床数据。
【PMCF目的】
确认器械预期寿命内的安全性和性能,
识别先前未知的副作用并监测所识别的副作用和禁忌症,
在事实证据的基础上识别和分析突发风险,
确保受益风险比的持续可接受性,以及
识别器械可能的系统性误用或标签外使用,以验证预期用途的正确性。
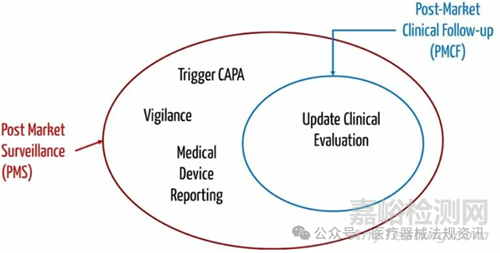
【PMCF和PMS的差异】
PMCF是上市后监督(PMS)的一个子集。
PMS涉及从现场收集所有类型的信息,如服务报告、热线电话、客户投诉等。PMS的目标比PMCF的目标更广泛。
PMCF旨在更新临床评价,而PMS的目标是确定是否需要采取必要措施以确保患者和从业人员安全。该决定考虑了临床评价的结果。因此,PMCF是PMS的一个子集。
【公告机构对PMCF文档审核重点】
PMS计划中是否包括PMCF计划?
PMCF计划是否充分?
PMCF活动是否记录在PMCF报告中?
如不进行PMCF,是否有合理的解释?
是否建立了PMCF相关程序文件?
注1:PMCF计划模板,请参考MDCG 2020-7指南;PMCF报告模板,请参考MDCG 2020-8指南。
注2:证明为什么不需要PMCF活动时,可以从以下两点考虑:
从MDCG 2020-6来描述成熟的技术,
基于风险管理,并考虑器械与人体之间相互作用的具体特征、预期临床性能和器械的声明。
【PMCF活动包括哪些?】
在MDR, Annex XIV, Part B,6.2的 (a)和(b)小项中明确PMCF活动包括两类,即:一般的PMCF方法和程序、特定的PMCF方法与程序。
一般的PMCF方法和程序,包括:收集获得的临床经验、用户的反馈、科学文献和其他来源临床数据的筛选;
特定的PMCF方法与程序,包括合适的登记数据或PMCF研究的评价。
其他PMCF活动:
来自卫生保健专业人员的调查
来自患者/用户的调查
审查可能显示滥用或标签外使用的病例报告
真实世界的证据分析
PMCF活动的要求:
至少,必须进行特定产品的文献搜索,以从同行评审的科学文献中发表的报告中获得所谓的关键数据。
对于根据第61(4)条未进行临床研究的植入类器械和III类器械,PMCF计划应包括上市后研究,以确认器械的安全性和性能。
【PMCF文档更新频率】
我们需要先了解下PMSR、PSUR和CER更新的频率,因为PMCF报告的数据需要根据器械分类相应更新到PMS报告或PSUR报告,和CER中。
PMSR适用于I类器械,PSUR适用于IIa, IIb, 和III类器械。
PMSR是对所有PMS活动(包括PMCF)以及任何纠正和预防措施的结果的总结。PMSR应根据需要进行更新,并应要求提供给主管当局。
PSUR是高风险器械所必需的,是PMSR的一个更稳健的版本。PSUR总结了PMS数据的结果和结论,包括PMCF的主要发现,以及所采取的任何预防和纠正措施的理由和描述。也包括其他结论,如估计的销售额、更新的风险受益决定和用户群体特征。
在CER的更新时应包括PMCF结果的摘要,以及是否需要额外的PMCF或停止PMCF活动的理由。可以根据PMCF数据对器械安全性和性能的阐明以及对受益风险比的持续接受程度,评估CER中应包含哪些PMCF数据以及应包含多少PMCF数据。
PMSR、PSUR和CER更新的频率如下:
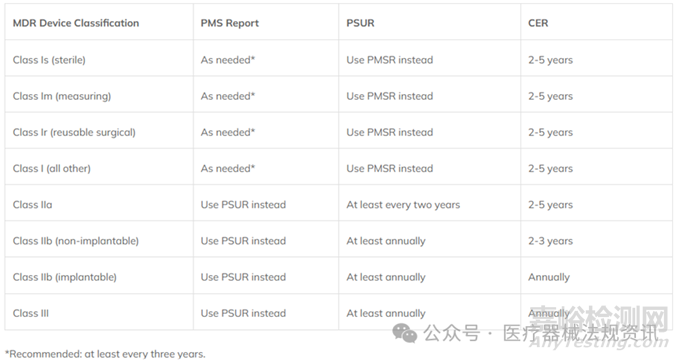
MDR虽然规定了PMSR、PSUR和CER以上更新频率,PMSR、PSUR和CER这三份文件必须包括PMCF过程的关键输出。然而,这并不意味着PMCF报告的更新频率必须与这三份文件的更新频率一致。
有些活动应该更频繁地进行,例如文献综述。此外,PMCF研究或用户调查的中期分析提供了信息,以得出适当的措施或对研究方案或设计进行调整,例如,在患者或研究中心数量发生变化的情况下。
对于III类器械和植入类器械,PMCF报告应至少每年更新一次。
在PSUR准备的两年期内,可能会准备多份PMCF报告,因为可能有多个活动具有不同的间隔。建议在PSUR中包含每个PMCF报告的简要摘要。
在任何情况下,在准备每个PSUR之前,都应该查看评估期间发生的所有PMCF分析和评估报告,看看是否所有内容都已完成。如果PMCF活动尚未完成,PSUR必须解释为什么可能与计划存在偏差,或者为什么没有足够的PMCF输出。

来源:医疗器械法规资讯


