您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-11 08:21
我国的干细胞药物研发已迎来黄金时代,截至2024年5月初,我国已有59家企业,共计114款干细胞药物临床试验申请获得受理,其中50家企业,共计91款产品获得临床试验默示许可。
干细胞产品,由于其“活”的药品属性,其CMC开发难点较多,也是其成药最核心的挑战。基于此,在ICH-Q8中最先提出质量源于设计(Quality by Design,QbD)这一理念,这一系统的研发方法,在基于可靠的科学和质量风险管理基础之上,从预先确定的产品目标出发,强调对产品和工艺的理解以及工艺控制。ICH-Q8强调,药品质量是通过设计所赋予的。区别于事后控制的质量源于检验(Quality by Testing,QbT),和事中控制的质量源于生产(Quality by production,QbP)。
QbD可分为以下6个关键步骤。
1、预先设定目标产品质量概况(Quality Target Product Profile,QTPP);
2、基于风险分析,确立产品的关键质量属性(Critical Quality Attributes,CQAs);
3、通过风险评估(Risk Assessment)和实验设计(Design of Experiment,DoE),确定关键工艺参数(CPP)、关键物料属性(CMA)和CQA的关系;
4、在多种影响因素下,建立能满足产品性能和工艺稳健的设计空间(Design Space),量化参数的可变性对CQA的影响。
5、根据设计空间,建立质量风险管理(Quality Risk Management,QRM),确立控制策略(Control Strategy,CS)和形成工艺控制空间。
6、生产后,实施检测和控制,持续改进工艺,保证工艺的稳健性和产品质量的稳定性。
本文将按照QbD的这六个关键步骤顺序,介绍QbD在干细胞产品研发中的应用及相关案例。
Step 1:确定MSC的QTPP
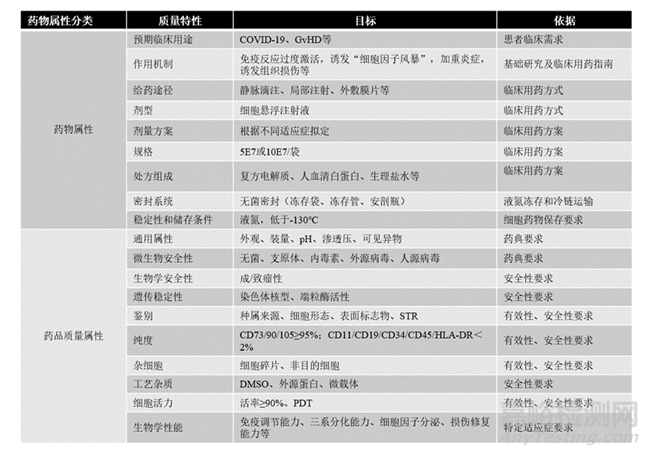
QTPP是药品开发的基础,是满足药物制剂安全性、有效性的质量特征,缺乏明确定义的QTPP会造成生产资源的极大浪费。药品的QTPP主要包括:
1、预期的临床用途,给药途径、剂型设计、给药系统与处方组成;
2、药物的剂量与规格
3、药品的有效期
4、药品包装容器密闭系统
5、药物释放和药代动力学的属性
6、药品质量标准。
下述表格以MSC产品举例,罗列出了在MSC产品开发中的QTPP:
表1、MSC产品的QTPP
Step 2:识别MSC产品的CQA
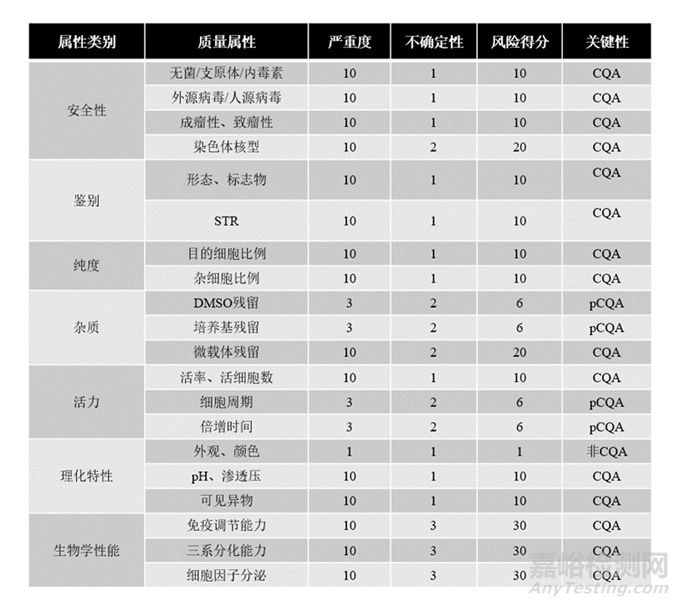
ICH-Q8是这样定义产品的关键质量属性的:物理、化学、生物或者微生物性能或特征在适当的限度、范围或分布,以确保得到期望的产品质量。MSC产品的CQA,即能够保证MSC的安全性和有效性的质量属性。在确定CQA时,通常使用风险排序法(PRM):通过评估质量属性对安全性和有效性的风险来确定CQA。评估包含两个维度:严重度和不确定性。其中,计算风险分数可使用严重度和不确定性相乘的数值。
严重度评分可分为三档:1)严重度较低,定义数值为1,这类属性的可变性对产品的安全性或有效性的影响很小或忽略不计,对患者的不良影响轻微且短暂。2)严重度中等,定义数值为3,即产品在临床历史中,属性的变异性可能降低安全性或有效性。可能导致可控制的不良反应,但不大可能对患者产生重大影响。3)严重度高,数值为10,这类属性的变异性可能对患者产生潜在的严重影响。对安全性、有效性存在潜在的重大变化,可能导致严重的不良反应。
对不确定性的评分也分为三档:1)不确定性低,数值定义为1,这类质量属性在大量的文献中已有报道,基于广泛的临床前研究、临床研究经验。2)不确定性中等,数值定义为2,即同类产品有部分文献报道,有一些可用的体内、体外或临床的数据,在临床方面只有有限的使用该产品的临床经验。3)不确定性高,数值定义为3,针对这类产品,先验知识很有限,在临床前和临床研究中均没有此产品可用的数据。
计算风险分数时,可将“严重度”和“不确定性”相乘,风险等级得分范围为:1-2分为非CQA;3-9分为pCQA;10-30分为CQA。
针对MSC产品,下表展示了部分通过RPM识别出的CQA项。
表2、MSC产品的CQA及判定依据
Step 3:识别MSC产品的关键物料属性CMA
在工艺流程中,当前一工序的输出物料成为下一工序的输入物料时,输出物料的CQA可能变成输入物料的CMA,因此在工艺流程中的关键物料,除了原始物料和辅料外,还包括中间体。识别MSC产品的CMA时,首先需确定全部物料属性,从对产品的安全性和有效性两方面评估其对产品CQA的影响;同时评估供应链风险,包括供应商质控、产品供应的连续性和物料变更可能。
针对MSC产品的开发过程中,关键的物料属性如下:
表3、MSC产品的CMA及判定依据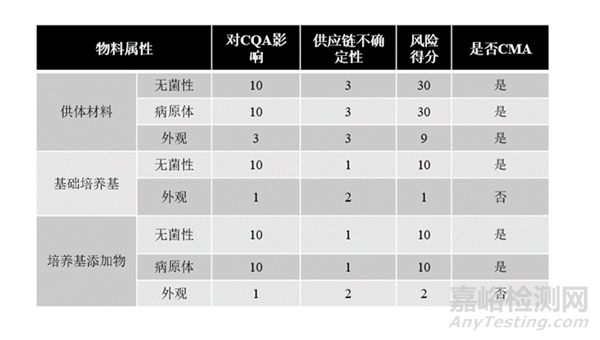
药典中还划定了四类物料的风险。
1)第1级为低风险、高品质的材料,是获得许可的生物制品、批准的药物、批准或承认的医疗设备,或者旨在用作植入的生物材料。通常为无菌包装系统或无菌剂型包装的,如人血清白蛋白、生理盐水等。
2)第2级为低风险、表征良好的材料,预期用途是用于药物、生物制品或医疗器械生产,高阔细胞、基因和组织工程产品的物料,是在GMP条件下生产的,如GMP级别的培养基、冻存液、细胞因子等。
3)第3级为中等风险材料,通常这些材料是为科学研究或体外诊断用途而生产的,而非用于生产细胞产品。这类材料可能需要升级物料的生产工艺以允许可使用该物料生产细胞产品,例如升级的科研级细胞因子生产工艺。
4)第4级为高风险材料,这些材料不是用于细胞产品的生产,也非cGMP生产的。包含具有已知生物学作用机制的剧毒物质,或未经外源病毒去除或灭活的复杂动物源材料,例如胎牛血清、胰蛋白酶等。
Step 4:对MSC工艺中CPP的识别
ICH-Q8中定义了关键工艺参数,即其波动会影响到产品的关键质量属性,而应该被监测或控制的工艺参数,以确保能够生产出预期质量的产品。
以脐带源间充质干细胞的生产工艺为例,不同阶段的CPP有很多。例如:在脐带采集时,作为原材料脐带的运输温度和运输时间;原代分离阶段的组织块大小、接种密度、培养时间、培养基种类;细胞扩增阶段的培养基种类、接种密度、培养温度、溶氧、pH值、葡萄糖浓度、培养时间、细胞汇合度等;细胞建库阶段的消化时间、离心转速、离心时间、东村密度、冻存液组分、程序降温和存储温度等;原液生产阶段的解冻时间、复渗时间、洗涤次数、离心力、离心时间、溶媒组分、细胞密度等;制剂灌装阶段的灌装速度、灌装体积、细胞浓度、保存温度和保存时间。

图4、MSC生产工艺[1]
针对MSC产品的的CPP判定依据如下表:
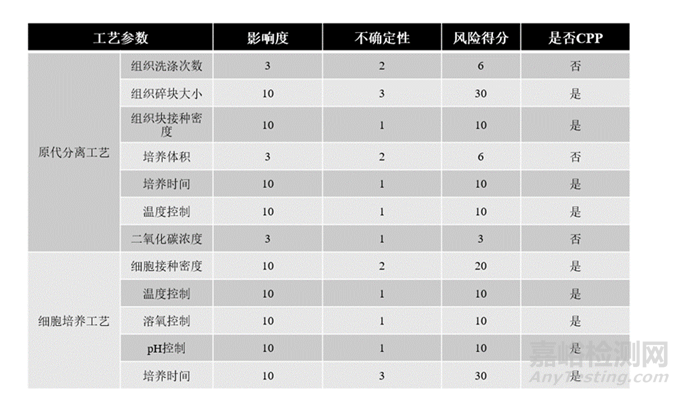
图5、MSC产品的CPP及判定依据
Step 5:使用DoE设计,建立设计空间
设计空间的定义为:已被证明能保证产品质量的输入变量(如物料属性CMA)和关键工艺参数CPP的多为组合交互作用的范围,在设计空间内的更改不需要上报,因为其不属于变更。
例如在一篇通过DoE设计优化间充质干细胞培养基组分的专利中[]提到,可以使用minitab软件,按照选择变量因子→设计不同水平,确定影响因子水平→列出全因子试验设计表→按照DoE给出方案进行MSC培养基优化实验→主效应及交互作用分析→实现最优化。
在这篇专利中,发明人将间充质干细胞培养基种类(培养基中有或无血清),QDS(一种启动水)体积含量,QDY(一种启动水)体积含量作为三个关键因子,设置不同水平进行交互分析。
图5、主效应分析图,表明无血清培养基效果高于有血清,启动水QDS和QDY的含量分别为5%时,培养效果最佳。
图6、交互作用分析图,确定MSC培养基的最佳优化条件为:无血清培养基,5%体积启动水QDS, 5%体积启动水QDY。
Step 6:持续工艺改进
间充质干细胞产品其持续的工艺改进至关重要。研究人员不断探索和升级培养基配方、优化细胞培养环境或者扩大生产规模,从而提高细胞分离、扩增甚至相关的生物学性能。有些平台也基于基因改造等升级了二代间充质干细胞产品,或是采用3D培养条件扩大了产能。随着技术革新与持续的工艺改进,工艺性能和产品质量检测的结果等都会造成工艺变更。为了正确评估并实施相关工艺变更,应当建立一个有效的变更管理系统。下表中列举了关于MSC产品中的一些变更案例。
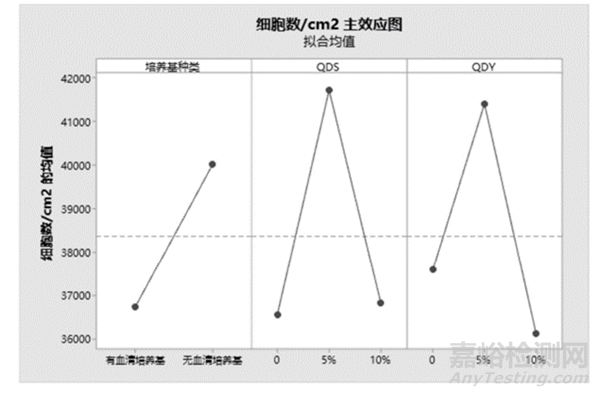
图7、MSC产品变更类型及判定依据
实施QbD理念并应用到产品开发中,将有助于提高产品开发效率和创新性。通过系统分析潜在影响因素和优化工艺参数,药品开发人员将更快地筛选出最佳工艺方案,从安全性和有效性这两大方面,保证产品质量,加速间充质干细胞产品从研发到上市的进程。
1、Optimization of Mesenchymal Stromal Cell (MSC) Manufacturing Processes for a Better Therapeutic Outcome,Front. Immunol., 09 June 2022.
2、专利授权号CN 114317423 B.
3、ICH Q8.

来源:药事纵横


