您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-17 08:19
研究背景
在2012年至2023年的12年间,FDA批准了48种含有无定形固体分散体(ASD)的药品(DP)。众所周知,难溶性药物如春潮翻涌般奔袭而来。已经研究了许多解决口服药物产品溶解度限制的固态形式和制剂策略,包括盐型、共晶、环糊精、脂质制剂、纳米晶体和无定形固体分散体。其中,值得注意的是,FDA批准的无定形固体分散体制剂的数量自推出以来一直在稳步增加,ASD技术成为提高难溶性药物口服生物利用度不可忽略的力量。为了成功地利用无定形固体分散体来增强药物递送,必须在制造过程和制剂产品的保质期内保持药物的无定形形式。此外,口服给药后,无定形基质会水合,药物会溶出。如果药物在暴露于生物体液后短时间内结晶,无定形制剂的溶解度优势将无法实现。因此,有必要评估药物在不同环境条件下的结晶趋势,并制定通过添加结晶抑制剂来改变结晶动力学的策略;对于固体分散体,聚合物是最广泛使用的结晶抑制剂。

图1 ASD开发的关键考量-货架期稳定性和溶出“弹簧-降落伞”1
情形分析
迄今为止,FDA批准的ASD通常由一系列不同的聚合物配制而成。这些聚合物分为无定形中性聚合物(PVPVA、HPMC、HPC和PVP)、无定形离子聚合物(HPMCAS、HPMCP、聚甲基丙烯酸酯)和结晶聚合物(PEG,聚乙二醇)。聚合物的选择是多方面的,因为聚合物具有多种功能,例如通过混溶性、药物-聚合物相互作用和抗塑化来增强物理稳定性,作为溶出速率增强剂,抑制过饱和溶液的结晶以及作为加工助剂。除了处方和制造工艺原因之外,单一来源聚合物的供应稳定性和使用偏爱是聚合物选择的关键驱动因素。
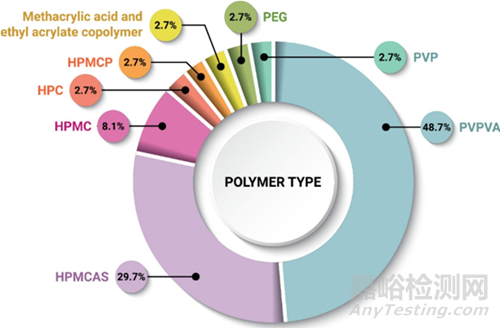
图2.用于配制ASD的聚合物的频率2
从图2可知,PVPVA存在于大多数ASD中(百分比:48.7%),而HPMCAS是第二常见的(百分比:29.7%)。试图推测在此数据集中选择聚合物的原因:
HPMC(百分比:8.1%)的选择受到限制,可能因为它在许多有机溶剂中相对不溶。
HPMCP(百分比:2.7%),未来可能会作为HPMCAS的替代离子聚合物获得更大的应用。HPMCP最常由信越提供,有HP-50和HP-55两种等级。HP-50和HP-55分别溶于pH5.0和5.5。
聚甲基丙烯酸酯(百分比:2.7%),肠溶聚合物家族,包括可溶于pH值高于5.5的甲基丙烯酸和丙烯酸乙酯共聚物(例如,Eudragit L100-55),或可溶于pH值高于6的甲基丙烯酸和甲基丙烯酸甲酯共聚物(例如,Eudragit L100)。
PVP(百分比:2.7%)PVPVA与化学相似,由于其吸湿性高,将来可能会减少使用频率。
HPC(百分比:2.7%)尚未被证明与药物分子具有显着的混溶性,因此其使用在未来可能不会扩大。
PEG(百分比:2.7%)是一种结晶聚合物,因此超出了稳定无定形药物的标准。在Envarsus XR中,他克莫司溶解在熔融的PEG中,然后喷洒到粉末床上(熔融造粒过程)。由于其低剂量和物理化学性质,他克莫司也可能不需要聚合物来稳定。
PVPVA的选择可能部分归因于其易于加工的热熔挤出(HME)。应用HME工艺的13个ASD中有12个使用这种聚合物(图3a)。PVPVA在暴露于挤出过程的高温下具有出色的热稳定性,并具有出色的粘弹性,可实现较宽范围的加工温度设计空间。PVPVA是一种中性(非离子)聚合物,具有中等吸湿性,可溶于许多有机溶剂,也是许多化合物的优良结晶抑制剂。PVPVA在接触水时形成强凝胶,这对于药物产品配方来说可能是一个挑战,其中凝胶层中的无定形-无定形相分离或结晶可能会对水合后的释放性能产生不利影响。此外,PVPVA可从多个供应商处获得。
HPMCAS是用于喷雾干燥ASD的最常见聚合物,50% ASD中使用该聚合物(图3b)。可以选择HPMCAS的原因包括其在许多有机溶剂中的溶解度,低吸湿性,pH值5.5-6.5以上的pH敏感释放以及出色的结晶抑制性能。HPMCAS有三种等级(L、M、H),它们的琥珀酰基和乙酰取代不同,导致其pH溶解度分布不同。其中,HPMCAS L和M型号在研究中最常见,因为与HPMCAS H相比,它们在相对较低的pH条件下可溶。HPMCAS比在HME工艺中使用的PVPVA更具挑战性,因为它在热处理过程中具有更高的粘度和更高的反应性,这可能导致药物和/或聚合物降解。由于其离子特性,HPMCAS可以根据其pKa与某些药物产生疏水离子对配方ASD的释放性能较差,或配方可能具有pH敏感的溶出性能。信越是HPMCAS最常见的供应商。

图3.(a)热熔挤出中ASD聚合物选择频率。(b)喷雾干燥中ASD聚合物选择频率。(c)用PVPVA配制的ASDs的制造工艺选择频率。(d)用HPMCAS配制的ASDs的制造工艺选择频率。2
案例分享
伊曲康唑是一种三唑类高效广谱抗真菌药物,已完成许多体外、体内和临床评估。该化合物的开发因其具有挑战性的物理化学特性而变得复杂:logP>5,pKa~4,在中性pH下水溶性为~1ng/ml,在0.1NHCl中为波~3μg/ml。伊曲康唑形成了一个关于聚合物选择的有趣案例研究。第一个产品是Sporanox(斯皮仁诺),于1992年获得批准,它使用HPMC作为聚合物来制备无定形药物层状珠子。

图4.伊曲康唑结构式、分子式和分子量3
Tolsura于2018年获批,是第二个获批的含有伊曲康唑ASD的药物产品。与100mg胶囊中的Sporanox不同,Tolsura含有65mg伊曲康唑,由HPMCP配制而成。虽然剂量不同,但Sporanox和Tolsura在进食条件下给药时被证明具有生物等效性。然而,在禁食条件下就不能这样说了。据报道,Sporanox容易受到食物和酸抑制作用的影响,需要低胃pH值才能达到治疗性血液水平。相比之下,Tolsura受餐后状态的影响较小,在禁食条件下报告的生物利用度适度增加。此外,虽然这些产品之间的生物等效性已被证明,但它们的剂量不同。例如,对于曲霉病的治疗,Sporanox给药BID,但QD给药Tolsura可能足以达到有效的血药浓度。此外,虽然Sporanox被批准用于治疗芽生菌病、组织胞浆菌病、曲霉菌病和甲癣,但Tolsura仅被批准用于治疗芽生菌病、组织胞浆菌病和曲霉病,而不用于治疗甲癣。因此,根据Tolsura处方信息,这些产品不被认为是可互换或可替代的。
Sporanox和Tolsura之间观察到的差异可以根据用于配制ASD的聚合物进行合理化。HPMC(Sporanox)是一种中性聚合物,溶解度与pH无关,药物释放可以在任何环境中发生,导致药物释放可能因pH环境而异,因为伊曲康唑在低pH值下具有更大的溶解度。HPMCP(Tolsura)是一种肠溶聚合物,在胃pH值下不溶,但在十二指肠pH值下可溶,当与弱碱性药物(如伊曲康唑)搭配使用时,大部分药物溶出只会在肠道中开始,导致在进食和禁食条件下药物释放一致。然而,在胃部环境中,伊曲康唑被电离并可能从制剂中溶出,导致肠道环境中结晶、去过饱和或药物释放不完全的风险。这种药物释放模式在几种弱碱性药物中得到了证明。
总结
随着新药开发中难溶性药物出现的频率越来越高,固体分散体的应用越来越多。本文基于FDA批准上市的ASD产品中所用聚合物的分析,总结出最常用的聚合物及其特点,有助于后续该增溶制剂的开发和聚合物的选择。
参考文献
1.Pharmaceutical Amorphous Solid Dispersions.Author(s): Ann Newman Publisher: Wiley, Year: 2015.ISBN: 1118455207,9781118455203.
2.Trends in amorphous solid dispersion drug products approved by the U.S. Food and Drug Administration between 2012 and 2023
3.伊曲康唑胶囊说明

来源:药事纵横


