您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-23 16:06
1、不同药典中不溶性微粒检测的历史发展
1.1 中国药典
1985年版《中华人民共和国药典》收录了100 mL以上大容量注射液的不溶性微粒检测(显微计数法);2000年版《中华人民共和国药典》增加了光阻法作为不溶性微粒检测的第二法;2005年版《中华人民共和国药典》将光阻法由第二法改成第一法,并增加100 mL以下小容量注射液剂型的检测方法;2010年版《中华人民共和国药典》通则<0903>更新,光阻法和显微计数法的检测限度标准与美、日、欧药典基本一致;2015年版《中华人民共和国药典》增加了用于无菌粉末、无菌原料药、注射用浓溶液的检测方法;2020年版《中华人民共和国药典》通则<0903>内容与2015年版内容保持一致。
1.2 美国药典
1975年美国药典(USP)采用显微计数法检测评估100 mL以上大容量注射剂中不溶性微粒;1985年增加光阻法为第二法并对100 mL及以下的小容量注射液剂型检测方法作了要求;1995年USP 23<788>将光阻法改为第一法,显微计数法作为第二法,并对判定标准进行了修改且沿用至今;2017年USP 40<1788>收录不溶性微粒检测第三法——动态(流动)图像法(Flow Imaging Method,FI),但FI作为新兴技术,缺乏历史数据,难以建立统一的规范,至今仍未被收录至通则<788> 中。
1.3 欧洲药典和日本药典
对比欧洲药典5.0版(EP 5.0)和欧洲药典10.0版(EP 10.0)及日本药典15版(JP 15)和日本药典18版(JP 18),发现欧洲药典和日本药典不溶性微粒检测方法相关章节在近年来无明显变化。但是EP 11.0<2.9.19>章节中内容相较于EP 10.0增加了生物技术药物不溶性微粒检测相关内容。
2、不同药典中不溶性微粒要求比较
自2010年起,《中华人民共和国药典》2010年版对不溶性微粒的要求与美国药典(USP 32)、日本药典(JP 15)、欧洲药典(EP 6.0)已基本保持一致,但在具体检测方法上仍存在部分差异。此外,美国药典中不溶性微粒检测除了注射剂通用的USP<788>章节外,还专门针对治疗性蛋白注射剂(USP<787>)和眼用制剂(USP<789>)单设章节,要求更加清晰。JP 18也针对治疗性蛋白注射液单设章节<6.17>,而在《中华人民共和国药典》2020年版中却未见区分。以下将从ChP 2020、USP-NF 2023、EP 11.0、JP 18中注射剂不溶性微粒要求的通用章节的检测方法、质量标准、系统适用性要求三个方面进行比较论述。
2.1 检测方法的对比
不同药典推荐的不溶性微粒检测方法均为光阻法与显微计数法,但在检测涉及的试验环境、检查用溶剂和具体的样品检测要求上,中国药典与美、欧、日药典存在差异。
2.1.1 对试验环境和检查用溶剂的要求
为了尽可能减小外来颗粒对样品检测结果的影响,各国药典除了对测试环境和检查用溶剂提出要求外,还要求在检查前进行检测。USP-NF 2023明确了该检测的目的是确认测试环境、玻璃器皿、微粒检测用水等是否满足试验要求,且该检测可重复进行直至结果满足要求后才可进行后续试验。对比来看,美国药典对于检查用注射用水的要求较高,具体见表1。
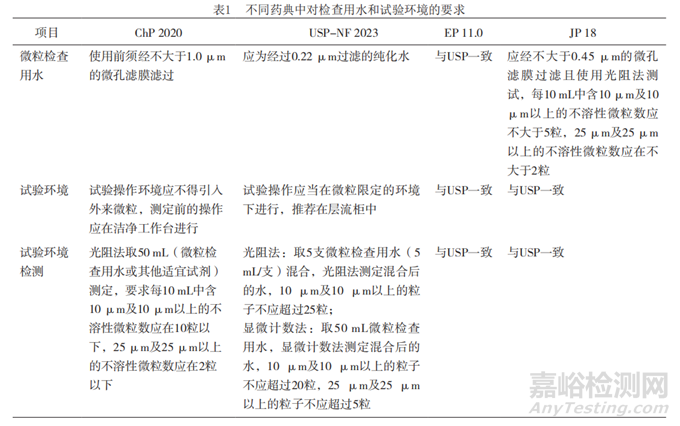
2.1.2 样品检测要求
在具体的样品检测要求方面,不同药典在相同供试品规格下的供试品数量、检测次数、检测体积有所不同。此外,USP-NF 2023<788>要求对于大容量注射剂,应对单个用药单元进行测试,而这一点在Chp 2020通则<0903>中并未明确。且在FDA官网的GMP问答中,也表示不接受测试单元之间的结果进行平均,因为颗粒物质在整个批次中可能是不均匀地分散的,评估每个单独单元的结果的目的是确保代表性并检测批次内的潜在变化。
美、欧、日药典就不溶性微粒检测相关内容已达成一致,不会单方面作出修改。通过与中国药典内容对比可见,无论是光阻法还是显微计数法,在对于不同规格的供试品,其供试品数量和检测次数要求上,美、欧、日药典要求与中国药典差异较大,尤其是在对25 mL以下的供试品检测方面。美、欧、日药典要求更侧重在对25 mL以下的供试品检测要求的限定,其检测要求也更为详细和严苛。两种方式各有优劣,比如采用美、欧、日药典的检测方法时,供试品数量要求多,测试覆盖的样品体积大,检测得到的数据也更具批代表性;而且,光阻法检测时,对于仪器是否具备微量进样功能的依赖度更低。但是,对于单瓶货值比较高的小容量规格的供试品而言,测试时供试品用量大,检测成本较高,而且虽整体样品量大而更具代表性,但也在一定程度上平均了各个供试品的品质差异,弱化了在实际应用过程中单瓶供试品间的差异。采用中国药典的检测方法,则可以降低企业的检测成本,并更有利于监测单个供试品内不溶性微粒水平的波动。
此外,Chp 2020还明确了静脉注射用无菌粉末和供注射用无菌原料药的测试方法,而USP-NF2023中仅提到了粉末的溶解方法。光阻法检查方法对比见表2、表3,显微计数法检查方法见表4、表5。



2.2 质量标准的对比
2.2.1 方法优先级比较
不同药典均将光阻法作为检测方法的第一法,显微计数法作为第二法。美国药典、日本药典、欧洲药典均明确说明光阻法优先,中国药典并未明确提及,且在描述不适合光阻法检测的特殊样品时,表述中出现了显微计数法测定结果有效性略优于光阻法的描述:“当光阻法测定结果不符合规定或供试品不适于用光阻法测定时,应采用显微计数法进行测定,并以显微计数法的测定结果作为判定标准。”美国药典、日本药典、欧洲药典也提到“供试品不适于光阻法时可以采用显微计数法”,但并未出现“以显微计数法的测定结果作为判定标准”这一表述。在美、日、欧药典中,当出现光阻法和显微计数法都可采用的情况时,并未明确说明以哪一个方法为准,而是希望得到一个一致(Conformance)的结论。
2.2.2 限定标准比较
在大体积和小体积的分类中,中国药典、日本药典将100 mL规定为大体积,美国药典和欧洲药典则将100 mL规定为小体积,除此之外,各药典对于大容量注射剂和小容量注射剂的限定标准一致,具体见表6。
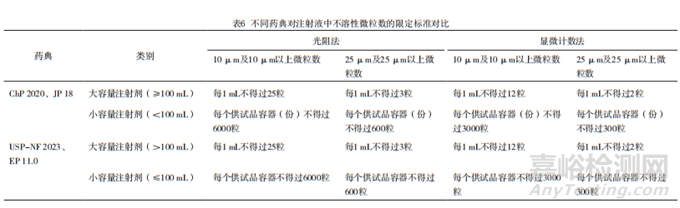
但是在ICH Q4B附录3(R1)中,对于100 mL注射剂,欧盟和FDA均认为美、日、欧三方药典的判定标准均有同等效力。因此,中、美、日、欧在对注射液中不溶性微粒数的限定标准方面要求一致。
2.3 系统适用性检测的对比
系统适用性是在检测样品之前,用来确认测量系统的重复性和准确性是否能够满足当前分析的要求,测试基于的原则:整个测量系统是由仪器、电路、分析方法和样品所组成的,将其作为整体去测试,从而验证整个系统的状态。药典中对不溶性微粒检测的系统适用性描述不涉及分析方法和样品,只对仪器进行系统适用性要求(使用标准样品对仪器进行校验),因此本节对药典中系统适用性的对比只涉及了仪器部分。
中、美、日药典均介绍了不溶性微粒测试方法的系统适用性标准,欧洲药典仅介绍了不溶性微粒测试方法,未见系统适用性要求相关内容。中国药典和日本药典将测试方法、限定标准、系统适用性都放在同一章节,分别对应2020年版《中华人民共和国药典》通则<0903>和JP 18<6.07>,USP-NF 2023则将测试方法和限定标准放在<788>中,而系统适用性测试标准则在<1788>、<1788.1>、<1788.2>中均有描述。
2.3.1 光阻法
欧洲药典并未对光阻法的系统适用性进行较多描述,中国药典、美国药典、日本药典在系统适用性检测上的不同之处主要为检测项目的差异,详见表7。

(1)在仪器的校准频次方面,中国药典明确至少每6个月校准一次,日本药典明确至少每一年校准一次,美国药典虽未明确校准频次,但是提出应在使用前或日常进行足够频次的性能确认,以验证仪器在制造商的规格和预期用途范围内提供准确、一致的结果。
(2)在体积准确性的验证方面,美国药典仅验证2次结果的准确性,未考虑此项重复性的验证。中国药典则验证3次测试准确性,其对体积准确性的要求更高。
(3)相对于中国药典,美国药典和日本药典对流速和直径校准提出了要求,检测项更为详细及严苛。事实上,基于光阻法原理,将流速作为系统适用性确认项有利于测试过程更准确。而且对于光阻类传感器而言,不同流速下的校准曲线结果是有差异的。对于用于曲线校准的粒子的大小,美国药典和日本药典也有所不同,美国药典中对于标准粒子的选择进行了说明,比如10μm和25μm是标准检测要求,增加5μm和15μm的校准是为了确保测试结果准确可靠。
(4)中、美、日药典在对微粒计数的测定方法与标准上均有不同。中国药典要求计数误差在20%以内,而美国药典要求计数误差在10%左右,计数准确性要求更高,且针对不同类型的设备,作了3种方法区分,充分考虑不同设备的验证能力。且在实践操作中,美国USP官方商城中出售的Particle Count Set中将计数准确性设定了两个范围值,一个是颗粒数量的范围值,另一个是粒径15μm和10μm的颗粒数量比值,且经过计算,误差范围约在±10%。
(5)在对传感器分辨率的要求上,中国药典和美国药典对粒子大小分辨率测试方法的描述较为全面,日本药典和美国药典的检查方法和要求一致,但计算方法略有不同。对比而言,美国药典所述的计算公式更科学,更能反馈传感器的分辨率性能。
2.3.2 显微计数法
对于显微计数法的系统适用性检测,日、欧药典内容一致,且所涉及的项目在美国药典均有包含。美国药典所含内容最为详实,中国药典在项目要求上相对较少,详见表8。
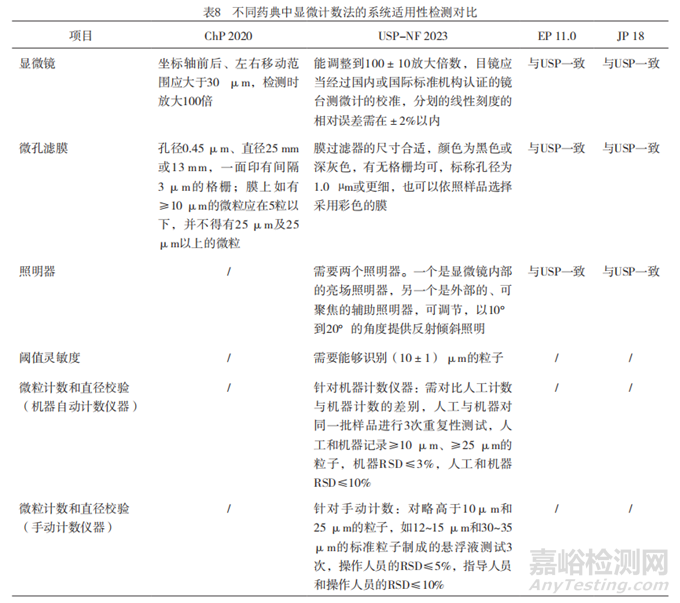
美国药典认为显微镜的光学对准和照片是显微计数法成功的关键,且显微镜对准不良也会造成操作者的疲劳。由于衍射极限约为1μm,在次优照明、干扰背景、粒子特征等多因素影响下,可能很难区分9μm和10μm或24μm和25μm。而操作员必须确认一个粒子是否高于或低于极限,因此优化检测系统的分辨率十分重要,基于操作者和保证测定数据的准确性考虑,美国药典对显微镜、照明器、阈值灵敏度、微粒计数和直径校验(机器自动计数仪器)、微粒计数和直径校验(手动计数仪器)均作了详细的要求。且美国药典要求,当该粒子粒径结果处于极限,不确定是否应当被计数时,操作员应当将其计数,且应对主要的粒子形态进行描述,适时做进一步分析。
在对微孔滤膜的要求上,中国药典明确了孔径为0.45μm,美国药典则是给出了孔径范围(孔径为1.0μm或更细),给予操作者一定的选择空间,且在<1788.2>章节中对此进行了说明,即“更细的孔径膜有更光滑的表面,提高了颗粒在显微镜下的分辨率,但较小的孔径可能会阻碍实验过程中黏性样品液的过滤”。
3、对于生物技术药物中不溶性微粒的监管考虑
3.1 药典要求
目前,ChP 2020对于不溶性微粒的要求仅有通则0903,通过对ChP 2020三部收载的治疗性蛋白品种进行汇总,发现此类品种的不溶性微粒限度也仅要求符合通则0903,未见针对生物技术药物特性提出不溶性微粒要求。而USP-NF 2023、EP 11.0、JP 18则均收载了生物技术药物中不溶性微粒相关的检测方法和要求。如USP-NF 2023和JP 18针对该类产品的特性,为治疗性蛋白注射液不溶性微粒单独制定了通则;EP 11.0虽未单设章节,但相较于上一版,在内容中也增加了生物技术药物适用的部分,具体内容如下:
(1)在检测方法方面,USP-NF 2023<787>章提到应首选光阻法,但同时也提到在充分研究的基础上,其他监管可接受的方法及限度要求也是可以被接受的。显微计数法则在非蛋白粒子或重要的粒子特征检查时会用到。在JP 18<6.17>章节中则明确检查方法为光阻法,并未提及显微计数法。EP 11.0<2.9.19>则提到光阻法和显微计数法均可适用。另外,USP-NF 2023、EP 11.0、JP 18均提出,应用光阻法检测时,超声处理作为常用的除气泡的方式并不适用,因为超声可能会导致蛋白的聚集或变性而影响检测结果。
(2)在检测用样品方面,USP-NF 2023<787>章节指出,若企业全面考虑到使用较小的检测产品体积可能涉及的分析相关的问题,在提供相关说明的情况下,允许使用较小的检测产品体积和较小的检测等分来进行检测,单次检测所需的体积通常为0.2~5.0 mL。在JP 18<6.17>中也明确样品检测体积可以减低为1 mL至5 mL,在满足一定条件下,甚至可以降至0.2 mL。而EP 11.0<2.9.19>仅说明在仪器适用的情况下,可将检测体积定为1 mL至5 mL。USP-NF 2023、EP 11.0、JP 18均认可若可以从一个容器中获得测试所需的体积,则对单个容器进行测试;若单个容器中的体积不能满足测试需求,可将多个容器中的内容物混合;但均未对混合样品的数量进行规定。与表2要求相比,这充分考虑到该类产品的容量较小的规格特征[18]和检测成本。
(3)在限度要求上,均仍仅对粒径为10μm和25μm及以上的粒子进行计数,JP 18<6.17>和EP 11.0<2.9.19>中的限度要求与表6一致。USP-NF2023<787>虽对治疗性蛋白注射剂中不溶性微粒提出了要求,但也仅在通用章节<788>要求的基础上,对于大容量注射剂(>100 mL)增加了单个供试品容器总微粒负载量的要求,即对于粒径在10μm及10μm以上微粒,数量应≤6000粒/容器;对于25μm及25μm以上微粒,数量应≤600粒/容器;在<1787>章节中提供了对产品中2~10μm粒径粒子计数和区分粒子类型的检测方法,以便在进行此类产品不溶性微粒检测时可以进行更小粒径范围的粒子监测。
但是,对有免疫原风险的小粒径(0.1~10μm)不溶性蛋白聚集体微粒,均未提出明确要求或指导性建议以控制其可能带来的免疫原性危害。
3.2 指导原则等相关要求
FDA在2014年发布的《行业指南:治疗性蛋白制品免疫原性的评估》(Guidance for IndustryImmunogenicity Assessment for Therapeutic Protein Products)指出,蛋白质聚集形成的颗粒可能会引起或增强免疫反应[19],形成的高分子聚合蛋白是可能造成免疫反应的主要物质。此外,0.1~10μm大小范围内的微粒也具有很强的免疫原性潜力。因此,FDA建议企业应在研发过程中尽可能采取措施减少蛋白质聚集,在产品检测中也需要采用单独或联合增强蛋白聚集体检测的方法来表征产品中不同种类的聚合物。FDA在该文件中还指出,企业应评估治疗性蛋白产品在整个保质期过程中(包括最初样品)存在的亚可见颗粒(2~10μm)的范围和水平。随着科技的发展和更多检测方法的出现,企业应努力在更小的尺寸范围内(0.1~2μm)对产品中的粒子进行表征。根据USP-NF 2023<1787>的描述,这里应当包括粒子的类型、粒径范围及不同粒径粒子的数量水平等内容。
经查询日本药品医疗器械管理局(Pharmaceuticals and Medical Devices Agency,PMDA)、欧洲药品管理局(The European Medicines Agency,EMA)和我国国家药品监督管理局相关官网,PMDA于2023年3月在官网发布草案《生物技术产品(生物制药)原料药、药品中不溶性颗粒物的流动成像法评价方法》[Evaluation Method of Insoluble Particulate Matter in Biotechnological Products (Biopharmaceuticals) Drug Substances/Drug Products by Flow Imaging Method〈G3-17-182〉],该草案提及了对于蛋白聚集体带来的免疫原性,应对其进行严格的评估和控制,但是该方法的测量范围仍为2~100μm。国家药品监督管理局药品审评中心于2022年5月发布的《特异性人免疫球蛋白药学研究与评价技术指导原则》对于不溶性微粒控制也仅提出“特免制品尤其是静注特免制品,还需重点关注对不溶性微粒的控制。”对于蛋白聚集体仅提出“特免制品制备过程中产生的多聚体与抗补体活性(ACA)有关,应重点控制免疫球蛋白G(IgG)多聚体含量。”未见对于多聚体的含量和小粒径不溶性蛋白聚集体颗粒相关标准和指导原则。
4、建议
对于治疗性蛋白注射液中不溶性微粒,虽然FDA发布行业指南建议评估治疗性蛋白产品中小粒径(0.1~10μm)的不溶性微粒,但是该行业指南并非强制要求。所以,对于产品中不溶性微粒,目前主要依靠企业的风险防控手段进行控制,企业在进行充分的研究和有足够的数据支持的基础上,明确在新增的不溶性微粒不影响产品本身质量的前提下,采取终端过滤的方式除去;如抗EGFR全人源单抗注射液,其进口原研药(帕尼单抗)和国内生物类似药注射前都要进行滤器过滤。可是,这并未从根本上解决问题,还是需要研发者秉着质量源于设计(QbD)的理念在药物的研发设计时,关注到产品中的小粒径不溶性微粒,通过制定有效的措施,减少不溶性微粒的产生以降低或消除风险。
小粒径(0.1~10μm)蛋白聚集体通过静脉注射进入患者体内可能引发的免疫原性的风险日益受到关注,可是目前仍按照药典通则要求对10μm及10μm以上的粒子进行质量控制。为更好地控制生物技术药物中小粒径(0.1~10μm)蛋白聚集体可能带来的免疫原性风险,保障患者的用药安全,提出以下三点建议:
(1)方法学研究方面:建议应使用多种方法检测注射液中小粒径不溶性微粒,进行全面的表征和对比性研究以获得准确的数据。此外,产品中“固有颗粒”的形成是一个动态、持续的过程,建议可分两个阶段对产品中小粒径微粒进行监测。先建立快速检测方法,准确识别产品中小粒径(0.1~10μm)不溶性微粒的增长情况;再根据需要对产品中不溶性微粒进行鉴定和分类,以充分了解产品的质量情况。
(2)数据收集方面:建议持续收集产品中小粒径不溶性微粒数据,包括临床试验样品、稳定性考察样品及上市后的货架期内的样品,结合不良反应情况对数据进行分析。
(3)技术要求方面:建议在可能涉及此类风险的生物技术药物药学研究指导原则中明确对初始样品和稳定性样品中0.1~10μm小粒径不溶性微粒数据的收集,以引导企业关注,尽可能在研发阶段找到合理的措施降低风险。
编者按:
综上所述,不同药典中不溶性微粒检测方法经历了不断的发展和完善。未来,随着科技的进步和医药行业的发展,不溶性微粒检测将面临新的挑战和机遇。我们需要继续加强研究和合作,不断完善和优化不溶性微粒检测方法,以确保注射剂的安全性和有效性。

来源:《中国药事》


