您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-26 20:07
内容提要:针对新法规下仍有大量医疗器械生产企业按传统执行计数抽样检验程序的问题,文章提出基于修改判定数组的计数抽样检验程序,并将计数抽样检验与风险管理进行结合,使企业的检验工作能够反馈定性数据和定量数据,从而能够深度参与企业的技术活动,为医疗器械生产企业在新法规下的检验工作提出思路。
关 键 词:医疗器械 计数抽样检验程序 GB/T 2828 标准 GB/T 2829 标准
随着我国经济过去几十年的高速增长,我国医疗器械行业也在快速发展,医疗器械监管方面的法规也随着行业的发展逐步完善。《医疗器械监督管理条例》经过2014 年、2017年及2020 年几轮修订,在各个方面都对企业有更高的要求,其中,对企业在检验方面的工作要求改变巨大,具体而言,要求产品由符合医疗器械国家标准或医疗器械行业标准改为符合强制性国家标准(或强制性行业标准)和产品技术要求。法规修订前,绝大部分企业执行计数抽样检验程序,法规修订后,计数抽样检验程序已经不满足法规要求,由于计数抽样检验程序几十年来运行的巨大惯性,以及没有替代规则的出现,大多数企业仍在执行计数抽样检验程序,面临违法的风险。目前尚未有对新法规下的检验程序方面进行研究。基于这种情况本文对新法规下的检验程序进行探讨,提出基于修改判定数组的计数抽样检验程序。
1.计数检验和抽样检验
计数检验是检验单个产品是否合格,以此计算一定数量产品的不合格数量[1]。
抽样检验是从一批产品中按规定的抽样方案随机抽取少量产品进行检验,按规定的判定规则判断该批产品是否合格的检验。该检验法的优点是不需要对一批产品全部进行检验,节约工作量和检验成本;缺点是存在误判的风险,得到的信息不足。
2.计数抽样检验
计数抽样检验从一批产品按规定的抽样方案随机抽取少量产品进行检验,计算不合格数量或比例,按规定的判定规则判断该批产品是否合格的抽样检验[1]。该检验只能用于定性的判定,不能用于定量判定。由于该检验对总体质量特性的分布没有限制要求,因此应用范围广,但提供的信息量有限。
3.计数抽样检验程序
计数抽样检验程序是一种特殊的假设检验,是在Ⅰ型错误和Ⅱ型错误发生概率一定的条件下的检验。
计数抽样检验程序常用的标准是GB/T 2828系列标准和GB/T 2829 标准[2],均是从ISO 标准转化而来,到目前为止共发布8 个标准,包括GB/T 2828 系列的第1 部分、第2 部分、第3 部分、第4 部分、第5 部分、第10 部分、第11 部分(其余部分尚未转化)和GB/T 2829 标准。GB/T 2828系列标准中GB/T 2828.1 应用最广泛。
4.接收质量限和不合格质量水平
在GB/T 2828 系列标准的执行过程中,都要先确定接收质量限(Acceptance Quality Limit,AQL)。它表示可容忍的系列批的最差过程平均质量水平[1]。
在GB/T 2829标准的执行过程中要先确定不合格质量水平(Reject Able Quality Level,RQL)。它表示不可接受的批质量下限值。
5.计数抽样检验程序在医疗器械旧法规下的应用
5.1 旧法规相关规定
我国医疗器械领域最高法规层次为国务院发布的条例,名称为《医疗器械监督管理条例》。该条例下配套规章(局令)、规范性文件(各类通知)和指导原则(主要为技术审评方面),构成我国医疗器械的法规体系。
我国最早的《医疗器械监督管理条例》发布于2000 年。在医疗器械检验方面的规定主要为:①生产医疗器械,应当符合医疗器械国家标准;②没有国家标准的,应当符合医疗器械行业标准。
医疗器械国家标准和医疗器械行业标准由相关领域的标准化技术委员会制定,其中医疗器械国家标准由国家标准化委员会和药监部门共同发布;医疗器械行业标准由药监部门单独发布[3]。
旧法规下,并非所有的医疗器械都有医疗器械国家标准或医疗器械行业标准,医疗器械生产企业会依据相关标准制定医疗器械注册产品标准,医疗器械注册产品标准在产品注册申报时由药监部门审批。
而我国以前制定的医疗器械国家标准或医疗器械行业标准的第6 章或第7 章一般为“检验规则”,包括至少4 节,一般第3 节为逐批检验,第4 节为周期检验。逐批检验一般都引用GB/T 2828.1,按检验项目的不合格分类(分为A、B、C三类)确定检查水平和AQL,周期检验一般都引用GB/T2829,按检验项目的不合格分类(分为A、B、C三类)确定判别水平、RQL和抽样方案。
5.2 旧法规下医疗器械生产企业的检验
企业在检验方面的工作包括入厂检验、过程检验和出厂检验,依据医疗器械注册产品标准制定相对应的检验规范。入厂检验、过程检验和出厂检验中的逐批检验一般会参考医疗器械国家标准或医疗器械行业标准按GB/T 2828.1 进行计数抽样检验;出厂检验中的周期检验一般会参考医疗器械国家标准或医疗器械行业标准按GB/T 2829进行计数抽样检验。
5.3 旧法规下医疗器械生产企业检验规则的弊端
旧法规检验规则下B类和C类项目(尤其是C类项目)存在检验不合格(不合格数量未超过规定数量)允许出厂的情况(GB/T 2828 系列标准和GB/T 2829 标准的规定)。因此存在一个矛盾的现象,明明医疗器械生产企业的产品不合格,但允许流入市场,这种做法还不违反法规的要求。这种情况对医疗器械的使用者不公平,也对药监部门的监管不利。
在旧法规下,医疗器械生产企业的检验工作扮演的是判定合格与否的角色,检验工作无法有效参与到医疗器械生产企业的其他技术活动中。例如,对医疗器械生产企业的设计开发工作参与不足,对医疗器械生产企业的技术改进工作反馈有限,对医疗器械生产企业的风险管理工作支持不力,在医疗器械生产企业的不良事件管理工作中存在感极低。其最关键的原因是医疗器械生产企业采用的计数抽样检验是一种定性的方法,不是定量的方法,而这些技术活动都需要定量的数据支持。
6.计数抽样检验程序在医疗器械新法规下应用存在的问题
6.1 新法规的调整
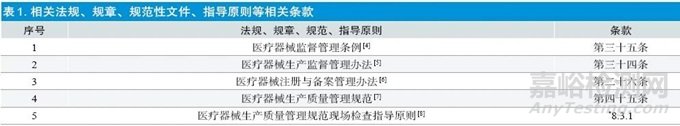
《医疗器械监督管理条例》经过2014 年、2017 年、2020年几轮修订,逐步完善,目前最新版为2020 年版修订版,在修订过程中与检验相关最大的变化是产品由符合医疗器械国家标准或医疗器械行业标准改为符合强制性国家标准(或强制性行业标准)和产品技术要求[4]。同时,配套的规章、规范性文件、指导原则也做了进一步规定,详见表1。医疗器械生产企业的检验工作也应随着法规的调整进行相应的变化。
6.2 计数抽样检验程序在新法规下的问题
2014 年以后,我国制定的医疗器械国家标准和医疗器械行业标准不再有“检验规则”章节,根据医疗器械产品技术要求相关的法规文件,企业的医疗器械产品技术要求也没有“检验规则”章节,“检验规则”不再由监管部门规定,由医疗器械生产企业内部自行规定[9]。
由于“检验规则”几十年来运行的巨大惯性,以及没有替代规则的出现,绝大多数医疗器械生产企业在制定出厂检验规范时仍然在执行以前的规则,逐批检验和周期检验仍然GB/T 2828.1 和GB/T 2829 进行抽样检验。
按照GB/T 2828 系列标准和GB/T 2829标准检验不合格(未超过规定不合格数量)的产品批次是允许出厂的,但在新法规下这种做法是违法的,因为强制性标准和产品技术要求都只要求产品的项目应符合规定,没有要求检验的产品中多少个合格(或不合格)属于符合规定,意味着只要有不合格就不符合规定,不符合强制性标准和产品技术要求。
6.3 计数抽样检验程序在新法规下可能的后果
上述情形违反《医疗器械监督管理条例规定》第八十六条(一)款的规定,处罚为包括:①责令改正,没收违法的医疗器械;②罚款2万~5万元(货值≤1 万元)或货值5~20倍(货值>1万元);③情节严重的,责令停产停业,吊销医疗器械相关许可证件(注册证、生产许可证、经营许可证);相关人员没收违法期间收入,处收入30%~300%罚款,10 年内禁止在医疗器械相关领域从业[4]。
与旧版条例相比,对企业的罚款数额提高,另外增加了对相关人员的处罚,且处罚极其严重。
如果长时间沿用GB/T 2828 系列标准和GB/T 2829标准的“检验规则”,则有可能构成“情节严重的”,相关人员(包括企业法人、管理者代表、质量授权人、质量部门负责人、质量检验人员)将面临财产和从业两方面的巨大风险。
7.计数抽样检验程序在医疗器械新法规下的应用探讨
7.1 仍然可以执行计数抽样检验程序的情形
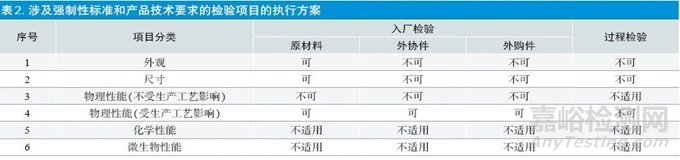
由于相关法规都是围绕强制性国家标准(或强制性行业标准)和产品技术要求。因此,凡是不涉及强制性国家标准(或强制性行业标准)和产品技术要求的检验项目理论上仍可以执行GB/T 2828系列标准和GB/T 2829标准,涉及强制性国家标准(或强制性行业标准)和产品技术要求的检验项目,建议分别考虑:①原材料入厂:原材料在生产过程中一般都会经过再加工,其特性会发生改变,因此原材料涉及强制性国家标准(或强制性行业标准)和产品技术要求的绝大部分入厂检验项目可以执行GB/T 2828 系列标准和GB/T2829 标准。②外购件、外协件入厂:外购件、外协件一般只会经过清洗、组装、消毒/ 灭菌,其主要特性一般不会发生改变,因此外购件、外协件涉及强制性国家标准(或强制性行业标准)和产品技术要求的绝大部分入厂检验项目不可以执行GB/T 2828系列标准和GB/T 2829标准。③过程检验:检验时产品的主要质量特性已经形成,不可以执行GB/T 2828系列标准和GB/T 2829标准。④化学性能和微生物性能等特殊性能一般都有单独的检验规则,不适用于GB/T 2828 系列标准和GB/T 2829 标准。
对于具体项目,详见表2。
7.2 基于修改判定数组的计数抽样检验程序应用方案
绝大部分医疗器械生产企业并没有专业的统计人员,无法建立一个合理的替代的检验规则,因此比较简单的办法就是仍然使用GB/T 2828系列标准和GB/T 2829标准,仅对标准的检验规则进行少量改动。具体而言,就是仍然根据GB/T 2828.1 按检验项目的不合格分类确定出厂检验的检查水平和AQL,根据GB/T 2829 按检验项目的不合格分类确定周期检验的判别水平、RQL和抽样方案,但是对两者的判定数组进行修改,将判定数组n[Re,Ac] 一律修改为n[0,1],即存在不合格该批次就不被接受。这样修改虽然不满足GB/T 2828 系列标准和GB/T 2829 标准,但由于GB/T 2828 系列标准和GB/T 2829 标准为推荐性标准,可参考执行,因此这样修改既不违反强制性标准也不违反现行法规。而且这样的修改对于检验人员而言,简单易懂,可与以前的检验规则顺利衔接,无须再经过其他培训。
例如:某医疗器械生产企业老法规下某出厂检验项目为B类,检查水平为S-3,AQL为2.5,该批产品的批量为3000 件,查GB/T 2828.1 表1 可知字码为E,查表2 得样本数量为13,但无对应的判定数组,需向下跳转,跳转后抽样方案为20[1,2],即抽检20 件其中有1 件不合格是可以接受的。在新法规下,根据GB/T 2828.1 表1 查字码为E,查表2 得样本数量为13,然后直接将抽样方案定为13[0,1] 即可,不需要再看AQL值所对应的判定数组。
7.3 计数抽样检验与风险管理的结合
如果只执行上述规则下,医疗器械生产企业的检验工作仍然扮演的是判定合格与否的角色,无法有效参与到医疗器械生产企业的风险管理活动。因此以下叙述建立计数抽样检验与风险管理结合的方法。
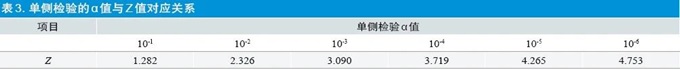
通过上述计数抽样检验程序得到的检验数据,可计算出该检验项目的均值x 与标准差s,已知该检验项目技术要求的上限USL 和下限LSL,则该项目超过上限的单侧检验量Zu=(USL-x)/s,低于下限的单侧检验量ZL=(x-LSL)/s,查Z值表或通过统计软件可以得到检验量Zu 与ZL 对应的确切的显著性水平αu与αL,显著性水平之和αu+αL 值为该检验项目的不合格概率,即该检验项目的风险概率。由于风险概率通常以10 的负整数倍划分等级,以下列出单侧检验中常用的10的负整数倍的α 值与Z值对应关系,详见表3。
通过上述计数抽样检验程序以及风险概率计算过程,医疗器械生产企业的检验工作不再仅反馈定性数据(批次是否合格)还能反馈定量数据(单个项目不合格的风险概率)。
计数抽样检验工作人员可将得到的单个项目不合格的风险概率动态反馈给风险管理人员,风险管理人员可以确切地知道该项目具体的风险概率,进而与设定的最高允许发生概率进行对比,从而动态地了解该单项风险是否超出风险接受准则[10]。这样,计数抽样检验就能与风险管理活动有机的结合起来。
同时,该风险概率也可以与医疗器械生产企业其他工作有机地结合起来,包括产品设计、技术改进、不良事件控制等。例如:医疗器械生产企业进行某项技术改进,如果反馈给技术人员的结果仅是合格或不合格,技术人员不知道目前技术改进的程度如何,还需要进行多大的改进。通过检验计数抽样检验工作得到确切的风险概率,技术人员根据风险概率目标值可以更有方向地设计进一步的改进方案。
7.4 计数抽样检验与评估违法风险的结合
在新法规下,产品不合格却流入市场的处罚极其严厉。但是任何产品都不能保证百分之百的合格,总会存在不合格的概率,即被可能被处罚的概率。企业应当进行技术改进以降低不合格的概率,但不计成本的投入是不现实的。上述计算风险概率的方法也同样适用于计算可能被处罚的概率。通过计算出不同方案的风险概率,企业可以评估出不同技术改进方案下的技术投入和被处罚的概率,从而有效地对比,选择出最优的技术改进方案。
8.讨论
本文构建的方法是针对现有计数抽样检验程序的修改,使医疗器械生产企业的检验工作能够反馈定性数据(批次是否合格)和反馈定量(不合格的风险概率),从而能够深度参与产品设计、技术改进、风险管理、不良事件管理工作。
但本文的方法仍存在一定不足,本文的方法未对计数抽样的抽样数量进行修改,由于GB/T 2828 系列标准和GB/T 2829 标准下的抽样方案的抽样数量普遍较少(大部分少于30),存在样本量不足的问题,样本可能并不符合正态分布,影响结果的准确性。但建立一个符合统计学要求的抽样数量又是不现实的,按照简单随机抽样的公式计算,抽样数量通常为一百到数千,医疗器械生产企业无法承担如此高的检验消耗。
最后,建议医疗器械行业主管部门和相关标准委员会根据医疗器械新法规的要求制定出适用于医疗器械行业的抽样检验标准。

来源:中国医疗器械信息


