您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-04 11:54
本文将结合《指导原则》及相关标准,详细的介绍其中的“加速老化试验”开展前试验方案的设计、试验实施详细步骤及最终试验结果的分析。
1、引言
有源医疗器械可实现对疾病的诊断、预防、监护和治疗,为了在临床使用中维持上述功能,医疗器械生产企业需确定产品的使用期限。在该期限内,要能够同时满足产品的安全使用和有效使用,即在使用期限内,有源医疗器械要同时满足安全要求和性能要求。
2019年5月份,《有源医疗器械使用期限注册技术审查指导原则》正式发布,为申报人员和审评人员提供了参考格式和关键信息等内容。不仅如此,指导原则也列出了相关的参考标准,以供申报和审评人员参考使用。2021年国家药品监督管理局发布第121号公告《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》,医疗器械注册申报资料要求及说明中指出“(七)、2.使用稳定性:如适用,应当提供使用稳定性/可靠性研究资料,证明在生产企业规定的使用期限/使用次数内,在正常使用、维护和校准(如适用)情况下,产品的性能功能满足使用要求。
以下将重点进行介绍,如何针对有源医疗器械进行使用有效期限的验证。
2、使用期限加速老化试验验证流程
《指导原则》明确指出,可以通过开展加速寿命试验来验证有效期限。加速寿命试验是在进行合理工程、统计假设及不改变产品故障模式和故障机理的基础上,利用与物理失效规律相关的统计模型对在超出正常应力水平的加速环境下获得的可靠性信息进行转换,得到试件在额定应力水平下可靠性特征的可复现的数值估计的一种试验方法[1]。《指导原则》特别强调了每个加速模型都有其适用范围,在选择相应的加速模型时要考虑其适用于试验应力的类型和试验对象[1]。开展加速寿命试验需确定以下相关参数:试验持续时间、样本数量、试验目的、要求的置信度、需求的精度、加速因子、实际使用环境、试验环境、加速因子计算、威布尔分布/指数分布等[1]。
根据《指导原则》的要求,正确开展加速寿命试验,需要包含以下步骤:
①.根据产品特点确定评价路径;
②.确定样品数量;
③.给定预期使用期限和置信度;
④.确定临床使用模式;
⑤.确定临床适用应力剖面;
⑥.确定应力大小;
⑦.选择失效模型;
⑧.根据文献资料确定模型中系数数值;
⑨.计算加速因子;
⑩.确定加速试验时间;
⑪.确定功能测试项目;
⑫.确定失效定义;
⑬.数据处理,失效分析。
此处将以上海某医疗器械公司某监测仪为例,按照上述步骤,介绍加速寿命试验的开展过程。
①.根据产品特点确定评价路径;
如功能单一,选择整机验证。
②.确定样品数量;
如整机10台或特定数量。
③.给定预期使用期限和置信度;(置信度取值可参照GB 5080.4-85,标准推荐90%,为了提高真值覆盖范围,建议使用95%或以上置信度)
如预期使用期限10年,置信度99%。
④.确定临床使用模式;
如某监测仪使用阶段有三种模式,分别为贮存模式、待机模式和工作模式。
⑤.确定临床使用应力剖面;
如考虑到某监测仪用于手术前对患者的监测,临床使用应力主要为温度和湿度。
参考温湿度:25℃,60%RH。
⑥.确定应力大小;
如贮存模式最高耐受温湿度:60℃,93%RH;待机模式最高耐受温湿度:55℃,85%RH ;工作模式最高耐受温湿度:45℃,85%RH;
⑦.选择失效模型;
根据临床使用应力剖面,参考GB/T 34986-2017中的温湿度应力试验加速模型:
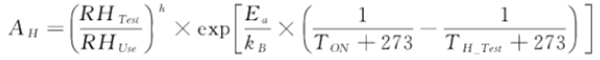
⑧.根据文献资料或试验分析确定模型中系数数值;
根据《Telcordia sr332 2016版电子产品可靠性预计标准》、《GB/T 34986-2017 产品加速试验方法等标准》,通过各温度、湿度环境下的极限破坏试验,确定产品的失效机理的一致性,从而计算出确定系数Ea及h取值,也可通过试验评估样品失效机理类型,根据不用的失效机理类型评估Ea(活化能)值范围。
⑨.计算加速因子;
根据不同临床应用不同模式,计算在各模式下的加速因子TAF:贮存/待机/作模式TAF值(设为TAF1/TAF2/TAF3);
⑩.确定加速试验时间;
若设备标称使用期限10年,临床使用频率和强度为每周使用7天,每天使用5小时,待机3小时,其余时间计入贮存时间。则产品贮存总时间为58448小时,待机总时间为10959小时,工作总时间为18265小时。根据GB/T 34986-2017《产品加速试验方法》的要求,设置试验裕度为10%。
贮存模式加速老化时间=
待机模式加速老化时间=
工作模式加速老化时间=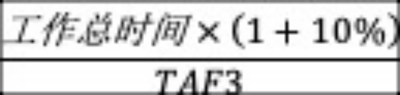
⑪.确定功能测试项目;
根据产品技术要求、产品专标,确定某测试范围和测试精度为基本性能测试项目,根据GB 9706.1-2020、GB/T 4793.1-2007,确定基本安全测试项目是否通过如接地电阻、漏电流、电介质强度、机械强度等。可在等效老化单位年限中进行中间试验,如发现不符合则可以通过定时截尾的数据处理方式,基于试验样品数量、样品试验时间等确定被试样品的使用期限。
⑫.确定失效定义;
当基本性能测试项目或基本安全测试项目中任意一项测试未通过时,判定整机失效。
⑬.数据处理,结合样本试验时间及样品失效数量进行统计分析(参照GB 5080.4-85、GB 4086.2-83、GB/T 5080.1-2012);
试验结束,共失效1台设备,进行概率统计分析,因使用期限为>0的正数,基于双边置信区间中,需关注单边置信区间的下限,经过统计分析计算出结果为“平均使用期限的单边置信下限为14.1年,置信度99%”。即有99%的概率,基于试验数据下的使用期限年限的下限值为14.1年。
3、结语
结合《指导原则》和《产品加速试验方法》及相关统计分析标准,能够使验证方案更加合理,验证过程更加严谨,条理清晰、关键信息更加完备。
加速寿命试验实际上是可靠性试验的一部分,可靠性试验在家电领域和汽车、军工领域已经开展的很成熟了。而作为要求本该更严格的医疗器械领域,可靠性试验却刚刚起步不久。提高医疗器械的可靠性,任重而道远。
参考文献:
[1] 国家药品监督管理局.关于发布有源医疗器械使用期限注册技术审查指导原则的通告(2019年第23号).[2019-05-14];
[2] 国家药品监督管理局.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号). [2021-09-30];
[3] GB/T 34986-2017《产品加速试验方法》;
[4] GB/T 5080.1-2012《可靠性试验第1部分:试验条件和统计检验原理》;
[5] GB 5080.4-1985 《设备可靠性试验 可靠性测定试验的点估计和区间估计方法(指数分布)》。

来源:Internet


