您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-06 20:06
摘 要 / Abstract
致癌性试验是药物非临床安全性评价的重要内容之一。当前国内外普遍采用并认可基于ICHS1B 指南建立的药物非临床致癌性试验替代方案。遗传修饰致癌性小鼠模型是替代方案中“卡脖子”的关键技术问题。从1997 年ICH S1B 指南发布至今,我国制药行业主要依赖进口获得小鼠模型,其价格高昂、进口周期长、条件严苛,且由于模型资源唯一,制药行业承受着成本高昂和供应链不稳的双重压力。本文概述了国内外致癌性试验相关指导原则,介绍了国内外主要的致癌性小鼠模型,包括Tg.rasH2、KI.C57-ras、p53+/- 小鼠等的构建、验证与应用历程,并展望了建立我国自主知识产权的致癌性小鼠模型以及标准化生产供应的途径。
The assessment of carcinogenicity is a pivotal element in the preclinical safety evaluation of pharmaceuticals. The alternative approach to non-clinical carcinogenicity assessment, as outlined in the ICH S1B guidelines, is widely endorsed both domestically and internationally. However, the development of genetically modified mouse models for carcinogenicity poses significant technical challenges within this alternative approach. Since the issued of the ICH S1B guidelines in 1997, China's pharmaceutical industry has heavily relied on costly and lengthy imports from overseas, which are subject to stringent conditions. Moreover, due to monopolied resources being controlled by Western countries, the pharmaceutical industry faces mounting pressure from high costs and unstable supply chains. This article outlines relevant guidelines for carcinogenicity evaluation at home and abroad, introduces the global development, validation, and application history of major carcinogenicity mouse models such as Tg.rasH2, KI.C57-ras V2.0, p53+/- mice; it also looks ahead to establishing independent intellectual property rights for domestically produced carcinogenicity mouse models while standardizing their production and supply.
关 键 词 / Key words
药物致癌性试验;致癌性小鼠模型;指导原则;遗传修饰动物模型
pharmaceutical carcinogenicity test; carcinogenicity mouse model; guidelines; genetically modified animal models
致癌性试验是药物非临床安全性评价中的重要内容, 也是药物毒理学研究中的重要评价指标, 旨在考察药物在动物体内的潜在致癌作用, 从而评价和预测其可能对人体造成的危害。国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)发布的《S1A :药物致癌性试验必要性指导原则》(Guideline on the Need for Carcinogenicity Studies of Pharmaceuticals S1A)指出, 临床预期用药6 个月以上(含6 个月)或治疗慢性复发性疾病而需间歇使用的药物以致总暴露量与前者相似的药物均需进行致癌性试验[1]。传统的致癌性试验方法框架是通过为期2 年的大鼠和小鼠的致癌性试验完成的。20 世纪90 年代开始, 欧盟、美国等国家和地区开展了遗传修饰动物模型的短期致癌性试验方法的研究。1997 年, ICH 发布了《S1B :药物致癌性试验》(Testing for Carcinogenicity of Pharmaceuticals S1B)[2],建议药物临床前致癌性试验采用遗传修饰动物模型开展试验,该指导原则中新药潜在致癌性评价改为一项大鼠长期致癌性试验加上一项短期或中期体内试验,使用的模型包括啮齿类引发- 促进模型、遗传修饰小鼠模型和新生啮齿类动物致肿瘤模型,以缩短试验周期,减少动物用量并降低费用。2010 年,我国发布实施《药物致癌试验必要性的技术指导原则》,鼓励国内制药企业开展新药的短期致癌性评价试验[3]。
ICH S1B 指导原则中的遗传修饰小鼠模型一般指Tg.rasH2 转基因小鼠模型、p53+/- 基因敲除小鼠模型、Tg.AC 转基因小鼠模型及Xpa-/-基因敲除小鼠模型[4-5],其构建的方法为传统的转基因技术(例如Tg.rasH2 转基因小鼠)或干细胞打靶法(例如p53+/- 基因敲除小鼠),但研究人员逐渐发现传统转基因技术存在着不足。随着基因编辑技术的发展[6],研究人员利用新型打靶技术构建了多种抑癌基因敲除或原癌基因激活的致癌性小鼠模型。这些新型遗传修饰小鼠模型与传统小鼠模型相比,具有动物用量少、试验周期短、费用低、特异性及敏感性高等多重优势,为推动新药研发提供了更实用的模型工具[7]。
本文从新药临床前致癌性试验方法进展、国内外致癌性试验相关指导原则的发布及现有致癌性小鼠模型的建立等3 个方面概述了遗传修饰动物模型在致癌性试验中的应用,以探索建立我国自主知识产权的致癌性小鼠模型的途径。
1、新药临床前致癌性试验方法进展
近年来,新药致癌性试验技术方法不断更新和完善。致癌性试验主要包括体外试验、体内试验和流行病学调查等方面。体内试验是药物毒理学评价的重要环节,尤其是动物模型的优化和新型动物模型的建立,为致癌性试验方法发展提供了更科学的技术工具[8]。致癌性试验经历了2 年期大鼠和小鼠致癌性试验和2 年期大鼠和6 个月小鼠模型替代致癌性试验2 个发展阶段。2 年期致癌性试验通常选用两种啮齿类动物(大鼠和小鼠)进行评价,被视为致癌性试验的“ 黄金标准”。在该致癌性试验的分析中,国际癌症研究机构(International Agency for Research on Cancer)和美国国家毒理学计划(National Toxicology Program) 都得出结论, 啮齿类动物2 年期的致癌性试验结果与人类真实致癌反应高度一致[9-10]。虽然也存在局限性[11-12], 但美国食品药品监督管理局(Food and Drug Administration,FDA)、美国环境保护局(Environmental Protection Agency,EPA) 和全球其他国家和地区的相关监管机构均接受了2 年期致癌性试验数据,进一步考虑到致癌性试验持续时间长、成本高的客观现实,通常建议在Ⅰ期和Ⅱ期临床试验完成后进行致癌性风险评价。6个月替代致癌性试验是1997 年ICH S1B 指导原则中正式提出的新评价框架,即选用一种常规啮齿类动物(大鼠)和一种啮齿类动物替代模型(多指致癌性遗传修饰小鼠模型)进行致癌性试验,同时强调使用证据权重(weight of evidence,WoE) 对药物的致癌性信息和试验结果进行总体风险评估[2]。其中选用的小鼠替代模型是在20 世纪80 年代~90年代由多个国家和地区的科学家们构建并联合验证的、针对不同致癌基因或抑癌基因编辑产生的转基因或基因敲除小鼠模型。近年来,短期致癌性试验方法成为美国、日本、欧盟等国家和地区的药品监管机构普遍认可并接受的新药申报方法[13]。
替代性毒理学新技术在一定范围内兴起和发展,包括体外方法、计算机模拟、毒理基因组学等,尤其是器官芯片技术的快速发展促进了非遗传毒性药物的致癌性预测和致癌机制研究[14-15]。虽然,多个国家和地区的药品监管机构已认识到毒理基因组学在药物研发中的重要性,但如何准确评价器官芯片的性能、推动其从药物研发到注册及监管的应用仍面临诸多问题[16]。
可以预计,未来研究人员将会继续关注和发展新的致癌性试验替代方法,但基于体内试验评价新药潜在致癌性风险还是必要的。
2、国内外致癌性试验相关指导原则的建立
2.1 国外致癌性试验相关指导原则
全球多个国家和地区的药品监管机构和组织,包括ICH、FDA、EMA 等已经制定并实施了致癌性试验指导原则, 已形成了成熟的致癌性试验评价体系。1995 年,ICH 陆续推出了S1A、S1B、S1C 系列技术指导原则。随后,FDA 发布了《啮齿类动物致癌性试验设计和结果分析的统计学考虑》(Statistical Aspects of the Design, Analysis, and Interpretation of Chronic Rodent Carcinogenicity Studies of Pharmaceuticals) 及《致癌性试验设计方案的提交》(Carcinogenicity Study Protocol Submissions)等技术指导原则。FDA 发布的《神经毒性研究红皮书》(Redbook 2000: IV.C.10.Neurotoxicity Studies)作为实用性很强的指导方针, 以草案形式提供了关于设计和开展致癌性评价的具体方法。不过,《神经毒性研究红皮书》中提供的研究设计被认为是最基本的设计, 实用性略欠缺。EMA 发布的《人类胰岛素类似物致癌潜力的非临床评估科学指南》(Non-Clinical Assessment of the Carcinogenic Potential of Human Insulin Analogues – Scientific Guideline)、《CHMP SWP 关于使用转基因动物模型开展致癌性试验的结论和建议科学指南》(CHMP SWP Conclusions and Recommendations on the Use of Genetically Modified Animal Models for Carcinogenicity Assessment -Scientific Guideline)、《治疗HI V感染的药品致癌性评价指南》(Carcinogenicity Evaluation of Medicinal Products for the Treatment of HIV Infection -Scientific Guideline)指导原则中也提出了药物潜在致癌性试验的注解。这些致癌性试验指导原则内容涵盖了致癌性试验设计、开展的必要性、数据统计学分析、考虑要点、剂量选择等方面。2022 年,ICH 再次发布了《S1B(R1):药物致癌性试验》[Testing for Carcinogenicity of Pharmaceuticals S1B (R1)] 附录,该指导原则再次强调了3R 原则(the rules of 3R),提出了WoE方法评估2 年期大鼠的致癌性试验的价值,但该指导原则仍推荐开展小鼠致癌性试验,可见遗传修饰的致癌性小鼠模型的应用价值。S1B(R1)指导原则附录的发布,既减少了动物的使用,将资源集中到更加科学的、基于机制的致癌性试验上,同时持续推进创新药安全并合乎伦理的研发。
2.2 我国致癌性试验相关指导原则
我国在药物致癌性试验领域起步较晚,近些年先后也发布了一系列的法规和指导原则,已经初步搭建了致癌性试验管理体系。2005 年版《药品注册管理办法》附件中规定预期临床连续用药6个月以上或需经常间歇使用的药物必须提供致癌性试验资料,并指出了进行致癌性试验的多个考虑因素。2007 年,《治疗用生物制品非临床安全性技术审评一般原则》发布,阐述了相关产品致癌性试验的要求。2009 年, 原国家食品药品监督管理局药品审评中心组织毒理专家、企业及研究单位代表召开了制定“药物致癌试验必要性技术指导原则”专题讨论会,会上基本认同了ICHS1A 中内容的适用性,并结合我国国情进行了调整,《药物致癌试验必要性的技术指导原则》于2010 年4 月1 日发布。该指导原则旨在阐明在何种情况下需要进行药物致癌性试验,以及进行致癌性试验的考虑因素和致癌性试验的时间安排等。该指导原则的发布意味着我国开展新药致癌性试验的工作进入新阶段。
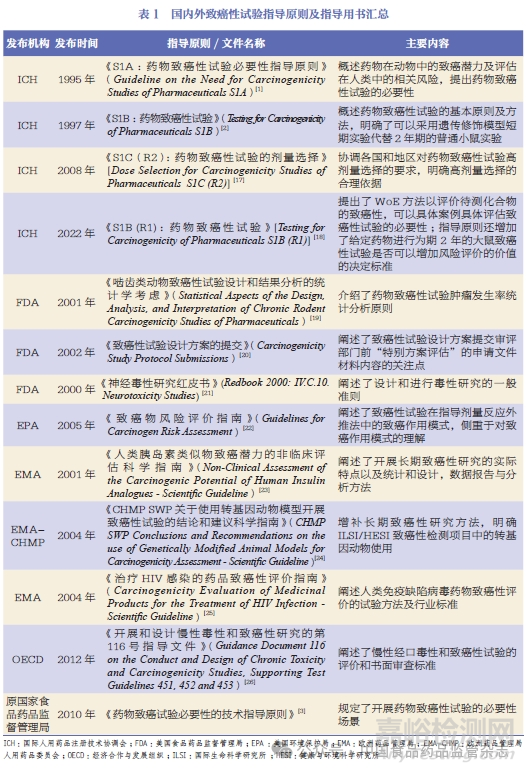
2017 年6 月,原国家食品药品监督管理总局成为ICH 成员,进一步强调药品科学监管与国际接轨,随后专门成立了ICH 工作办公室,主要负责ICH 指导原则的转化实施。目前,国家药品监管部门陆续发布多项ICH 指导原则及其中文译稿,我国开始全面实施ICH 指导原则。2019 年,《S1A :药物致癌性试验必要性指导原则》发布,成为第一个转化的指导原则。2022 年,国家药品监督管理局药品审评中心发布了《关于公开征求ICH〈S1B(R1):致癌性研究〉实施建议和中文版的通知》,持续推动新修订的ICH 致癌性试验指导原则在我国实施。综上,本文对国内外致癌性试验指导原则及指导用书进行了总结,见表1。
3、国内外致癌性试验用遗传修饰动物模型
遗传修饰动物模型是建立药物致癌性试验替代方法的关键技术,对我国制药企业而言,也是一项“卡脖子”的技术。为此,本文将重点介绍国内外代表性遗传修饰动物模型的构建历程、各自优缺点以及真实世界研究的应用,并对我国自主知识产权的致癌性小鼠模型的构建进行了讨论。
3.1 国外遗传修饰动物模型
20 世纪80 年代出现了转基因技术,自此,通过基因编辑技术建立的遗传修饰大小鼠模型广泛用于各个领域,包括潜在致癌性试验。常见的遗传修饰小鼠模型包括Tg.rasH2 转基因小鼠模型、p53+/- 基因敲除小鼠模型、Tg.AC 转基因小鼠模型以及Xpa-/-基因敲除小鼠模型。
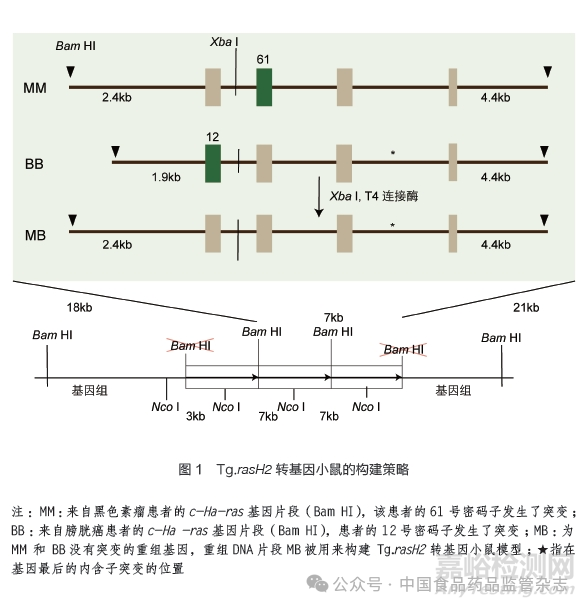
为验证4 种替代小鼠模型的准确性和灵敏性,1996~2001年国际生命科学研究所(International Life Sciences Institute,ILSI) 和健康与环境科学研究所(Health and Environmental Sciences Institute,HESI)协调美国、欧盟和日本等国家和地区的50 多家制药企业、政府部门和学术机构实验室开展了小鼠模型的系统评估工作,耗费近3500 万美元。通过标准化评定实验方案,实现了跨多个实验室获得的数据的可重复性和可比性[27]。其间,共完成了包含N-甲基-N-亚硝基脲(MNU)、p-3-氨基对甲苯甲醚、12-O-十四烷酰佛波醋酸酯-13等 21 个已知致癌受试物的致癌性实验,虽然有个别实验的结果不确定,但最终认为Tg.rasH2 转基因小鼠模型和杂合p53+/- 基因敲除小鼠模型可用于短期致癌性试验评价,Tg.AC 转基因小鼠模型和纯合Xpa-/- 基因敲除小鼠模型存在一定的试验评价风险[28-29]。本文对国外常见的4 种小鼠模型的特性进行了比较,见表2。在2010 年后提交给FDA 的新药申报中,未见采用杂合p53+/- 基因敲除小鼠模型用于致癌性试验评价,目前使用最为广泛的模型是Tg.rasH2 转基因小鼠模型,故本文对Tg.rasH2 转基因小鼠模型进行了重点介绍。
3.1.1 Tg.AC 转基因小鼠模型
Tg.AC 转基因小鼠模型是美国科学家Leder 等人在1990年构建,采用原核注射的方法将活化的人源v-Ha-ras 基因导入到FVB/N 小鼠品系中产生,该小鼠模型最显著的特征是在表皮磨损区域或诱导后短期内会出现乳头状瘤, 曾用于经皮给药药物致癌性试验的替代模型[30-33]。ILSI/HESI 项目中早期使用纯合子Tg.AC 转基因小鼠, 后期则使用杂合子Tg.AC 转基因小鼠。Tg.AC 转基因小鼠模型的构建,是将珠蛋白启动子与v-Ha-ras 基因连接,通过传统转基因技术将重组DNA 随机整合进入小鼠基因组。转基因技术的天生不足可能会导致转基因遗传不稳定,基因可能会丢失,从而导致该小鼠对致癌物不敏感,不能较好地反映已知人类阳性致癌物的致癌性。早期Tg.AC 转基因小鼠模型可用于局部给药和用于人类局部使用的化合物的致癌性试验,由于其准确性和敏感性方面缺陷,目前为其他模型取代,FDA 不再推荐使用这种模型 [34]。
3.1.2 Xpa-/- 基因敲除小鼠模型
Xpa-/- 基因敲除小鼠模型是美国科学家在1995 年构建,采用胚胎干细胞(embryonic stemcell,ES)打靶技术将小鼠Xpa基因的3–4 号外显子敲除,从而获得Xpa 基因敲除小鼠。Xpa-/-基因敲除小鼠易受紫外线诱导产生皮肤和眼部肿瘤,并可在二羟甲基丁酸化学诱导后发生皮肤肿瘤[35]。ILSI/HESI 项目中关于Xpa-/- 基因敲除小鼠模型数据较少,仅有13/21 个化合物采用该模型评价,且无重复试验,特别是3 个人类遗传毒性致癌物中的2 个化合物美法仑和环磷酰胺均未采用该模型进行评价,故尚无法对该模型的价值作出最终判断,纯合Xpa-/- 基因敲除小鼠与癌症易感性增加最相关的是全基因组修复缺陷,而不是转录偶联修复(transcription-coupled repair,TCR)缺陷。纯合Xpa-/- 基因敲除小鼠存在TCR 介导的活性转录基因中基因毒性损伤缺陷,从而导致对化合物的敏感性增强,产生假阳性结果,故不推荐使用[34]。
3.1.3 p53+/- 基因敲除小鼠模型
p53+/- 基因敲除小鼠模型是美国科学家在1992 年构建[36],采用ES 打靶技术敲除小鼠p53抑癌基因的5 号外显子,通过显微注射将重组ES 送入129 受体鼠的囊胚胚泡中,并将胚泡植入假孕的 F1(C57BL/6.CBA)雌性小鼠体内,产生嵌合型小鼠。嵌合体多表现为129 ES 遗传特性,随后将嵌合体雄性与 C57BL/ 6雌性小鼠交配。在第四代回交后,约有6% 的 129 品系等位基因被保留下来,故准确名称应表示为B6.129-Trp53(N4)[37]。后续实验发现,该模型对遗传毒性致癌物敏感,仅可用于遗传毒性药物潜在致癌性试验[28,38],后续使用逐渐减少。
3.1.4 Tg.rasH2 转基因小鼠模型
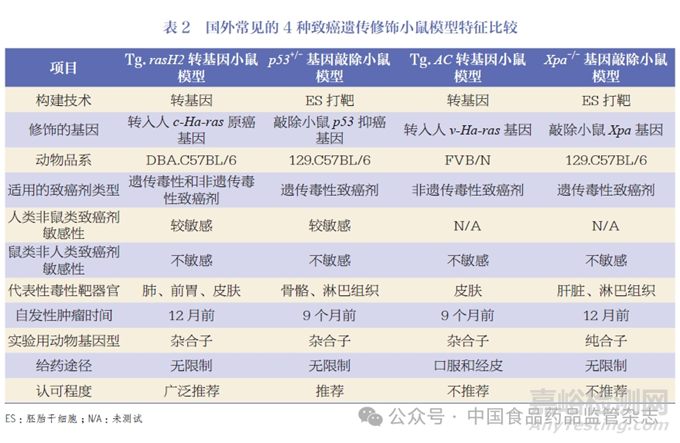
Tg.rasH2 转基因小鼠模型是由日本科学家在1990 年通过转基因方法将人原癌基因c-Ha-ras基因转入小鼠筛选获得,该转入基因是通过将膀胱癌和黑色素瘤患者激活突变的c-Ha-ras 进行重组连接获得, 仅最后一个内含子有突变, 保留c-Ha-ras 基因内源性启动子和增强子, 如图1 所示[39-41]。
另外, 该模型是在DBA/2 和C57BL/6J 小鼠品系的杂交胚中进行转基因操作,产生并获得了8 只首建鼠,其中2 只存活。初步比较后,最终选择其中2 系作为模型的首建鼠,并将首建鼠与C57BL/6J 品系进行超过10 代的回交,使其与C57BL/6J 回交纯度达到99.5%后开始大规模生产,目前使用的为C57BL/6J 品系的Tg.rasH2转基因小鼠模型[42-44]。通过聚合酶链式反应(polymerase chain reaction,PCR)方法证实,该模型一共转入3 个拷贝基因,并在15 号染色体E3 区以首尾串联方式排列[45]。为降低自发肿瘤发生率,实际致癌性试验使用的是Tg.rasH2转基因小鼠与BALB/cByJ 小鼠的杂交一代,命名为CB6F1 杂合小鼠。Tg.rasH2 转基因小鼠和非转基因同窝小鼠的生长曲线,如图2 所示, 其中雄性Tg.rasH2转基因小鼠的绝对体重为野生的80%, 雌性Tg.rasH2 转基因小鼠的绝对体重为野生的 90%,但脏体比与野生型相似[46]。
值得一提的是,Tg.rasH2 转基因小鼠模型是随机插入方式构建,插入到E3 位点、插入3 个拷贝、呈首尾串联方式排列,均是在生物体内自发发生的随机事件。但这些因素均会影响转基因的表达和模型稳定性,对后续该小鼠模型致癌性表型起到了不可忽视的决定性作用。再次重复这个转基因过程,很难重现同一结果。
本文对 12 项 ILSI 替代致癌性测试(ACT)研究项目在 26周用药期(32 周龄小鼠)内观察到的自发性肿瘤发病率和发病时间情况进行了汇总,见表3。在多数情况下,常见自发性肿瘤的发生率略高于 1.0%[47]。2012 年,美国辉瑞公司等3 家公司根据内部数据和出版文献等资料整理了Tg.rasH2 转基因小鼠自发性肿瘤发生率。自发性肿瘤发生率大于1.0% 的常见肿瘤中,细支气管肺泡腺瘤(平均3.9%~9.9%,范围0.0%~18%)、细支气管肺泡腺癌( 平均1.4%~2.4%, 范围0.0%~5.0%), 脾脏血管肉瘤( 平均3.0%~ 3.9%, 范围0.0%~17.0%), 皮肤鳞状细胞乳头状瘤( 平均1.1%~1.2%,范围0.0%~ 4.0%)、哈德腺腺瘤( 平均0.8%~1.2%, 范围0.0%~4.0%) 和肝细胞腺瘤( 平均1.8%, 仅雄鼠为0.0%~9.0%)[48]。总之, 该自发性肿瘤发生率在可以接受的范围内,但也应注意,不同实验室获得的数据存在差异,甚至波动很大。此外,应注意不同实验室间自发性肿瘤计算方法的差别,比较严格的方法是,不分肿瘤类型,只要有一只小鼠发生任何一种自发性肿瘤,均记为阳性。

阳性致癌物证实了Tg.rasH2转基因小鼠对遗传毒性和非遗传毒性的人类致癌物是敏感的,能识别广谱致癌物。根据传统2 年期的啮齿类动物的生物试验数据,在对于27 种化学品进行的26 周分析研究中,Tg.rasH2 转基因小鼠模型准确预测了约80% 化学品的致癌反应。以MNU(75mg/kg,腹腔注射) 作为阳性对照物(MNU 是最常用的阳性致癌物),Tg.rasH2 转基因小鼠对阳性致癌物比同窝野生型小鼠更敏感的靶器官包括血液系统、胸腺、前胃和皮肤[46,49-50]。近几年,Tg.rasH2 转基因小鼠的研究趋于细化,多数研究集中在其背景肿瘤的研究,以期增加该小鼠模型的背景数据库,提升试验的准确性。根据美国辉瑞公司2004 年3 月和2009 年7 月在GLP 条件下进行的10 项雄鼠和11 项雌鼠为期6 个月致癌性研究,研究结果结合其他研究和文献报道,较全面汇总了Tg.rasH2 转基因小鼠的肿瘤谱及发生率,见表4。

3.2 我国遗传修饰动物模型
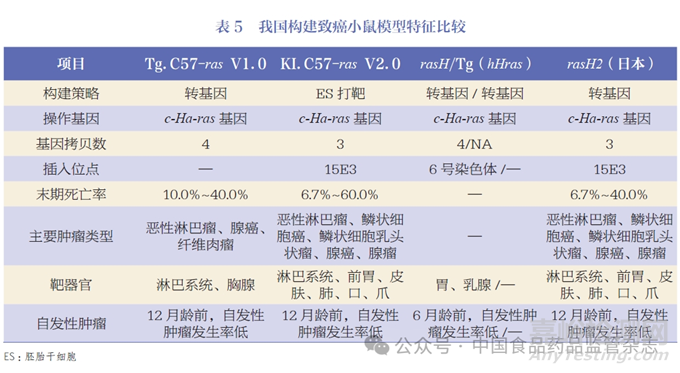
目前, 我国通过GLP 认证的药物非临床安全性评价研究机构已70 多家,建立了较为系统和完善的药物临床前安全性评价体系,但临床前药物致癌性试验体系的建立尚滞后于国外,缺乏我国自主知识产权的致癌性小鼠模型。从2004 年开始,中国食品药品检定研究院(以下简称中检院)启动了我国自主知识产权的致癌性小鼠模型研究,先后研发了基于传统转基因技术构建的Tg.C57- ras V1.0 版和先进干细胞打靶技术构建的KI.C57- rasV2.0 版两代致癌性小鼠模型,均已获得专利授权,并在国内较广泛地使用。由于起步工作基础薄弱,研发过程曲折,且研究经费需求巨大,项目整体进展未达到预期,研发经历了长达数十年。本文将简述中检院两代致癌性小鼠模型构建历程,总结得与失,并提出建立我国自主知识产权的致癌性小鼠模型需要着重考虑的要点,以期为后续研究人员研发提供参考。
3.2.1 中检院一代致癌性Tg.C57-ras V1.0 小鼠模型
中检院一代致癌性小鼠模型采用与日本Tg.rasH2 转基因小鼠模型相同的转基因方法构建,命名为Tg.C57-ras V1.0,转入的人原癌基因c-Ha-ras 含有4 个外显子、自身启动子、调控序列和poly A 信号序列[51]。经原核注射,转基因整合率为1.6%,获6 只首建鼠,其中3 只成活,最终选择首建鼠3 进行保种繁殖,后续实验证明,其转基因能稳定遗传[52]。插入基因拷贝数经荧光定量PCR方法测定,拷贝数为4[53],但整合位点未确定。
通过测定Tg.C57-ras V1.0小鼠的22 项血液生理指标和12项血液生化指标,比较雌性转基因阳性鼠和阴性鼠发现,嗜中性粒细胞(NEUT)、嗜中性粒细胞百分比(NEUT%)差异显著(P<0.05) ,血小板压积(PCT)差异极显著( P<0.01),其余19项无显著性差异(P>0.05)。雌性阳性鼠和阴性鼠的12 项生化指标均差异不显著(P>0.05);雄性小鼠丙氨酸氨基转移酶(ALT)、甘油三酯(TG) 差异显著(P<0.05),其余10 项差异不显著(P>0.05)[54-56]。
给予Tg.C57-ras V1.0 小鼠阳性致癌物(MNU,75mg/kg),雌性Tg.C57-ras V1.0 小鼠恶性淋巴瘤的发生率为14%,比相关文献报道略低,未观察到皮肤及前胃乳头状瘤等特征肿瘤的发生[57],雌性Tg.C57-ras V1.0 小鼠乳腺腺瘤的发生率为6%,但是雄性Tg.C57-ras V1.0 小鼠发生直肠纤维肉瘤,未见相关文献报道。
结合后续数量更大且多单位使用结果显示, 一代致癌性Tg.C57-ras V1.0 小鼠较同窝野生型敏感,遗传稳定性好,质量可靠。目前,累计向市场提供近1500 只,用于硝酸镧、纳米银新型材料的潜在致癌性试验,并支持国家科技重大专项项目完成,推动了我国基于转基因小鼠模型的致癌性试验替代方法的建立[58-59]。
通过对不同单位的5 个致癌性试验时间综合分析及文献对比发现, 一代致癌性Tg.C57-ras V1.0 小鼠模型存在较突出的不足,主要表现为敏感性较日本Tg.rasH2 转基因小鼠低,尚不能完全达到文献报道的国际同类模型的效果。这可能是由于转基因技术本身的局限性或其他原因带来的,故在2017 年前后,中检院停止了一代致癌性Tg.C57-ras V1.0 小鼠模型的生产供应,并同步启动更加先进的第二代致癌性小鼠模型的研制。
基于多年的探索,虽然一代致癌性Tg.C57-ras V1.0 小鼠模型存在局限,但为研究人员在致癌性小鼠模型研究中积累了丰富的数据和经验,为二代小鼠模型的遗传设计、生物学特性鉴定、生产体系及资源保存体系的建立以及规模化联合验证思路的形成奠定了基础。同时,也提示了研究人员基于常规转基因技术构建的遗传修饰小鼠模型较难达到预期效果。
3.2.2 中检院二代致癌性KI.C57-ras V2.0 小鼠模型
基于遗传学原理及遗传修饰小鼠模型的自身特点,研究人员认为遗传修饰动物模型的表型受5 方面因素影响:转基因、转基因拷贝数、基因排列顺序、插入位点以及小鼠遗传背景,要想获得符合预期的表型,上述因素均需要考虑。中检院二代致癌性小鼠模型,是在总结一代致癌性小鼠模型经验与不足的基础上,充分考虑上述影响因素后而设计的。鉴于常规转基因技术存在局限,二代致癌性小鼠采用了全新的ES打靶大片段定点整合技术。
中检院二代致癌性KI.C57-ras V2.0 小鼠模型, 是将3 个拷贝的人源c-Ha-ras 全长基因组DNA 首尾串联, 精准插入C57BL/6J 小鼠15 号染色体E3位点(15E3) ,经过多重筛选而得,其基因结构图如图3 所示。插入的DNA 全长片段约为21 kb,由于该原癌基因鸟嘌呤和胞嘧啶所占的比率(GC)偏高,且含有重复序列,要实现定点整合的操作难度很大,构建需花费较长时间。二代致癌性小鼠模型名称中,“KI” 是“Knock-in” 的缩写,意指定点插入,与一代致癌性小鼠模型表示转基因的“Tg”(transgenic)不同,转基因一般为随机插入,容易导致基因丢失,遗传不稳定;“C57” 表明其遗传背景,即直接采用C57BL/6JES 进行编辑,无需漫长回交直接获得纯C57BL/6J 背景的模型;“ras”意指插入的基因为人源原癌基因c-Ha-ras,不包含突变位点;二代致癌性小鼠模型具有明显的优势,即遗传稳定、个体间均一,结果一致性更好。实际表型验证数据结果也表明,二代致癌性小鼠模型敏感、遗传稳定、表型优良,为构建我国自主知识产权的致癌性小鼠模型奠定了基础。二代致癌性KI.C57-rasV2.0 小鼠模型较中检院一代致癌性Tg.C57-ras V1.0 小鼠模型及Tg.rasH2 转基因小鼠具有优势,这得益于其采用了先进的ES 打靶技术,实现定点整合。

测定二代致癌性KI.C57-ras V2.0 小鼠模型的22 项血液生理指标和9 项血液生化指标结果显示,转基因阳性雌鼠、雄鼠和同窝阴性雌鼠、雄鼠相比各项指标没有差异,均在正常值范围内;9项血液生化指标也无差异。这意味着二代致癌性小鼠模型血液生理生化指标背景清晰干净,有利于在药物安全评价中的应用。
经过给予MNU 致癌物验证,结果提示二代致癌性KI.C57-ras V2.0 小鼠模型能形成淋巴瘤、鳞状细胞癌、鳞状细胞乳头状瘤、腺癌、腺瘤等肿瘤。值得注意的是,在特征性靶器官例如前胃和皮肤,能观察到典型肿瘤类型,包括鳞状细胞乳头状瘤和鳞状细胞癌,且比例明显高于野生型小鼠,组织病理学特征分析结果也与相关文献报道特征一致。另外,给予MNU 后,小鼠首次死亡时间、期末生存率及肿瘤发生率及关键特征靶器官与同窝阴性小鼠有明显差异。通过对50 只小鼠为期6个月的自发性肿瘤观察,发现仅1 只小鼠在6 个月内出现了脾淋巴瘤,表明自发性肿瘤发生率低,但目前尚缺少大规模观察数据。
自二代致癌性KI.C57-ras V2.0 小鼠模型研发成功以来,得到业界广泛关注。2020 年9 月,在北京召开了人源化小鼠模型研究进展研讨会,会上专家、学者听取了致癌性模型的构建过程及验证结果,并一致支持推动这一具有自主知识产权且弥补国内短板的模型动物的国产化[60]。截至目前,中检院已经向我国10余家制药企业提供了二代致癌性KI.C57-ras V2.0 小鼠模型, 用于新药评价、致癌性试验平台建设及食品添加剂、医疗器械、生物大分子的潜在致癌性试验。在获得国家药品监督管理局GLP 认证的20 家机构中,有7 家使用过二代致癌性KI.C57-ras V2.0小鼠模型。通过对已经完成致癌性试验机构的数据进行分析表明,在给予MNU 后二代致癌性KI.C57-ras V2.0 小鼠模型的首次死亡时间,期中和期末生存率、肿瘤发生率(100%)、肿瘤谱(肿瘤类型)及关键特征靶器官比较一致,表明该模型不仅较同窝阴性小鼠具有更高的致癌敏感性,可重复性好,且与ILSI 的ACT研究项目中所涉及的日本致癌模型的 MNU 诱导后产生的致癌实验评价指标相同或接近,但数据量有待进一步充实。这些已有数据表明,二代致癌性KI.C57-ras V2.0 小鼠模型较一代质量大幅度提升,对致癌物敏感,具备作为标准动物模型用于药物临床前致癌性试验的潜力。
3.2.3 其他致癌模型
我国多家相关企业或机构也研发了同类致癌性小鼠模型。据公开资料显示,北京维通达生物技术有限公司构建的CB6F1-Tg(HRAS)9/Vst 小鼠( 以下简称rasH 小鼠)采用转基因方法构建[61],转入基因包含人原癌基因的编码序列、内含子以及上下游非编码区的染色体DNA 片段。将DNA 片段注射到C57BL/6N小鼠受精卵的原核内,获得转基因阳性首建鼠,分别扩繁建系,进行表型分析,从中筛选符合致癌性试验的第9 个系保留。用数字定量PCR 法确定该小鼠串联转基因拷贝数4 个,用染色体步移法确定转基因串联片段,并整合于小鼠第6 号染色体上。利用免疫印迹法进行检测,结果显示HRAS 在小鼠前胃和肺中具有较高的表达量。江苏集萃药康生物科技股份有限公司采用了转基因技术,将人原癌基因Hras 进行基因改造后,连同内源性启动子和增强子转入B6 小鼠体内,命名为B6J-Tg(hHRAS)16/Gpt转基因小鼠,即Tg(hHras) [62]。本文根据公开数据对上述几种小鼠模型进行了特征比较,见表5。
4、药物致癌性试验替代方法的建立
4.1 药物致癌性试验替代方法建立的必要性
目前,国内外均广泛采用并接纳ICH S1B 致癌性试验设计框架,采用2 年期大鼠试验加上6个月遗传修饰动物试验的评价已经成为支撑新药申报的主流数据。致癌性小鼠试验因其实验周期短、结果准确可靠、受自发性肿瘤干扰小的突出优势,越来越受到制药行业的重视[63]。
自“ 十三五” 以来, 我国着眼从制药大国向制药强国迈进。据《自然》(Nature) 杂志发表的评述文章[64], 近年来,我国创新药首次新药临床试验(investigational new drug,IND) 申请的数量急剧增加。2010~2020 年, 国家药品监管部门共收到了1636 件创新药的首次IND 申请,86% 来自国内的制药企业。2023 年, 我国Ⅰ类新药申请1310 件,同比增加近34%。其中,中药60 件,同比增加33% ;创新化学药品626件,同比增加35% ;创新生物制品624 件, 同比增加32%。不难看出,我国创新药在迅速发展,而新药的临床前致癌性试验需求必然随之提升。
然而,目前致癌性试验小鼠资源来源唯一,且该模型进口成本逐年上涨,由于致癌性试验单次动物用量大,购买动物的成本占比不容小觑。此外,供应链问题还会受到其他因素的影响,制约了我国制药企业的发展。我国制药企业十分期待质优价廉国产致癌性小鼠模型。
4.2 中检院建立致癌性试验替代小鼠模型的历程
2004 年开始,中检院开始组建遗传修饰动物模型平台,随即开启自主知识产权的致癌性小鼠模型研究。如前所述,先后研发了一代致癌性Tg.C57-ras V1.0小鼠模型和二代致癌性KI.C57-ras V2.0 小鼠模型,分析了模型的生物学特性,建立了胚胎冷冻及精子冷冻资源保存方法和规模化生产及供应技术,组织开展了多批次验证实验,并发表了一系列成果论文,获得了多项专利授权,还先后向相关企业提供大批模型动物,为推动我国致癌性试验替代方法的建立发挥了主力作用。
4.3 建立我国致癌性小鼠模型的几点思考
质量可靠、经过充分验证且能稳定批量供应的致癌性小鼠模型是建立我国致癌性试验替代方法的关键技术。第一,致癌性小鼠须具备清晰的遗传背景,从打靶载体设计到完成构建,均需充分论证。第二,要对其生物学特性进行充分细致地分析,阐明转基因拷贝数、整合位点、序列等特征。第三,需要充分验证致癌性小鼠模型的敏感性和准确性,必要时可开展多中心联合验证,并建立质量标准[65-67]。第四,建立对种质资源进行胚胎和精子冷冻保存,以确保模型供应的一致性。第五,需要建立稳定的批量生产体系和质控体系(图4)。第六,需要关注致癌性小鼠模型的自发性肿瘤发生率、生理生化参数背景数据,以保障小鼠模型质量。
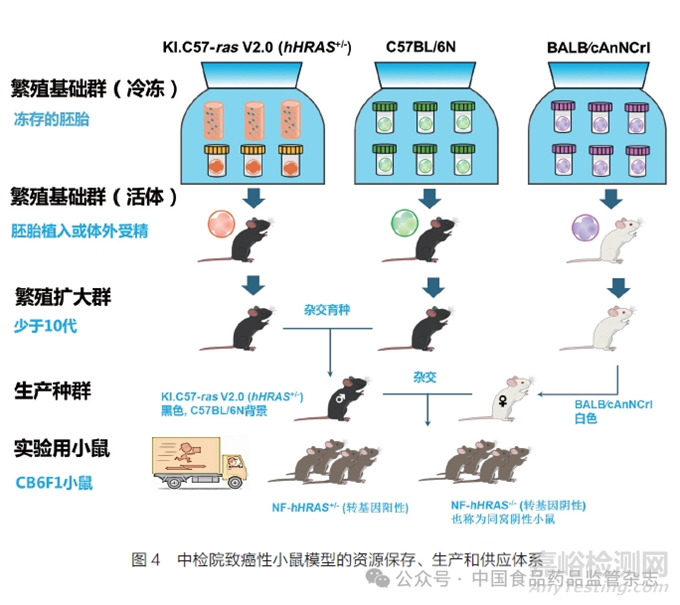
4.4 我国自建致癌性小鼠模型与国际致癌性小鼠模型的关系
国际上Tg.rasH2 转基因小鼠的构建大体上经历了模型构建与生物学特性研究、多实验室联合验证、专家讨论认可3 个阶段。联合验证是关键环节,旨在证明转基因阳性小鼠较同窝野生型小鼠易感,证明小鼠模型的准确性与灵敏度。我国自建致癌性小鼠图4 中检院致癌性小鼠模型的资源保存、生产和供应体系模型同样离不开上述环节,但由于目前研究人员已积累了大量背景数据,充分认可基于遗传修饰动物模型开展致癌性试验结果,故无需像Tg.rasH2 转基因小鼠模型,开展几十种致癌物的验证实验。只需在遗传基础清晰前提下,开展充足数量的验证,证明自建模型的可靠性即可。但需要考虑,我国自建的致癌性小鼠模型的表型需要与Tg.rasH2 转基因小鼠比较,因为肿瘤发生本身是一个复杂的过程,受模型动物的影响,同样受致癌性试验和统计学方法的影响。
综上,从支持我国新药研发角度出发,建立具有我国自主知识产权的致癌性小鼠模型是必要而紧迫的。建立模型,需充分研究其生物学特性,建立资源保存和生产体系,开展联合验证,获得必要的背景数据,以推动业界及监管机构认可,是建立致癌性小鼠模型的必然途径。虽然建立我国自主知识产权的致癌性小鼠模型尚有待大量工作需要完成,但我国定会突破重重困难,实现致癌性小鼠模型的国产化。

来源:中国食品药品监管杂志


