您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-11 19:45
摘 要
依托咪酯通过可逆性地阻断11-β-羟化类固醇脱氢酶,从而抑制肾上腺细胞合成皮质醇。本品为特殊注射剂,在评估仿制药与参比制剂质量和疗效一致时,应在药学及非临床一致性的基础上,用逐步递进研究策略,首先进行人体生物等效性(BE)研究。在BE研究中需对研究类型、给药剂量和方法、BE评价、安全性监测、药效学(PD)评价等方面进行充分考虑与合理设计。本文结合依托咪酯中/长链脂肪乳注射液的药代动力学(PK)特征,并基于其仿制药在国内上市前所开展的BE研究实例,系统探讨了本品BE研究的一般设计要求及相关考虑,旨在为国内仿制药的研发工作提供有益的参考和指导。
依托咪酯是临床麻醉科最为常用的短效麻醉药之一,具有起效快、对呼吸及循环系统影响较小以及代谢快等临床优势,近几年被广泛应用于危重症及高龄患者的麻醉诱导。依托咪酯通过可逆性地阻断11-β-羟化类固醇脱氢酶,从而抑制肾上腺细胞合成皮质醇。依托咪酯中/长链脂肪乳注射液用于成人、6个月以上婴幼儿、儿童和青少年的全身麻醉诱导。
依托咪酯注射液由Janssen Pharmaceutical在1942年开发,于1972年在欧洲上市,商品名为Hypnomidate;于1982年在美国上市,商品名为Amidate,上市剂型为静脉注射水针剂。由于该水针剂含有35%丙二醇,其渗透压高会导致注射部位疼痛、血栓性静脉炎和溶血等药物不良反应。为解决这一问题,德国贝朗(B. Braun Melsungen AG)开发了依托咪酯的乳状注射液。该乳状注射液使用脂肪乳剂作为依托咪酯的溶剂,可以减少上述药物不良反应。乳状注射液于1991年在德国上市,规格为10 mL:20 mg,商品名为EtomidateTM-Lipuro,随后在法国、荷兰和英国上市。德国贝朗的依托咪酯乳状注射液(现药品通用名称为依托咪酯中/长链脂肪乳注射液)于1996年9月进入中国市场,商品名为宜妥利/Etomidate-Lipuro,规格为10 mL:20 mg。
依托咪酯中/长链脂肪乳注射液属于特殊注射剂,与普通注射剂相比,其质量及其活性成分的体内行为更大程度地受到处方和工艺的影响,可能进一步影响制剂在体内的安全性和有效性。在评估依托咪酯中/长链脂肪乳注射液仿制药与参比制剂质量和疗效一致时,应在药学及非临床上具有一致性的基础上,用逐步递进研究策略,首先进行人体生物等效性(BE)研究。
BE是指在相似的试验条件下,单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内。在BE研究过程中,需要充分考虑并合理设计研究类型、给药剂量和方法、BE评价、安全性监测、药效学(PD)评价等方面,以确保研究的科学性和可靠性。本文结合依托咪酯中/长链脂肪乳注射液的药代动力学(PK)特征,及其仿制药在国内上市前所进行的BE研究情况等,对依托咪酯中/长链脂肪乳注射液的BE研究进行总结和概述,并对需特别关注的问题进行讨论。
1、 研究设计
依托咪酯中/长链脂肪乳注射液的BE研究应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》(2016年第61号)《中华人民共和国药典》通则“9012生物样品定量分析方法验证指导原则”《生物等效性研究的统计学指导原则》《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》等相关指导原则。
BE研究设计包括研究类型、受试人群、给药剂量和方法、血样采集、检测物质、BE评价、其他需关注的内容等。
1.1 研究类型
依托咪酯中/长链脂肪乳注射液属于特殊注射剂,从本品目前已开展的BE研究结果来看,未见其高变异特征,建议采用两制剂、两周期、两序列交叉设计,进行空腹条件下单次给药的BE研究。
1.2 受试人群
考虑到健康人群较患者人群更敏感,变异性通常较低,一般选择健康受试者进行BE研究,以尽量减少其他因素对PK结果的干扰。一般情况下,研究入选的受试者应有适当的性别比例,同时应符合伦理学的一般要求。入选受试者的例数应使BE评价具有足够的统计学效力。
1.3 给药剂量和方法
依托咪酯中/长链脂肪乳注射液原研进口说明书指出,对于所有的患者,应根据个体反应和临床效应调整剂量。对于成人和青少年,本品的有效催眠剂量为0.3 mg·kg-1,相对应的本品为0.15 mL·kg-1,可通过追加注射本品来延长催眠时间,总的用量不可超过3安瓿(30 mL)。对于儿童患者,特别是15岁以下的儿童,可能需要增加剂量,有时需增加至成人正常剂量的30%,以达到同样的催眠深度和时间。对于老年患者,本品的单次用药剂量为0.15~0.20 mg·kg-1,并根据临床疗效来进一步调整剂量。
进行BE研究时,给药剂量一般应与临床单次用药剂量一致,不得超过临床单次最大剂量或已经证明的安全剂量。由于依托咪酯是一种麻醉药,使用时需根据个体反应和临床效应调整剂量,BE研究中应用于健康受试者时需考虑受试者安全性问题,根据相关文献及同类药物《丙泊酚中长链脂肪乳注射液BE研究指导原则》,0.5 mg·kg-1依托咪酯使用剂量与2.5 mg·kg-1丙泊酚使用剂量能达到相同的麻醉程度。因此,笔者建议在本品的BE研究中,采用5 μg·kg-1·min-1的给药速率缓慢静脉输注,持续给药30 min。
1.4 血样采集
单次给药后,依托咪酯迅速从中央室分布至外周室和深外周室;同时由于其清除率较快,血浆药物浓度在给药约30 min后迅速下降,依托咪酯的终末清除半衰期约2~5 h。通常建议采集血液样品,合理设计样品采集时间,应采集不短于3个末端消除半衰期的样品以充分表征本品药代动力学特征。
1.5 检测物质
在BE研究中,检测物质的选择至关重要。一般而言,推荐仅测定原形药物,这是因为原形药物的药时曲线相较于代谢产物能更灵敏地反映出不同制剂之间的差异。对于特殊注射剂,其活性物质在体内如同时存在多种形态,BE研究应充分考虑各种形态药物对安全性和有效性的影响,结合药物特点选择科学、合理的检测物质,同时检测方法需经过充分验证,并对目标检测物质具有足够区分力,对受试制剂和参比制剂的差异具有足够灵敏度。本品在注射时,依托咪酯迅速地从油颗粒中分出来,依托咪酯血浆浓度与其水剂型相同,因此笔者建议本品BE研究时仅需测定原形药物依托咪酯。
1.6 BE评价
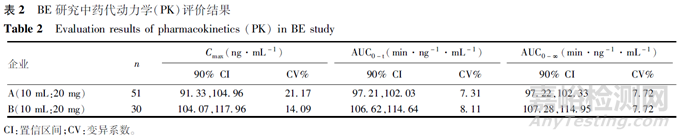
BE研究方法按照研究方法评价效力,其优先顺序为PK研究、PD研究、临床研究和体外研究。峰浓度(Cmax)、血药浓度-时间曲线下面积(AUC)等主要PK参数反映了药物在人体内的吸收速率和程度,笔者建议以依托咪酯的Cmax、AUC0-t和AUC0-∞作为BE评价指标。在BE评价中,采用平均BE(ABE)方法进行评价,BE接受标准为受试制剂与参比制剂的Cmax、AUC0-t和AUC0-∞的几何均值比90%置信区间在80.00%~125.00%范围内。
BE集(BES)是评价受试制剂和参比制剂是否生物等效的主要数据集,BES通常包括至少一个周期且具有至少一个可评价药代动力学参数的统计分析集,例如:某例受试者提前退出试验,根据血药浓度数据得知,该例受试者具有可评价的Cmax,该参数应纳入BES进行评价。
数据集事先需要在方案中明确定义,包括具体的受试者剔除标准,通常情况下,BES不应基于统计分析结果,或者单纯的PK理由剔除数据,同时不建议剔除离群值,必要时需进行敏感性分析。
1.7 安全性监测
依托咪酯中/长链脂肪乳注射液原研进口说明书中药物不良反应:与大多数全麻药物相似,依托咪酯可影响呼吸功能和血管功能。与其他一些全麻药物相似,本品可引起非自主性肌肉运动。除此之外,依托咪酯常对肾上腺皮质功能产生影响。相关文献报道,依托咪酯还有苏醒延迟、注射痛与肌阵挛、术后呕吐恶心等药物不良反应。为最大限度地保护受试者的安全并考察试验药物的安全性,输注过程中需由麻醉医师在现场进行监护和必要的干预。
1.8 PD评价
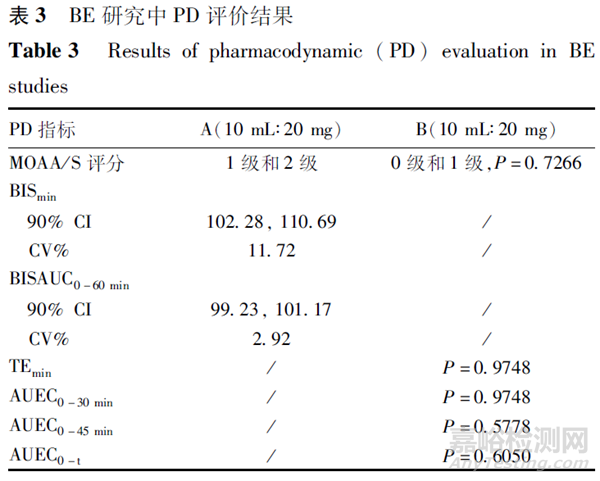
依托咪酯中/长链脂肪乳注射液的PD评价主要关注其麻醉/镇静效果。在现有的研究方法中,评分法或仪器法是2种常用的评价手段。为确保评价的准确性和客观性,笔者建议研究过程中应监测脑电双频指数(BIS)和/或进行改良警觉/镇静(MOAA/S)评分等。BIS监测应详细记录并分析从给药到给药结束后时间内的BIS值-时间曲线下面积(AUCBIS0-t)、给药过程中BIS达到的最低值(BISmin)、最小BIS值出现时间(t-BISmin)等结果,反映药物对大脑电活动的影响程度和持续时间。MOAA/S评分应对评分值、受试者完全苏醒时间等进行统计分析,以评估受试者在不同镇静水平下的表现。PD评价中应对受试制剂和参比制剂相关评分的差异进行统计分析并对结果进行解释。
通过结合BIS监测和MOAA/S评分等多种方法,可以更全面地评价依托咪酯中/长链脂肪乳注射液的麻醉/镇静效果,为药物的研发和临床应用提供更有价值的参考信息。
2、 国内依托咪酯中/长链脂肪乳注射液所开展的BE研究情况
查阅药物临床试验登记与信息公示平台及药审中心近年来申报本品仿制药的BE研究开展情况,整体来讲,均采用两制剂、两周期、两序列交叉设计,进行空腹条件下单次给药的BE研究。研究中纳入健康男性和女性受试者,给药剂量为5 μg·kg-1·min-1的给药速率缓慢静脉输注,持续给药30 min。研究方案规定检测物质为原形药物依托咪酯,以依托咪酯的主要PK参数Cmax、AUC0-t、AUC0-∞作为BE评价的指标,接受标准为依托咪酯的主要PK参数几何均值比值的90%置信区间在80.00%~125.00%内。在药物输注过程中,所有受试者均接受了严密的安全性监测,由麻醉医师在现场进行监护和必要的干预。不同的是BE研究中PD指标的选择,如采用BIS及MOAA/S评分等。目前,已获批两家申请人开展BE研究的主要设计、PK参数及BE结果情况,见表1、表2及表3。

3、 结 语
BE研究和审评是在遵循相关法规和指导原则的基础上,结合药物作用机制、制剂特点、生理过程、统计学方法等综合评价的一门学科,其在评价仿制药与参比制剂疗效一致性方面发挥着重要的作用。鉴于依托咪酯中/长链脂肪乳注射液属于特殊注射剂,本文深入探讨了开展BE研究时需重点关注的问题,并提出相关建议。需要说明的是,上述建议基于笔者当前的科学认知及背景调研,并不代表监管机构的正式要求。随着科学技术的发展和不断进步,相关内容和建议将持续更新和完善。

来源:中国临床药理学杂志


