您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-23 20:25
放射性核素偶联药物(radionuclide drug conjugates,RDC)是一种新兴的肿瘤诊疗药物,其结合了精准靶向和强效杀伤两方面的优势,用携带放射性核素有效载荷的特异性配体靶向癌细胞,将放射性能量集中在癌细胞周围释放,杀死癌细胞的同时,最大程度地减少对癌细胞附近正常组织细胞的损害。
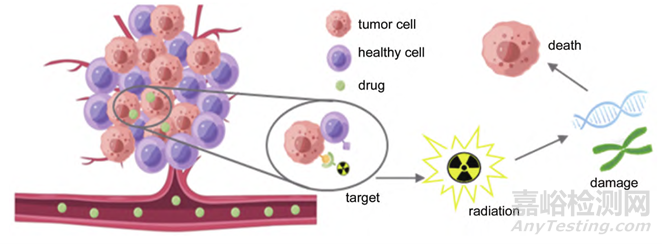
图1. RDC药物作用机制图[1]
与常规的靶向肿瘤治疗药物相比,RDC药物因其特殊的结构与理化性质,具有以下独特的优势。[2]
第一,放射性核素所带来的独有性质使RDC药物能够实现“诊疗一体化”闭环。首先使用物理半衰期较短的放射性核素(能发射γ射线或者正电子)进行标记,合成诊断型RDC药物,用SPECT或PET成像进行检测,从而确定靶标(癌症特异性膜蛋白)是否在患者肿瘤上大量表达。如果检测到靶标具有足够的特异性和摄取,再用物理半衰期较长的放射性核素(能发射α或β射线)对几乎相同的配体进行标记,合成针对相同靶标的治疗型RDC药物。目前,诺华(Novartis)的177Lu-PSMA-617和68Ga-PSMA-11是最具代表性的“诊疗一体化”成功案例,它们的成功极大地激发了全球对RDC药物研发的热情。
第二,传统治疗模式依赖体内的生物化学过程和细胞的信号通路,易产生耐药。而RDC发挥药效主要依赖物理辐射,因此不易产生耐药。
RDC的药代动力学研究策略
由于放射性同位素实验开展的门槛较高,根据NMPA发布的指导原则,RDC药物如果使用已有临床使用经验的放射性核素,可采用不具有放射性的受试物cold偶联药物开展临床前实验,例如含稳定同位素的受试物、放射性体内诊断药物经衰变后的产物等。当然,有条件的情况下,也可以直接用放射性核素偶联药物开展相应研究。
RDC药物的发现阶段,首先需要筛选合适的配体,确保配体有较好的稳定性、亲和力和靶向性。我们可以通过体外的代谢稳定性实验评估其稳定性,如使用全血或血浆、肝S9或肝匀浆液、肾S9或肾匀浆液等基质。在动物体内PK研究中,应评估配体的体内半衰期和其他PK参数,通过组织分布实验评估RDC对靶组织的靶向性,并在药效实验中评估对靶点的亲和力。
RDC的临床前药代研究包括体外分布、代谢和药物相互作用研究,体内PK线性、性别差异等,以及组织分布和排泄实验等研究内容(图2)。
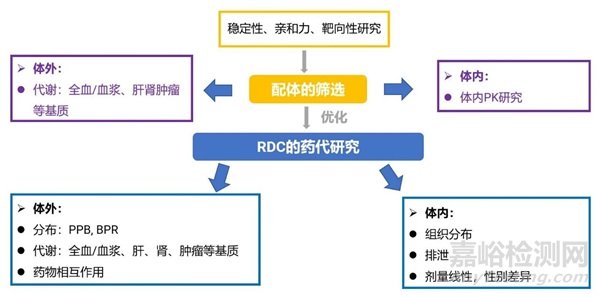
图2. RDC药物药代动力学研究示意图
案例分享[3]
1、诊疗型RDC药物
68Ga PSMA-11的药代动力学特征
PSMA-11在浓度为1 ug/mL和5 ug/mL条件下,在大鼠、迷你猪和人种属的血浆中的蛋白结合率较低(33-44%)。在小鼠、大鼠、迷你猪和人种属的全血和血浆中,PSMA-11的分配比均小于1,分别为0.54、0.43、0.71和0.71。在小鼠中的分布体积为0.3-0.5 L/kg,这表明PSMA-11主要分布在外周体液。使用热药在荷瘤小鼠中开展组织分布实验,显示肾脏和肿瘤是主要的分布组织(肾脏是PSMA高表达器官),表明了药物具有较好的靶向性。使用非放射性标记的Ga-PSMA-11在体外基质中评估了其代谢稳定性,包括大鼠、迷你猪和人种属的体外血浆、肝S9和肾S9,结果显示在37℃条件下孵育1小时均稳定。荷瘤小鼠的组织分布显示药物主要分布在肾脏系统,人体临床结果显示药物主要通过肾脏排泄。在大鼠PK中呈现剂量线性,且无性别差异。
2、治疗型RDC药物
177Lu-PSMA-617的药代动力学特征
PSMA-617和非放射性175Lu-PSMA-617在大鼠、迷你猪和人种属的血浆蛋白结合率为50%-70%。PSMA-617和175Lu-PSMA-617在小鼠、大鼠、迷你猪和人种属的全血和血浆中的分配比均<0.6。175Lu-PSMA-617和PSMA-617在大鼠、迷你猪和小鼠组织中分布有限。177Lu-PSMA-617在健康大鼠中组织分布显示177Lu-PSMA-617仅在肾脏蓄积,给药1小时后达峰值。1天以后,肾脏中仅剩余0.4%的给药剂量,>97%的给药剂量在尿液中回收,且在其他组织中无蓄积。在人体给药2.5小时内,177Lu-PSMA-617主要分布于胃肠道、肝脏、肺部、肾脏、心脏壁、骨髓和唾液腺。175Lu-PSMA-617和PSMA-617于37°C条件下在人、大鼠和小型猪的血浆中2小时均稳定。175Lu-PSMA-617和PSMA-617在人、大鼠和小型猪的肝S9和肾S9中37℃条件下孵育1小时均稳定。
PSMA-617不是CYP450酶的底物,不诱导CYP1A2、2B6或3A4;对CYP1A2、2B6、2C8、2C9、2C19、2D6和3A均无抑制作用。PSMA-617不是BCRP、P-gp、MATE1、MATE2-K、OAT1、OAT3或OCT2的底物;也不抑制BCRP、P-gp、MATE1、MATE2-K、OAT1、OAT3、OATP1B1、OATP1B3、OCT1或OCT2。
参考文献:
[1] 陶巧玉,许波华,李嫚琪,付莉莉,刘楚乔,常艳等. 放射性核素偶联药物的研究进展[J].中国新药杂志,2022,31( 23) : 2377-2384.
[2] John J Sunderland, Laura B Ponto, Jacek Capala. Radiopharmaceutical Delivery for Theranostics: Pharmacokinetics and Pharmacodynamics. Semin Radiat Oncol. 2021;31(1):12-19.
[3] 多肽偶联放射性核素药物及其DMPK研究策略,药明康德DMPK公众号。

来源:药明康德赋能前沿


