您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-25 08:51
玻璃体腔注射是治疗视网膜和脉络膜疾病最为常见和重要的给药方式。玻璃体腔注射药物批准用于临床的历史已有20余年。更昔洛韦于1996年被FDA获批用于治疗慢性视网膜疾病。接下来Macugen于2004年获批,雷珠单抗和阿柏西普分别于2006和2011年获批,法瑞西单抗和高剂量阿柏西普分别于2022年和2023年获批。近年来,随着新技术和新的制剂方法在眼科药物研发领域不断的拓展应用,比如玻璃体腔长效缓释制剂、植入物以及基因治疗药物的研发,得以实现药物浓度在玻璃体腔的长期维持,极大拓展了其临床应用价值。
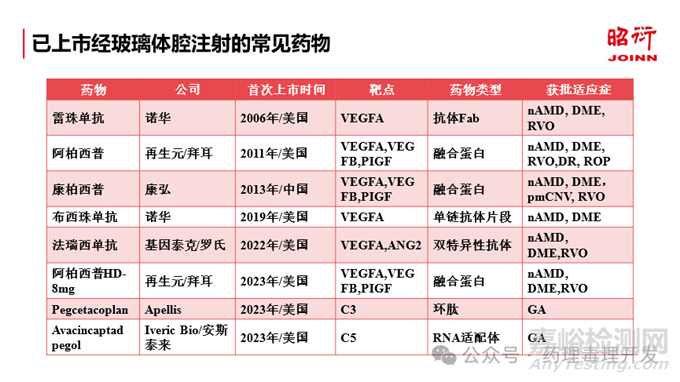
虽然有诸多的眼科药物已经获批上市,以及很多新药正在研发中,目前监管机构仍然没有发布专门的眼科药物研究的指导原则可供参考。 最近,FDA发布了针对眼部罕见病基因治疗的指导原则,主要是针对视网膜疾病(2020年1月)。在眼科药物的非临床研究中,针对小分子药物,可以参考ICH M3(R2);对于生物制品来说,可以参考ICH S6,但是针对眼部药物的一些特殊考虑并没有在ICH M3(R2) 或ICH S6中进行体现和说明。
本系列文章从非临床研究中动物解剖差异、药理学研究、PK研究、毒理学研究和早期临床研究等多个方面讨论经玻璃体腔给药的眼科新药研究中的一些考虑要点。其中所述的观点主要适用玻璃体腔注射途径给药的小分子药物和生物制品的非临床和早期临床研究。针对经玻璃体腔途径给药的眼内植入物和基因治疗产品的评价,其中一些研究内容可参考本文,但仍有些其他特殊需要考虑的要点不在本文的讨论范围。
一、眼部解剖和生理的种属间差异
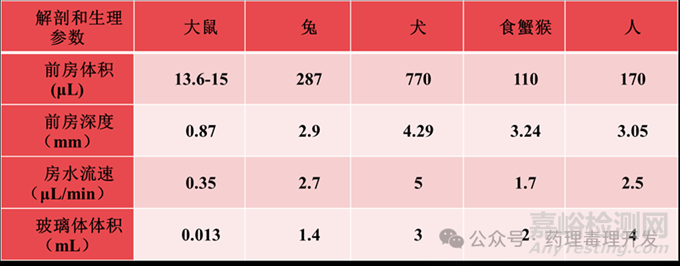
非临床研究中需要使用不同的动物种属来评价药物的安全性和有效性,进而运用非临床研究的数据指导临床试验。因此,人和不同动物种属间的解剖学和生理学的差异会影响试验结果的解释和药物的评价。下表列出了一些与玻璃体腔给药相关的种属间解剖学结构差异。给药操作、药代特征解释、毒理结果解释及临床起始剂量计算时需要充分考虑种属间解剖和生理学差异。
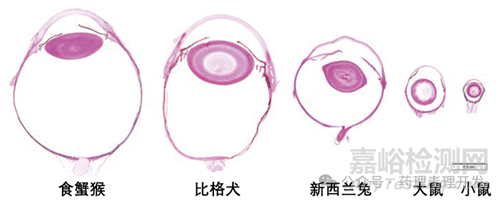
不同种属实验动物眼球大小的差异,图片引自M.F. Ramos, Ocular Immunopathology, Immunopathology in Toxicology and Drug Development, DOI 10.1007/978-3-319-47385-7_14.
人和动物眼球内的空腔结构主要有两部分液体填充:房水和玻璃体。房水的化学组成与血浆类似,包含免疫球蛋白和生长因子(TGF-β2)。这些因子在免疫组织损伤修复中发挥着重要的作用。房水由睫状体的上皮细胞分泌至后房,并经瞳孔循环至前房,然后经小梁网途径(Schelemm’s管-巩膜表层静脉)或葡萄膜巩膜途径(睫状体-巩膜和脉络膜静脉)引流至眼外。不同动物种属中,房水引流速度的差异可能会影响眼内药物浓度。因而,在毒理实验中,可以通过增加前房给药或玻璃体腔给药的频次来更全面的评价药物的代谢状态。
在人和大动物中,玻璃体占了眼后节大约80%的体积。玻璃体主要由含水的粘弹基质,胶原纤维和粘多糖组成。其主要由睫状体上皮细胞,视网膜胶质细胞和hyalocytes合成。在不同种属中,玻璃体的流动力学差异主要是由透明质酸的含量造成的。透明质酸在维持玻璃体的形状并且吸收水分子的过程中发挥了重要作用。在大鼠、兔和犬中,较低的透明质酸浓度造成玻璃体呈胶状。在小型猪,食蟹猴以及人中,玻璃体的成分在玻璃体腔中呈区域性分布,表现为更紧密的玻璃体皮质(较多的胶原成分)和相对液化的中部玻璃体。在玻璃体液活体采集和生物标志物的分析中,需要充分考虑到玻璃体的不均匀性。
玻璃体腔注射的药物通常经睫状体平坦部给药,因为睫状体平坦部具有较少的血管和神经组织。玻璃体腔注射可以在玻璃体-视网膜界面产生很高的药物浓度,对治疗视网膜疾病非常重要。由于不同种属的眼球大小的差异,睫状体平坦部的位置距角巩膜缘的距离也有差异,需要在实际操作过程中予以注意。由于啮齿类动物具有较大的晶状体以及较少的玻璃体体积,对于注射时进针的角度需要注意以避免损伤到晶状体。在实际操作中的给药体积受限于眼球的大小,常用的给药体积如下:大鼠:4-5μL,兔:50μL,大动物:50-100μL,人:100μL。尽管给药体积很小,但仍会引起一过性的眼压升高以及药物的返流等现象。同时,玻璃体腔注射可引起一些常见的并发症包括:结膜下出血,晶状体的损伤,眼内感染,眼内出血,玻璃体嵌顿等。
玻璃体视网膜交界面由玻璃体胶原纤维的紧密连接、内界膜、胶质细胞和粘多糖(如硫酸软骨素等)组成。正是由于存在这些粘附成分,玻璃体视网膜交界面也成为年龄和药物引起的相关病变的发生部位。因而在非临床研究和临床研究中,针对玻璃体腔给药的药物,需要对玻璃体视网膜的交界面进行全面的影像学检查和评价。
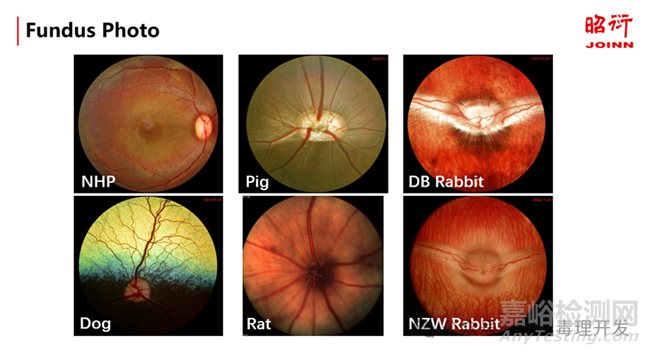
不同动物种属的眼底照相,图片来源:昭衍新药眼科实验室
大部分经玻璃体腔注射的药物其药理学作用的靶细胞位于视网膜。不同动物种属的视网膜在解剖和生理上也有明显的差异,如猴是唯一具有视网膜黄斑中心凹的实验动物,而猪、犬和兔则只在视网膜的特定部位具有类似黄斑结构visual streak,因而在某种程度上,猴也是进行眼底视网膜疾病研究的最佳的动物种属。其他的一些解剖和生理学差异,比如兔的视网膜血管结构只在特定区域分布,犬和猫的眼底具有反光的绒毯层结构(tapetum lucidum)等等,这些都需要在非临床研究中进行充分的考虑。
二、药理学研究
目前,已获批上市玻璃体腔注射药物的适应症主要集中在视网膜病变,最常见的如新生血管性老年性黄斑变性、糖尿病性视网膜病变和视网膜静脉阻塞。最近,用于治疗干性老年性黄斑变性的玻璃体腔注射药物也已获批上市,该适应症也是目前眼科新药的研发热点。在临床前研究中,可以通过物理或化学诱导的方法对动物进行造模,以模拟患者发病过程中的某些病理改变,如视网膜水肿、视网膜和脉络膜的新生血管等。同时,通过对老龄猴进行筛查,可以筛选出一些自发性的眼部疾病模型。这些自发性的动物模型与人类相应的疾病表现类似,具有很高的研究应用价值。但是,这类自发性眼病模型资源较稀缺,需要有大型CRO公司猴场资源的支持。下面简单介绍几种视网膜脉络膜病变的常见动物模型,以供参考。
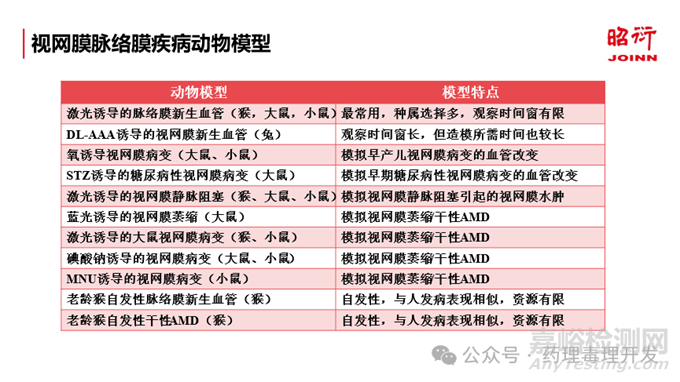
药理学研究是为了研究产品与治疗靶点相关的作用机制和效应,以明确产品的生物学作用特点。对于药理学研究中动物疾病模型的选择,需要根据药物的作用靶点、临床适应症和动物模型的可及性等,综合考虑动物模型对疾病的模拟程度、解剖差异、研究终点指标和给药方式等诸多因素来确定,从而有助于后续非临床和临床研究的剂量选择和试验设计。
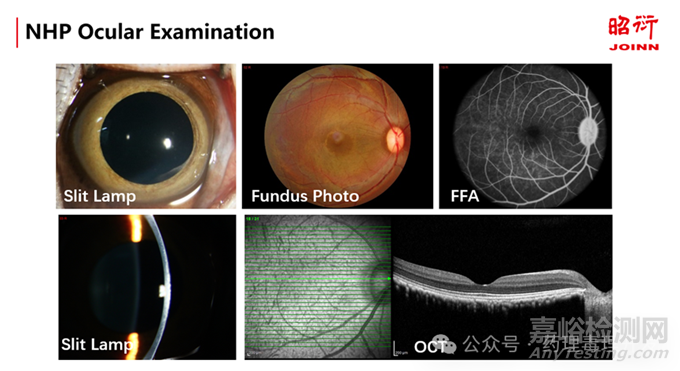
食蟹猴的眼科影像学检查,图片来源:昭衍新药眼科实验室
对于这些动物模型的药理学观察指标,可以从活体的眼科影像学检查,功能学检查和组织学检查等多个维度来进行评价。影像学方面,由于眼底视网膜是全身唯一可以直接观察到小血管的部位,各种眼底的影像学检查在临床前药理学研究中广泛使用,包括眼底照相,眼底荧光素血管造影(FFA),光相干断层扫描(OCT),光相干断层扫描血管成像(OCTA),自适应光学扫描仪,活体的视细胞观察等技术的不断创新,可以达到对视网膜进行在细胞层次的观察,也进一步提高了药理学研究的效率。对于活体的眼科功能学检查主要包括眼电生理和视觉行为评价。眼电生理可以在不同的模式下评价不同神经元的电信号传导功能。视觉行为学检查主要用于啮齿类动物,用以评价动物的视觉。组织学检查主要包括应用不同的染色技术和组织处理方法,对药物作用的靶细胞进行特异性的观察,比如广泛应用于视神经保护药物评价的离体视网膜铺片RGC染色等等,需要根据具体的研究目的来进行综合评估和选择。
◆法瑞西单抗的非临床药理学研究
法瑞西单抗(Faricimab)是一款靶向VEGF和Ang-2的双特异性抗体,通过玻璃体腔注射用于治疗新生血管性老年性黄斑变性和糖尿病性黄斑水肿等视网膜疾病。于2022年在美国获批上市。法瑞西单抗可以通过阻断VEGF/VEGFR信号控制新生血管,同时也能通过抑制Ang-2信号通路来改善血管的稳定性和减轻视网膜炎症。
非临床药理学研究主要做了以下试验,以评价其抑制CNV和抗炎的作用
• 亲和力和组织交叉反应试验
• 小鼠自发性CNV模型,和激光诱导的非人灵长类CNV模型,用以评价抑制新生血管生长的药理学作用。
• 内毒素诱导的葡萄膜炎小鼠模型来评价药物的抗炎作用。
参考文献
[1] Ramos MF, Ocular Immunopathology, Immunopathology in Toxicology and Drug Development, DOI 10.1007/978-3-319-47385-7_14.
[2] Regula JT, et al. Targeting key angiogenic pathways with a bispecific CrossMAb optimized for neovascular eye diseases,EMBO Mol Med (2016) 8: 1265-1288.
[3] U.S FDA. Non-clinical review of Faricimab.
[4] Ingrid M. et al. International consortium for innovation and quality: An industry perspective on the nonclinical and early clinical development of intravitreal drugs. Clin Transl Sci. 2023;16:723–741.
[5] Booler HS, et al. Scientific and regulatory policy committee points to consider: fixation, trimming, and sectioning of nonrodent eyes and ocular tissues for examination in ocular and general toxicity studies. Toxicol Pathol. 2022;50(2):235-251.

来源:药理毒理开发


