您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-25 09:00
摘 要: 采用高效液相色谱法测定四妙勇安汤物质基准的指纹图谱及含量。使用ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-0.2%磷酸为流动相,梯度洗脱,流量为0.8 mL/min,检测波长为210 nm,柱温为25 ℃。建立15批四妙勇安汤物质基准的高效液相色谱指纹图谱,运用中药色谱指纹图谱相似度评价系统(国家药典委员会2012 A版)进行相似度评价,对共有峰进行药味归属,建立了绿原酸、哈巴苷、哈巴俄苷的含量测定方法。15批四妙勇安汤物质基准相似度均大于0.90,指纹图谱中含有11个共有峰,其中归属于金银花5个,玄参2个,当归2个,甘草2个。绿原酸、哈巴苷、哈巴俄苷平均质量分数分别为2.24%、0.59%、0.14%。建立的15批四妙勇安汤高效液相色谱指纹图谱精密度、稳定性良好,能够较好的反映其化学成分组成,可用于四妙勇安汤物质基准的质量控制与评价。
关键词: 四妙勇安汤基准; 高效液相色谱法; 指纹图谱; 绿原酸; 哈巴苷; 哈巴俄苷
四妙勇安汤是国家药品监督管理局发布的首批100首来源于古代经典名方的中药复方制剂之一,处方经典简洁,效用显著。此方最早收载于汉代《华佗神医秘传》,后收载于清代名医鲍相敖所著《验方新编》中[1],由金银花、玄参、当归、甘草四味中药组成[2],具有清热解毒,活血止痛之功效[3],主要用于毒热壅盛所致的疮疽痈疡之证[4],临床上主要用于治疗血栓闭塞性脉管炎、糖尿病足、动脉硬化闭塞症[5‒8],取得了较好的疗效。目前还广泛用于痛风性关节炎、结节性红斑等的治疗[9‒10]。
近年来对四妙勇安汤的提取制备工艺及质量控制研究已有报道[11‒12],但对四妙勇安汤物质基准(指按传统工艺煎煮所得汤剂经低温干燥而得的干浸膏)的指纹图谱研究及指标成分含量测定涉及较少。中药复方制剂成分复杂,指纹图谱能够较全面地反映其所含化学成分的种类和数量,能够对其进行整体描述和评价,有利于控制中药材质量,促进中药现代化发展。
为了能够较为全面系统地了解四妙勇安汤物质基准所含化学成分的种类和数量[13],笔者建立了四妙勇安汤物质基准的HPLC指纹图谱,并且研究了指纹图谱中各色谱峰的来源,为四妙勇安汤物质基准的进一步研究和开发奠定了基础。
1、 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:SHIMADZA LC-20AT型,配二极管阵列检测器,日本岛津仪器公司。
电子天平:NewClassic MS105DU型,感量为0.01 mg,瑞士梅特勒-托利多仪器公司。
超声波清洗器:KQ500D型,昆山市超声仪器有限公司。
煎药壶:D5.5-L型,潮州市潮安区康雅顺电器有限公司。
真空干燥箱:BZF-50型,上海博讯医疗生物仪器股份有限公司。
高速多功能粉碎机:HCP-1000A型,浙江省永康市金穗机械制造厂。
超纯水发生器:Milli-Q Reference型,美国密理博公司。
绿原酸对照品:质量分数为98.0%,批号110753-202018,中国食品药品检定研究院。
哈巴苷对照品:质量分数为96.8%,批号110729-201707,中国食品药品检定研究院。
哈巴俄苷对照品:质量分数为96.8%,批号110730-202110,中国食品药品检定研究院。
阿魏酸对照品:质量分数为99.4%,批号110773-201915,中国食品药品检定研究院。
3.5-O-二咖啡酰奎宁酸对照品:质量分数为99.0%,批号111894-202205,中国食品药品检定研究院。
4.5-O-二咖啡酰奎宁酸对照品:质量分数为99.0%,批号111782-202208,中国食品药品检定研究院。
甘草苷对照品:质量分数为95.0%,批号111610-202209,中国食品药品检定研究院。
甘草酸铵对照品:质量分数为96.2%,批号110731-202122,中国食品药品检定研究院。
金银花、当归、玄参、甘草药材样品:产地及批号见表1,通过随机数表法对表1中不同品种及批次药材进行随机组合,见表2,北京园禾方圆植物科技股份有限公司。
表1 四妙勇安汤饮片来源信息
Tab. 1 Source information of Simiao Yong'an Decoction herbal pieces

表2 四妙勇安汤基准物随机组合
Tab. 2 Random combination table of Simiao Yong'an Decoction
乙腈:色谱纯,赛默飞世尔科技(中国)有限公司。
磷酸:色谱纯,天津市科密欧化学试剂有限公司。
实验用水为纯化水。
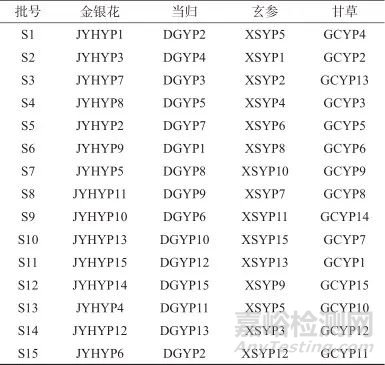
1.2 色谱条件
色谱柱:ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm,美国安捷伦科技有限公司);柱温:25 ℃;检测波长:210 nm;流动相:A相为乙腈,B相为0.2%(体积分数,下同)磷酸溶液,流量为0.8 mL/min,梯度洗脱,洗脱程序见表3;进样体积:10 μL,理论板数按绿原酸峰计应不低于5 000。
表3 梯度洗脱条件
Tab. 3 Conditions of mobile phase in gradient elution
1.3 溶液制备
四妙勇安汤基准样品溶液:按照处方比例称取金银花90 g、玄参90 g、当归60 g、甘草30 g,加水浸泡1 h,煎煮两次,第一次50 min,第二次40 min,煎液滤过,合并滤液,减压浓缩至相对密度为1.30~1.35 (60 ℃),减压干燥制成干膏粉。取干膏粉适量(含金银花约0.5 g),精密称定,置于50 mL容量瓶中,加水适量超声20 min,取出放冷,加水稀释至标线,摇匀,用0.45 μm滤膜滤过。
单味药材溶液及阴性对照溶液:按处方组成分别称取金银花、玄参、当归、甘草各单味药材以及处方中缺金银花、玄参、当归、甘草各单味药材的阴性对照,按样品溶液制备方法制备各单味药材溶液及阴性对照溶液。
绿原酸、哈巴苷、哈巴俄苷对照品贮备溶液:精密称取绿原酸对照品、哈巴苷对照品、哈巴俄苷对照品适量,加入70%(体积分数,下同)乙腈溶解,制得质量浓度分别为928.00、229.20、63.20 μg/mL的对照品贮备溶液。
绿原酸、哈巴苷、哈巴俄苷混合对照品溶液:取绿原酸、哈巴苷、哈巴俄苷贮备溶液适量,加入70%乙腈,制成混合对照品溶液,绿原酸、哈巴苷、哈巴俄苷质量浓度分别为232.00、57.30、15.80 μg/mL。
阿魏酸、3.5-O-二咖啡酰奎宁酸、4.5-O-二咖啡酰奎宁酸、甘草苷、甘草酸铵对照品溶液:分别称取阿魏酸对照品、3.5-O-二咖啡酰奎宁酸对照品、4.5-O-二咖啡酰奎宁酸对照品、甘草苷对照品、甘草酸铵对照品适量,加入70%乙腈,制成质量浓度均约为100 μg/mL的对照品溶液。
空白溶剂:取水作为空白溶剂。
1.4 实验方法
取四妙勇安汤基准样品溶液,按1.2色谱条件进样,记录色谱图。将15批样品的HPLC色谱图导入《中药色谱指纹图谱相似度评价系统》(2012版),进行相似度评价。依照对照品溶液的出峰时间,对共有峰进行药味归属;按照外标法计算绿原酸、哈巴苷、哈巴俄苷的含量。
2、 结果与讨论
2.1 实验条件的优化
2.1.1 检测波长的选择
采用二极管阵列检测器在200~400 nm波长范围内对绿原酸、哈巴苷及哈巴俄苷对照品溶液进行扫描,绿原酸、哈巴苷及哈巴俄苷对照品溶液紫外吸收光图谱见图1。由图1可见,绿原酸对照品溶液在218、326 nm处有较强吸收;哈巴苷对照品溶液在195 nm处有较强吸收,哈巴俄苷对照品溶液在280 nm处有较强吸收,但这几个吸收峰并不重叠。3种对照品溶液在紫外末端均有吸收,因此综合考虑下,确定检测波长为210 nm。
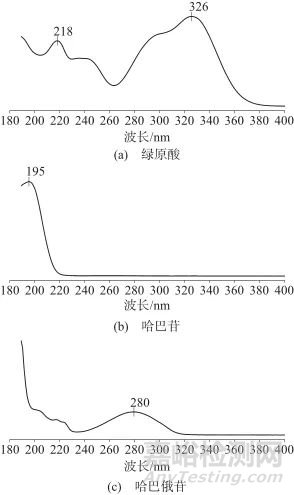
图1 绿原酸、哈巴苷及哈巴俄苷对照品的紫外吸收光谱
Fig. 1 UV spectrograms of chlorogenic acid,harpagide,harpagoside reference substances
2.1.2 流动相的选择
分别考察甲醇-0.1%磷酸、乙腈-0.1%磷酸、乙腈-0.2%磷酸三种流动相体系,以不同梯度进行分析,以色谱峰峰形、分离度等为考察指标。以甲醇-0.1%磷酸为流动相时,绿原酸色谱峰形较差,色谱保留时间较长,与前后杂质峰的分离度均小于1.5;以乙腈-0.1%磷酸为流动相时,绿原酸峰形较好,但是与前后杂质峰的分离度均小于1.5;以乙腈-0.2%磷酸为流动相时,绿原酸峰形较好,与前后杂质峰的分离度均大于1.5,哈巴苷、哈巴俄苷与前后杂质峰的分离度均符合要求,所有色谱峰能达到基本分离,因此最终选择乙腈-0.2%磷酸流动相体系,梯度洗脱。
2.1.3 含量测定中指标成分的选择
四妙勇安汤君药为金银花[14],用药量占总药量的三分之一;臣药为玄参,用药量亦为同样占总药量的三分之一。金银花的主要成分为绿原酸,玄参的主要成分为哈巴苷与哈巴俄苷[15],所以选择测定这3种指标成分的含量,以保证四妙勇安汤物质基准的有效性和稳定性。
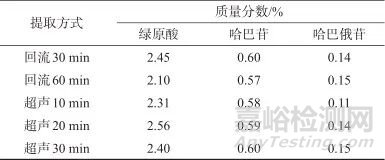
2.1.4 样品溶液制备方法
在指纹图谱方法建立时,对S1样品制备方法进行了考察。提取溶剂为水,考察不同提取方式(超声法、回流法)及提取时间(分别为10、20、30、60 min)下目标成分测定结果,结果见表4。综合分析后选择提取率最高的组合即超声20 min的提取方法。
表4 不同提取方式及不同提取时间下绿原酸、哈巴苷、哈巴俄苷质量分数测定结果
Tab. 4 different extraction methods and different extraction times of chlorogenic acid,harpagide,harpagoside
2.2 四妙勇安汤基准样品指纹图谱
2.2.1 HPLC指纹图谱的建立及相似度评价
取15批基准样品粉末适量(相当于金银花0.5 g),按1.3方法制备样品溶液,再按1.2色谱条件进样,记录其HPLC指纹图谱,然后将15批基准样品的HPLC色谱图导入《中药色谱指纹图谱相似度评价系统》(2012版),进行指纹图谱分析,以S1为参照图谱,时间窗宽度0.1 s,设置中位数法,全谱峰匹配,生成对照指纹图谱。空白溶剂图谱、基准样品对照图谱及15批叠加图谱,见图2~图4。

图2 空白溶剂色谱图
Fig. 2 chromatogram of blank solvent
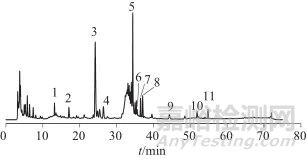
图3 四妙勇安汤基准对照图谱
Fig. 3 reference fingerprint chromatogram of Simiao Yong'an decoction substance benchmarks
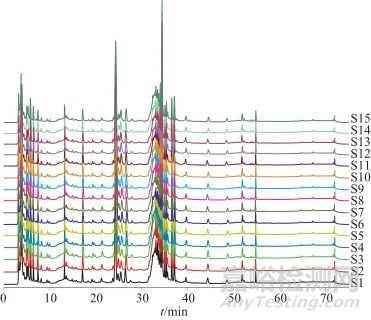
图4 15批四妙勇安汤基准样品指纹图谱叠加
Fig. 4 15 batches fingerprint chromatogram of Si miao Yong'an decoction substance benchmarks
2.2.2 共有峰的指认及归属
经过对15批基准样品的HPLC指纹色谱图的比较,认定其中11个峰作为共有峰。通过对基准样品、单味饮片、对照品、阴性样品及空白溶剂的图谱比对,指认1#峰为哈巴苷;3#峰为绿原酸;5#峰为阿魏酸;6#峰为甘草苷;7#峰为3.5-O-二咖啡酰奎宁酸;8#峰为4.5-O-二咖啡酰奎宁酸;9#峰为哈巴俄苷;10#峰为甘草酸铵。确定了11个共有峰的归属,其中2#、3#、4#、7#、8#峰来自于金银花;峰5#、11#来自于当归;1#、9#峰来自于玄参;6 #、10 #峰来自于甘草。
2.2.3 指纹图谱精密度试验
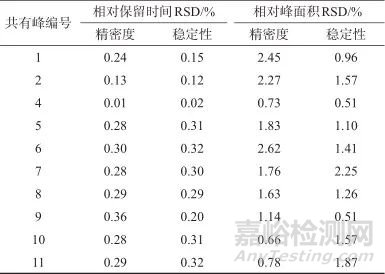
精密称取S1样品,平行称取6份,按1.3方法制备样品溶液,按1.2色谱条件进样,记录色谱图。以共有峰3号(绿原酸)为参照峰,计算各共有峰的相对保留时间和相对峰面积,并计算相对标准偏差,结果见表5。各共有峰相对保留时间的相对标准偏差小于2%,相对峰面积的相对标准偏差小于3%,表明该方法精密度良好。
表5 15批基准样品指纹图谱方法学验证结果(n=6)
Tab. 5 validation method used for15 batches fingerprint chromatogram of Simiao Yong'an decoction substance benchmarks
2.2.4 指纹图谱稳定性试验
精密称取S1样品,按1.3方法制备样品溶液。按1.2色谱条件,分别于0、2、4、6、8、24 h进样,记录色谱图。以共有峰3号(绿原酸)为参照峰,计算各共有峰的相对保留时间和相对峰面积,并计算相对标准偏差(见表5)。测得各共有峰相对保留时间的相对标准偏差小于2%,相对峰面积的相对标准偏差小于3%,表明样品溶液在24 h内稳定。
2.2.5 指纹图谱相似度计算结果
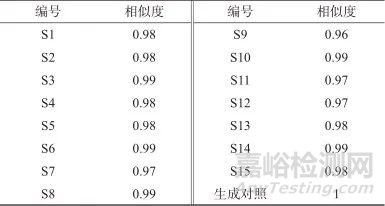
采用《中药色谱指纹图谱相似度评价系统》(2012版),以15批基准样品的HPLC指纹图谱生成的对照指纹图谱为参照,进行整体相似度评价,见表6。15批基准样品相似度均大于0.90,表明其差异较小,制备工艺稳定、重现性良好。
表6 15批基准样品相似度测定结果
Tab. 6 the similarity of the 15 batches substance benchmarks
2.3 四妙勇安汤基准样品中3种指标成分含量测定
2.3.1 线性方程和检出限
分别精密吸取对照品贮备溶液适量,置于同一容量瓶中,加入70%乙腈稀释至标线,得不同质量浓度的系列对照品线性混合溶液。取上述溶液按1.2色谱条件进样测定,以各成分对照品质量浓度为横坐标(x)、峰面积为纵坐标(y),绘制标准工作曲线,计算线性方程,见表7。取混合对照品溶液逐级稀释,当信噪比为3时,测得绿原酸、哈巴苷及哈巴俄苷的检出限分别为为0.01、0.05、0.02 μg/mL。
表7 三种指标成分的线性方程与线性范围
Tab. 7 Regression equation and linear range of three components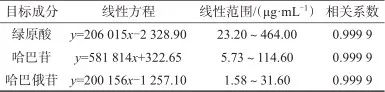
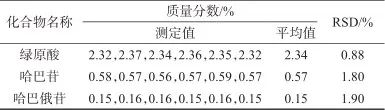
2.3.2 精密度试验
精密称取S1样品,按1.3方法平行制备6份样品溶液,按1.2色谱条件进样测定,结果见表8。由表8可见,绿原酸、哈巴苷及哈巴俄苷含量测定结果的相对标准偏差分别为0.88%、1.80%、1.90%,表明该方法的精密度良好。
表8 精密度试验结果
Tab. 8 Test results of precision
2.3.3 稳定性试验
精密称取S1样品,按1.3方法制备样品溶液,按1.2色谱条件,分别在第0、2、4、6、8、24 h进样,记录色谱图,数据见表9。由表9可见,绿原酸、哈巴苷及哈巴俄苷峰面积测定结果的相对标准偏差分别为0.46%、0.58%、0.62%,表明样品溶液在24 h内稳定。
表9 稳定性试验结果
Tab. 9 Results of stability test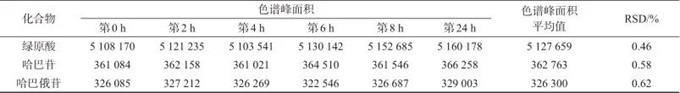
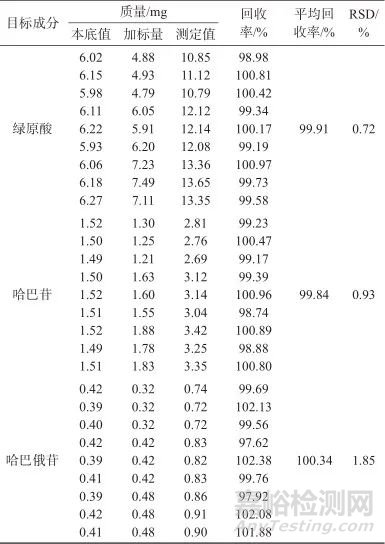
2.3.4 样品加标回收试验
精密称取S1样品,按照对照品量与样品中待测成分量0.8∶1、1∶1、1.2∶1的比例加入绿原酸、哈巴苷、哈巴俄苷对照品各3份(n=9),按1.3方法制备样品溶液,按1.2色谱条件进样,测定样品中3种指标成分的含量,计算加样回收率,见表10。由表10可见绿原酸、哈巴苷、哈巴俄苷平均回收率分别为99.91%、99.84%、100.34%;测定结果的相对标准偏差分别为0.72%、0.93%、1.85%,表明该方法样品加标回收率良好。
表10 样品加标回收试验结果
Tab. 10 Results of test for sample spike recovery
3、 结语
按照中药色谱指纹图谱相似度评价系统,计算15批四妙勇安汤基准样品指纹图谱相似度均大于0.90,同时对11个共有峰进行了来源归属,其中归属于金银花、玄参、当归、甘草的色谱峰分别为5个、2个、2个、2个。通过对照品保留时间及紫外光谱吸收曲线对比,对其中8个色谱峰进行了定性鉴别。15批四妙勇安汤基准样品中绿原酸、哈巴苷、哈巴俄苷平均含量分别为2.24%、0.59%、0.14%。所建立的四妙勇安汤基准HPLC指纹图谱能够反映其所含化学成分的种类和数量,实现了关键质量属性成分的表征。该指纹图谱具有科学性、合理性及可行性,能为其质量控制和评价提供依据。
参考文献
1 赵红霞,于智敏,耿颖,等.四妙勇安汤方源探析[J].中国中药杂志,2020,45(5):1 209.
ZHAO Hongxia,YU Zhimin,GENG Ying,et al. Exploration on origin of Simiao Yong'an decoction[J]. China Journal of Chinese Materia Medica,2020,45(5):1 209.
2 何录文,张爱华,薛俊茹,等.四妙勇安汤的组方考证及临床研究进展[J].中医药学报,2019,47(5):31.
HE Luwen,ZHANG Aihua,Xue Junru,et al. Textual research on the composition and clinical research progress of Simiao Yong'an decoction[J]. Acta Chinese Medicine and Pharmacology,2019,47(5):31
3 朱文卿,任汉书,郑媛媛,等.金银花的功能性成分及其生物活性研究进展[J].食品工业科技,2021,42(13):412.
ZHU Wenqing,REN Hanshu,ZHENG Yuanyuan,et al. Research progress in functional components and bioactivity of honeysuckle[J]. Science and Technology of Food Industry,2021,42(13):412.
4 蔡祎晴,王晨璐,刘雪寒,等.四妙勇安汤在消渴病脱疽中的应用探析[J].中华中医药杂志,2024,39(2):618.
CAI Yiqing,WANG Chenlu,LIU Xuehan,et al. Discussion on the application of Simiao Yong'an decoction in the treatment of consumptive thirst gangrene[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2024,39(2):618.
5 李慧宇,孙晖,张爱华,等.四妙勇安汤治疗血栓闭塞性脉管炎化学成分及药理作用研究进展[J].中国医药导刊,2022,24(4):393.
LI Huiyu,SUN Hui,ZHANG Aihua,et al. Research progress on chemical constituents of Simiao Yongan decoction and its pharmacological effects in the treatment of thromboangiitis obliterans[J]. Chinese Journal of Medicinal Guide,2022,24(4):393.
6 叶晔,刘骏逸,刘又文.胫骨横向骨搬移联合四妙勇安汤在糖尿病足中的应用效果分析[J].中国烧伤创疡杂志,2021,33(4):243.
YE Ye,LIU Junyi,LIU Youwen. Analysis of the applicalion effect of tibial transverse transport combined with Simiao Yong'an decoction in treating diabetic foot[J]. The Chinese Journal of Burns Wounds & Surface Ulcers,2021,33(4):243.
7 王继雪,杨稀瑞,吕勃川,等.四妙勇安汤通过JAK/STAT信号通路治疗下肢动脉硬化闭塞症的机制研究[J].海南医学院学报,2021,27(5):373.
WANG Jixue,YANG Xirui,LYU Bochuan,et al. Mechanism of Simiao Yong'an decoction in the treatment of arteriosclerosis obliterans of lower extremity through JAK/STAT signaling pathway[J]. Journal of Hainan Medical University,2021,27(5):373.
8 陈馨浓,葛其卉,赵一璇,等.四妙勇安汤对动脉粥样硬化巨噬细胞泡沫化的影响[J].中国中西医结合杂志,2023,43(6):705.
CHEN Xinnong,GE Qihui,ZHAO Yixuan,et al. Effect of Simiao Yongan decoction on macrophage foam cell formation in atherosclerosis[J]. Chinese Journal of Integrated Traditional and Western Medicine,2023,43(6):705.
9 潘静.四妙勇安汤治疗湿热型痛风临床观察[J].中国中医药现代远程教育,2023,21(2):110.
PAN Jing. Clinical observation on Simiao Yongan decoction in the treatment of dampness-heat gout[J]. Chinese Medicine Modern Distance Education of China,2023,21(2):110.
10 唐定书,杜茂涛,龙淼.四妙勇安汤加味治疗结节性红斑32例临床观察[J].四川中医,2007,25(11):92.
TANG Dingshu,DU Maotao,LONG Miao. Clinical observation on 32 cases with nodular erythema by modified Simiao Yong'an decoction[J]. Journal of Sichuan of Traditional Chinese Medicine,2007,25(11):92.
11 张星,赖文静,林夏,等. Box-Behnken设计-响应面法优化经典名方四妙勇安汤煎煮工艺研究[J].中草药,2023,54(10):3 109.
ZHANG Xing,LAI Wenjing,LIN Xia,et al. Optimization of decocting process of Simiao Yong'an Decoction by Box-Behnken design-response surface methodology[J]. Chinese Traditional and Herbal Drugs,2023,54(10):3 109.
12 李慧红,李敏,关红亚,等.反相高效液相色谱法测定加味四妙勇安汤中绿原酸和梓醇的含量[J].中国医院用药评价与分析,2023,23(1):36.
LI Huihong,LI Min,GUAN Hongya,et al. Determination of chlorogenic acid and catalpol in modified Simiao Yong'an decoction by reversed phase high-performance liquid chromatography[J]. Evaluation and Analysis of Drug-Use in Hospitals of China,2023,23(1):36.
13 孙克寒,杨会,王淑琪,等.基于UPLC-LTQ-Orbitrap-MS分析四妙勇安汤的化学成分[J].中国中药杂志,2022,47(10):2 658.
SUN Kehan,YANG Hui,WANG Shuqi,et al. Identification of chemical constituents in Simiao Yong'an Decoction based on UPLC-LTQ-Orbitrap-MS[J]. China Journal of Chinese Materia Medica,2022,47(10):2 658.
14 张可兴,刘树民.四妙勇安汤现代研究进展[J].中国药物依赖性杂志,2019,28(6):415.
ZHANG Kexing,LIU Shumin. Research progress of Simiao Yong'an decoction[J]. Chinese Journal of Drug Dependence,2019,28(6):415.
15 陈丽新,梁伟.玄参化学成分及药理作用的研究进展[J].特产研究,2023,45(1):147.
CHEN Lixin,LIANG Wei. Research progress on chemical constituents and pharmacological effects of radix scrophulariae[J]. Special Wild Economic Animal and Plant Research,2023,45(1):147.

来源:化学分析计量


