您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-26 13:59
介绍
无症状的颅内动脉瘤 (IA) 影响全球5% 到 10% 的人群。目前治疗 IA 的方法包括开颅夹闭术以及血管内栓塞术或流量导向术。血流导向支架 (FDS) 是一种较新且越来越受欢迎的治疗选择,可以让医生避免在脆弱的动脉瘤囊内操作器械。
FDS是一种具有高金属覆盖率的器械,可以覆盖动脉瘤颈部,从而改变血流方向使之远离动脉瘤囊腔。这会导致动脉瘤内血流停滞,进而形成血栓,最终使支架与动脉瘤颈部内皮化,实现永久性闭塞。血流导向装置的缺点是这些器械具有较高的血栓形成倾向,需要终身应用抗血小板药物,同时也无法进入持续存在的动脉瘤囊腔进行再次治疗。根据不同器械,血流导向术一年后动脉瘤持续存在的比例在25%至40%之间。这可能反映了器械设计的差异,包括孔径大小、孔密度以及支架材料和层数等,从而导致内皮化能力不同。此外,利用无创影像学检查如CTA或MRA得到的随访信息也有限,常需要患者接受更加有创的数字减影血管造影(DSA)检查。为了减轻动脉瘤持续存在的一些挑战,并在必要时便于对囊腔进行再次治疗,部分或完全可生物降解的FDS被提出作为潜在的解决方案。
ReSolv支架(Fluid Biomed, Calgary, Canada)是一种新型的混合聚合物为主的血流导向支架,其结构中只有少量金属成分,目前正处于研发阶段。该支架由至少40根聚左旋乳酸(PLLA)生物可降解纤维和最多8根铂金为主的不透射线丝组成,释放方式与金属血流导向支架类似。初步结果显示,该支架具有良好的血管重塑性,包括机械表现和血液相容性。一项前期临床研究也表明,ReSolv支架在体内和体外能够立即实现良好的血流导向特性。然而,使用ReSolv支架治疗动脉瘤后中期闭塞率尚未报道。因此,本研究的目的是评估ReSolv支架在兔侧壁动脉瘤模型中的血管造影效果,并描述其对载瘤血管和覆盖分支的影响。
方法
动脉瘤模型
这些研究获得了我们机构动物护理和使用委员会的批准(Protocol AC21-0119)。在本研究中共纳入15只(8只母,7只公)新西兰白兔,研究开始时平均体重2.85 ± 0.35 kg。动物被分配至以下血管造影随访时间点:1个月(n=1, 1公),3个月(n=4,2公2母),6个月(n=2,2母),9个月(n=3,2母1公),12个月(n=2,2公),16个月(n=1,1母),18个月(n=2,1公1母)。12个月组中1只动物因瘤体尖端发出气管分支而被后续排除。这项研究是基于一项正在进行的纵向调查,记录了聚合物支架随时间的吸收情况。因此,随访和终止的时间点不同,因为随访血管造影只能做两次(一次在指定的随访间隔,一次在终止时)。
手术前,动物依次给予了乙酰丙嗪(0.15 mg/kg IV)、异氟醚(1-5% in 100% O2)、美洛昔康(0.4 mg/kg SQ)和丁丙诺啡(0.03 mg/kg SQ)。在手术过程中,对兔进行插管并在100%氧气中维持2-3%异氟烷,持续监测心电图数据、动脉压、血氧饱和度和温度。
在无菌条件下,根据之前发表的方法,在所有兔子中建立了侧壁囊状动脉瘤。简单地说,暴露右侧颈总动脉(RCCA)并在头臂动脉分叉附近临时夹闭。在离分叉4厘米处结扎RCCA,将24号血管导管逆行置入管腔。将大约0.6 mL 50:50的弹性蛋白酶 (~ 4 u/mgP和~ 25 mgP/mL)和0.5 M CaCl2的混合物通过导管注入隔离的RCCA段。经过20分钟的孵育期后,在导管插入点近端将血管结扎,切断两个结扎点之间的远端段,并去除临时夹闭,使隔离的血管段重新得到灌注。关闭前,用生理盐水冲洗该区域。然后采用4-0 vicryl缝合物分层缝合切口,并在动物恢复期间进行监测。另外两剂丁丙诺啡和一剂美洛昔康用于术后镇痛。
支架释放和随访血管造影
动脉瘤形成后至少4周,进行支架置入手术。支架置入前一周,兔子无限期给予ASA (10 mg/kg, PO,每日),并在支架置入后6个月给予氯吡格雷(10 mg/kg, PO,每日)。在手术当天,按照动脉瘤形成程序对动物进行麻醉,并在动脉内给予100 U/kg肝素。采用无菌技术,切开并远端结扎了右侧股动脉。在结扎处稍近侧,置入了6 French(6F)血管鞘。插入6F导管和0.035英寸导丝并在透视下推送到升主动脉。使用100%碘化造影剂(Omnipaque 350)和OEC 980°C型臂透视X射线机器(General Electric)进行了头臂动脉数字减影血管造影(DSA)。视野中可见测量参考物。一旦确认动脉瘤形成后,将微导管插入导引导管,并在0.014英寸微导丝的引导下进入右侧锁骨下动脉。将ReSolv支架通过微导管hub导入并通过微导管植入并释放覆盖动脉瘤颈部。移除微导管后,通过导引导管进行了支架植入后的DSA检查。在植入10分钟后,再次进行DSA检查,以记录支架内可能发生的任何延迟性血栓形成。最后,移除导引导管和血管鞘,采用4-0 vicryl缝合物分层缝合切口。动物恢复过程同上述描述。
在随访时间点,再次使用上述技术对动物进行麻醉。通过切开进入股动脉,并置入4 French (4F)鞘。一根4F导管在导丝引导下穿过主动脉弓,并造影获得DSA图像。移除导引导管和鞘,缝合股动脉切口,并按上述方法进行术后镇痛。
血管造影分析
在支架植入前,使用数字减影血管造影(DSA)图像测量了载瘤血管和动脉瘤的基线特征,包括载瘤血管直径、动脉瘤高度、宽度、颈部尺寸和体积。对于其余的血管造影分析,使用在线调查的方式,将最终随访时获得的支架植入前后的DSA图像呈现给一位来自独立机构、对随访时间不知情的执业介入神经放射专家。评估血管造影图像的安全性(支架内狭窄、主血管和被覆盖分支的通畅性、支架贴壁性)和有效性(动脉瘤闭塞)。
安全性的评估方式如下:根据改良的北美症状性颈动脉内膜切除术试验(NASCET)标准,将支架内狭窄分为轻度(0-49%)、中度(50-69%)或重度(70-99%),其中中度或重度被认为是显著性狭窄。采用基于Fitzgibbon通畅性评分的简化评分系统,将载瘤血管和被覆盖分支的通畅性评级为1级(通畅,无管腔内不规则)、2级(通畅伴中度管腔不规则)或3级(通畅伴严重的管腔不规则)。使用改良的三分评分法(基于Rouchaud等人的方法),将支架贴壁情况分为良好(支架覆盖的动脉>80%贴壁良好)、中等(支架覆盖的动脉50%-80%贴壁良好)或较差(支架覆盖的动脉<50%贴壁良好)。
主要疗效结果通过Raymond-Roy闭塞分级进行(RROC)评估,分为I级(完全闭塞)、II级(颈部残余)或III级(动脉瘤残余)。次要疗效结果包括:O'Kelly Marotta (OKM)量表,其包括造影填充指标(A-动脉瘤完全显影[>95%]、B-瘤体部分显影[5-95%]、C-瘤颈残余[<5%]或D-完全闭塞[0%])和淤滞指标(1-无淤滞,造影剂从动脉期到毛细血管期前就消失;2-中度淤滞,造影剂在静脉期前消失;或3-明显淤滞,造影剂在动脉瘤内持续至静脉期及以后)。4F Flow diversion Predictive Score (4F-FPS)评价系统,根据入射血流(有[0分] vs无[2分])、动脉瘤残余充盈(≥50%[0分] vs <50%[1分])、造影剂淤滞时间(动脉期或毛细血管期[0分] vs 静脉期[1分])和动脉瘤形态(梭形[0分] vs囊状[1分])评分,该评分已被证明可预测动脉瘤闭塞情况。根据既往文献,认为满意的血管造影闭塞为RROC I或II级、OKM填充评分C或D,或4F-FPS评分4或5。
结果
基线特征
在13只兔子中,每只动物都植入了1个支架;剩下的1只兔子需要植入2个重叠的支架,以确保合适地覆盖动脉瘤颈部(每只动物平均植入1.08 ± 0.28个支架)。由于不透射线检查设备出现技术问题,1只兔子的第0天影像资料因无法查阅以评估基线特征。对于其余兔子,支架植入前血管直径的平均值为3.50 ± 0.40 mm,动脉瘤尺寸为高4.48 ± 1.50 mm、宽2.63 ± 0.72 mm、颈部尺寸3.18 ± 1.00 mm,体积为19.48 ± 12.69 mm³。血管造影随访时间范围为1至18个月,中位时间为7.5个月,与之前动物和人体研究中报道的血流导向装置相似。
安全性
在可供评估的12/14例支架植入后10分钟的血管造影中(2例因不透射线检查设备技术问题未进行造影),未发现支架内出现延迟性血栓形成。对于安全性评估,所有14只兔子的随访血管造影均可查阅。对于所有受试动物,支架内狭窄程度被评为轻度(0-49%),"支架贴壁性"被评为良好。92.9%(13/14)的病例载瘤血管通畅性被评为1级,仅7.1%(1/14)出现中度管腔不规则(评为2级)。所有被支架覆盖的分支的通畅性(33/33)被评为1级。
有效性
所有14只兔子的随访血管造影均可用于疗效评估。根据RROC评分标准,64.3%(9/14)的兔子被评为I级(完全闭塞)、21.4%(3/14)的兔子被评为II级(瘤颈残余)、14.3%(2/14)的兔子被评为III级(动脉瘤残余)(见表1)。根据主要疗效终点评价,85.7%的病例表现出了充分血管造影闭塞情况。图1详细列举了各随访组的RROC评分结果。

表1:在中位随访7.5个月后,对14例兔囊状侧壁动脉瘤置入ReSolv支架后的RROC、OKM和4F-FPS动脉瘤评估评分
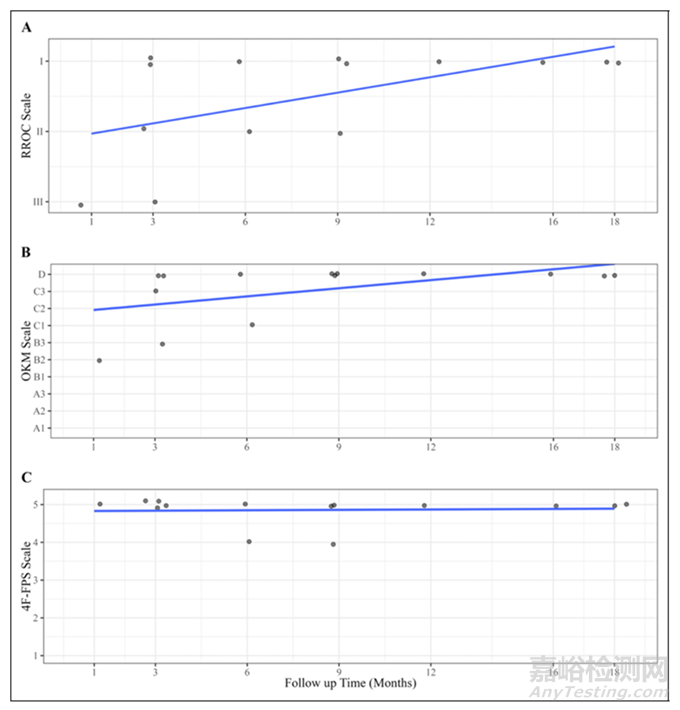
图1:RROC量表(A)、OKM量表(B)和4F-FPS量表(C)的得分随随访时间(月)的变化呈最佳拟合(R2分别为0.31、0.28和<0.01)。每个点表示在指定的时间点上的一只兔子。为了使单个分数可视化,数据是抖动的
根据OKM评分标准,64.3%(9/14)的兔子被评为D级,7.1%(1/14)被评为C3级,14.3%(2/14)被评为C1级,7.1%(1/14)被评为B3级,7.1%(1/14)被评为B2级(见表1)。根据4F-FPS评分标准,85.7%(12/14)的兔子得分为5分,14.3%(2/14)得分为4分。因此,基于OKM量表,85.7%(12/14)被认为达到充分的闭塞,而基于4F-FPS量表,100%(14/14)被认为达到充分闭塞。图1详细列举了各随访组的疗效评分结果。
讨论
金属血流导向装置(FDS)是在弹簧圈栓塞术引入之后被开发的,用于解决宽颈动脉瘤的治疗难题以及外科夹闭术的较高并发症率。2011年,Pipeline栓塞装置(PED)(Medtronic, Irvine, CA, USA)首次获得FDA批准。但使用受到基于患者年龄、动脉瘤部位和颈部特征的限制。PREMIER试验证实了PED在141名患者中的疗效,12个月随访时84%的动脉瘤达到RROC I级或II级。同样地,Surpass SCENT试验显示75.5%的病例达到RROC I级或II级,而FRED关键性研究则在12个月时报告了80%的结果。
已商业化的血流导向装置(FDS)存在一些主要问题,包括需要大面积金属表面覆盖(占器械总表面积的30-35%)来实现充分血流导向作用,这可能导致血栓栓塞并发症,直到支架完全内皮化内嵌血管壁并覆盖动脉瘤颈部。由于内膜增生引起的支架内狭窄也是支架引起动脉损伤的相关问题。血栓形成和新内膜增生可能引起血管狭窄和/或闭塞,从而导致缺血或卒中。FDS植入后发生重大或轻微卒中的发生率在2%到12%之间,而商业化FDS植入1年后出现显著(>50%)支架内狭窄的发生率在2.9%到4.3%之间。新型支架材料(包括生物可降解聚合物)能够在保持同等或更高疗效的同时降低这些并发症发生率,仍有待确定。
先前发表的关于新型混合聚合物-金属血流导向装置(FDS)的报告显示,该装置在体外和体内具有与金属支架相当的即刻血流导向特性。在本研究中,我们以独立观察者的盲法评估了同一支架在兔子侧壁动脉瘤模型中的中期体内安全性和疗效。我们的结果显示,根据主要疗效终点RROC I级或II级评分,85.7%达到充分闭塞率。根据次要疗效终点OKM和4F-FPS评分,分别有85.7%和100%的动脉瘤达到充分闭塞。在2例根据OKM评分未能达到充分闭塞的动脉瘤中,两者4F-FPS评分均为5分,但随访时间较短(1个月和3个月)。图2展示了相应的DSA图像及其RROC和4F-FPS评分。如果4F-FPS评分在人体模型中的预测性(平均随访9个月时闭塞率98%)能够转化到该体内模型,则表明这两例案例在更长时间后很可能达到OKM评分中充分闭塞的标准。
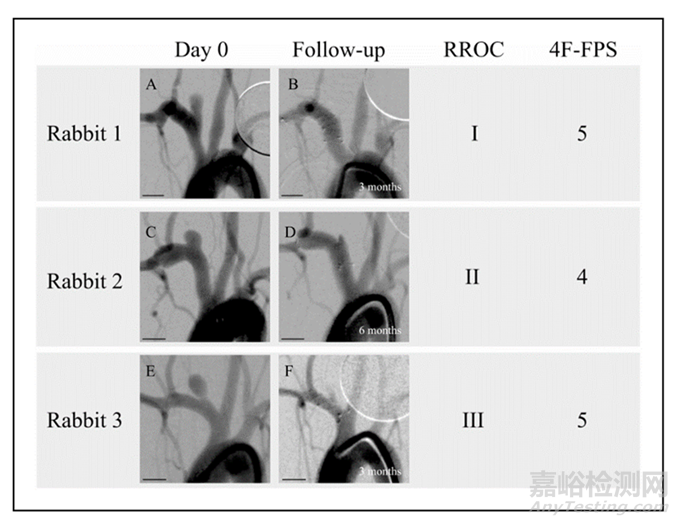
图2:三位兔侧壁动脉瘤在治疗(A、C、E)和随访(B、D、F)时的数字减影血管造影(DSA)图像,由不知道随访时间点的独立观察者根据Raymond-Roy和4F-FPS评分系统进行评估。比例尺的长度为5毫米。(A)兔1的治疗。(B) 兔1的3个月随访。(C)兔2的治疗。(D)兔2的6个月随访。(E)兔3的治疗。(F) 兔3的3个月随访。
本研究的疗效结果与之前研究金属血路导向装置(FDS)的前期临床试验结果相当。Fahed等人对兔子弹性蛋白酶动脉瘤模型中FDS治疗后的动脉瘤闭塞进行了meta分析,发现1个月后充分闭塞率为79.2%,3个月后为73.5%,6个月后为96.7%,12个月后为66.7%。对已商业化FDS(如PED)的前期研究显示,动脉瘤闭塞率高于Fahed等人的平均充分闭塞率;在中位随访3个月时,该装置的第二代产品完全闭塞率达94%,不完全闭塞率为6%。这些结果与本研究的发现相似,本研究发现中位随访7.5个月时总体充分闭塞率为85.7%。
文献中很少有其他关于生物可降解血流导向装置(FDS)在兔模型中疗效的研究。Nishi等人发表了关于一种48股聚乳酸(PLLA)生物降解FDS原型在17例兔囊状动脉瘤中的结果。然而,他们研究中使用的支架在释放后需要球囊扩张,这与本研究使用的ReSolv支架不同。在中位随访3个月时,他们观察到总体充分闭塞率(完全闭塞或颈部残余)为64.7%(11/17)。同一研究小组(Sasaki等人)最近的一项研究比较了他们第二代PLLA-FDS与钴铬合金FDS,在中位随访6个月时,充分闭塞率分别为57%和47%。
在安全性方面,我们的研究显示所有载瘤动脉和被覆盖分支均通畅,只有1例出现中度管腔不规则,没有出现延迟性血栓。同样,Nishi等人和Sasaki等人的研究也显示所有分支血管完全通畅,没有出现远端动脉闭塞或血栓形成。尽管我们的研究,Nishi等人的研究以及Sasaki等人的研究都没有对动物进行超过PLLA开始吸收的时间点(约1.5-2年,取决于具体材料特性)的长期随访,但生物可降解支架在兔动脉瘤模型中的中期安全性似乎是可接受的。我们实验室正在进行更长期的研究,以评估这些支架在聚合物成分吸收期间及之后的安全性和疗效。
这项研究存在几个局限性,例如样本量较小。不同随访时间点动物数量分布不均也限制了组间比较和动脉瘤闭塞率随时间变化的分析。但值得考虑的是,这些研究结果类似于真实世界患者数据的采集,必须应对随访时间点和各组患者分布不均的情况。此外,本研究的设计也存在两个局限性:首先,并不是所有的动物都在随访时间点被处死,这限制了潜在的更明确的组织学结果评估;二是缺乏以金属血流导向装置为对照组,无法直接比较ReSolv支架和现有商业化的血流导向装置。最后,本研究使用定性评估量表来确定动脉瘤闭塞状态,这具有一定主观性,可能影响结果的可靠性。但基于血管造影的动脉瘤治疗疗效评估量表本质上都存在一定主观性,并被广泛应用于血流导向装置治疗的结果报告中。此外,本研究中对血管造影数据进行解读的神经介入医生是在盲法情况下进行,这有助于减少潜在偏倚。
总结
总之,新型聚合物和金属混合的ReSolv支架在兔侧壁囊性动脉瘤模型中显示出令人振奋的血管造影安全性和治疗效果,可与市售的金属血流导向装置相媲美。正在进行的长期研究将确定支架聚合物成分吸收后,动脉瘤、载瘤动脉和分支血管的最终结局。

来源:TRA of Neuro


