您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-01 09:09
为了评估射频场引起的植入物周围组织的热效应,多数情况下需要进行植入物电磁建模和虚拟人体仿真[5]。电磁模型准确与否直接影响最终的评价结果,因此,需要在体外体模中对电磁模型进行验证。而体外的电磁模型验证需要相应的射频测试环境。
虽然ISO/TS 10974[6]和ASTM F2182[7]允许使用磁共振整机设备作为射频测试环境,但由于磁共振整机设备同时具有强磁环境,试验操作不便,而且当序列扫描采用射频匀场策略时,会偏离圆极化[8-9],给测试环境电场验证带来很大的困难。因此,在射频热效应评估中,最好采用单独的射频发生系统构建测试环境。
目前,构建射频测试环境有2种策略:①选用Zurich Med Tech公司的商用MITS系统;②自行定制开发。采用商用系统的优势是方便快捷,但价格昂贵,无法满足定制化需求,二次开发困难。考虑到个性化的研究需求和成本因素,本研究选择第2种策略,即自行定制开发。
考虑到射频测试环境应同时具备射频场发生、电磁场量测和电磁探棒定位3种主要功能,本研究构建了由射频发生系统、电磁场量测系统和机械臂定位系统构成的硬件环境,并使用基于Python的软件开发平台构建了自动化控制软件环境,实现了高精度、自动化的集成测试环境构建。
1、总体方案设计
本研究的主要目的是构建用于植入物电磁模型验证的测试环境,根据ISO/TS 10974[6]的要求,模型验证需要将被测植入物置于明确定义的、具有重复性的辐射电磁场测试环境中,通过比对测试环境中的测量结果和仿真结果的一致性,来验证植入物电磁模型。
基于以上测试需求,测试环境至少应包含3套基本的硬件系统:①射频场发生系统,用于产生测试所需的电磁场;②电磁场量测系统,用于电磁场的测量和标定;③电磁探棒定位系统,用于调节测量点的空间位置。
除了硬件系统,软件环境的构建也至关重要。各硬件系统通过局域网(local area network,LAN)连接至PC上位机,由上位机软件统一对其进行控制,实现射频场控制、机械臂运行控制和电磁量测控制等功能,从而形成三位一体的集成测试环境。测试系统总体设计框架如图1所示。
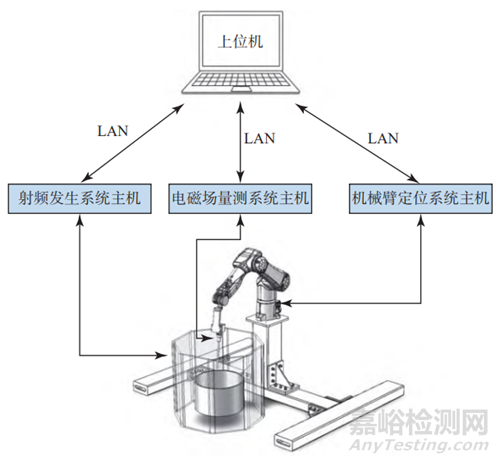
图1 测试系统总体设计框架
Fig.1 Test system design framework
2、硬件环境构建
2.1 硬件环境构成
为构建射频场发生系统的硬件环境,本研究选用由鑫高益公司定制开发的RF15型号的射频发生系统,用于在射频线圈中产生64 MHz的射频场。选用SPEAG公司的EASY4电磁量测系统,该系统提供开放的TCP/IP协议连接至上位机。由于电磁场的空间分布较为复杂,电磁探棒的位置精度直接关系到测量结果的准确性,因此需要引入高精度的定位系统。考虑到目标区域的范围及操作灵活性,选用史陶比尔公司的TX2系列工业机器臂进行电磁探棒的定位,具有高可靠性和良好的抗电磁干扰能力,重复定位精度为±0.03mm。
上述3套系统通过LAN与PC上位机建立连接,形成整体硬件环境。
2.2 工作环境坐标系转换
在硬件环境的构建中,要实现电磁探棒高精度定位,关键环节是工作环境坐标系的转换,即将基于射频线圈的坐标系转换到机械臂坐标系。
本研究选用射频线圈顶部圈口上的3个定位柱( P1、P2、P3)作为坐标系转换的基准点(见图2(a)),由于已知射频线圈的孔径和高度,仅需确定P1、P2、P3共圆的圆平面,射频线圈的三维模型即可在机械臂坐标系中建立起来,这样射频线圈内部的任意目标点都可转换到机械臂坐标系中。
具体计算过程如下:
1)求P1,P2,P3共圆的圆心O:令圆心O坐标为(x0,y0,z0),P1坐标为(x1,y1,z1),P2坐标为(x2,y2,z2),P3坐标为(x3,y3,z3),由空间三点P1、P2、P3确定的平面记为平面a,圆半径记为,则圆心O为:
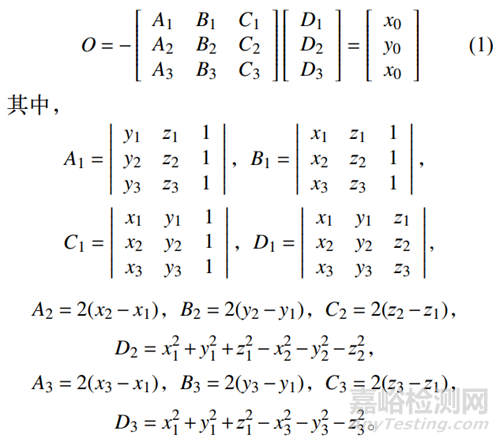
2)计算平面a法向量Vn:

3)定义机械臂坐标系xO'y平面法向量为V'n。
4)定义点集V0、V1:

其中,R坐标为 (r,0,0)。
5)将圆心O平移至机械臂坐标原点O'。
6)根据KABSCH的算法V0、V1[10],计算点集 ~的旋转矩阵:
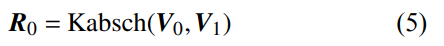
7)计算最终坐标转换结果:射频线圈坐标系中的坐标记为K0,转换到机械臂坐标系中的坐标记为K1,则

上述坐标转换过程如图2(b)所示,其中步骤①展示的是确定O、Vn和V'n,步骤②展示的是将圆心O平移至机械臂坐标原点O',步骤③展示的是通过旋转矩阵进行坐标变换。同理,也可将机械臂坐标系中的坐标转回到射频线圈坐标系。
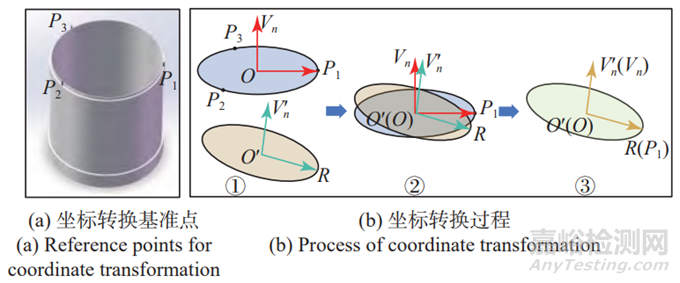
图2 坐标转换示意
Fig.2 Coordinate transformation diagram
3、软件环境构建
根据测试需求,与硬件环境相对应,软件模块主要包括射频发生模块、电磁场量测模块和机械臂控制模块(见图3),分别用来实现射频场控制、射频场量测和机械臂运行控制三大功能。软件环境的构建是将以上3个模块集成在一个软件平台,形成用于射频场热效应评估的集成测试环境,统一进行测试流程的自动化管理和控制。
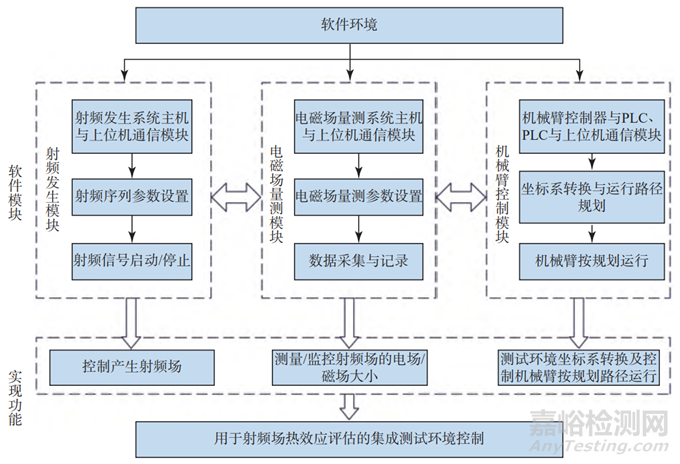
图3 软件模块设计
Fig.3 The framework of software module design
本研究采用基于Python的软件开发平台进行软件环境的构建。Python是一种开源语言,相关库资源丰富,开发便捷高效。图4是基于Python开发平台构建的自动化控制软件界面。
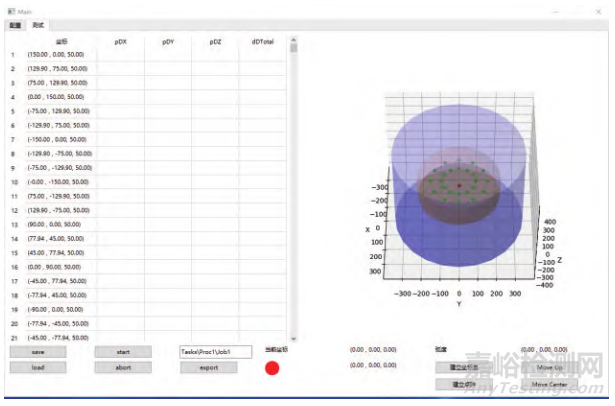
图4 软件界面设计
Fig.4 Software interface design
4、测试验证与结果分析
为了对构建的测试环境进行验证,将仿真电场与测试环境中实测电场进行了比对分析。
4.1 电场实测
按照图1所示搭建测试环境。射频发生系统的射频线圈内部放置一个圆形体模,体模中液体为盐水[电导率(0.47±10%) S/m],盐水中心与线圈中心对齐,盐水体模直径为44 cm,高度为20cm。开启射频发生系统,产生射频环境,机械臂夹持电场量测探棒到达体模中指定位置,便可直接读取该位点处的电场值。
4.2 电场仿真
使 用 时 域 有 限 差 分( finite-difference time-domain,FDTD)算法进行射频线圈内电磁场的仿真。仿真中采用与实际射频线圈同样结构和尺寸的16腿的高通鸟笼线圈(见图5)。
盐水体模的尺寸参数与实际测试环境中的体模保持一致。盐水电导率设置为0.47 S/m,相对介电常数设置为78。网格大小设置为2 mm,边界条件设置为吸收边界。线圈使用64 MHz正弦信号作为激励信号,调节线圈上的电容值,使其在64 MHz的频率下谐振。
4.3 实测电场与仿真电场比对
从仿真结果中提取体模中心层面上的电场,其分布如图6(a)所示。为了验证测试环境中实际电场与仿真的一致性,选取体模中心层面,半径分别为r=16 cm和r=8 cm的圆环上的24个点作为校准点,使用电场量测探棒对校准点处的电场进行实测,同时也提取上述位点的仿真电场。

图5 高通鸟笼线圈
Fig.5 High-pass birdcage coil
由于仿真中很难直接将激励源大小设置成与实际测试环境完全一致,为了在同一尺度下对仿真电场值和实测电场值进行比对,需要对其进行归一化处理。选取r=16 cm,标号为1的校准点的数据,计算仿真电场值与实测电场值之间的比例因子,将所有点位的仿真电场值按照上述比例因子进行缩放,结果如图6(b)所示。从图中可以看出,仿真电场与实测电场的数值具有良好的一致性。经分析,24个校准点的仿真与实测电场值之间的最大偏差为11.97%,最小偏差为0%,平均偏差为5.85%。
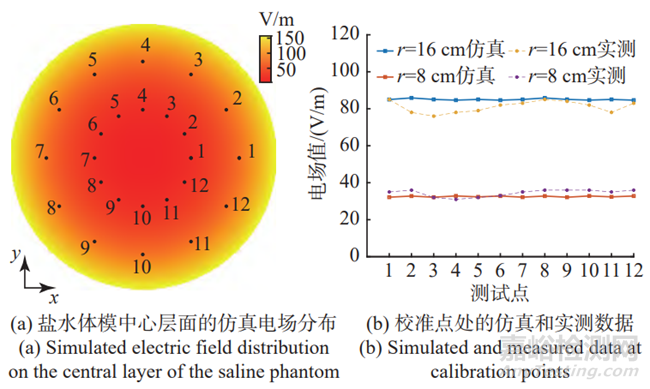
图6 仿真和实测数据对比
Fig.6 Comparison of the simulated and measured data
5、结论
本研究采用机械臂定位技术和基于Python的软件开发平台,完成了高精度自动化的集成射频测试环境构建工作。本测试环境形成的电场与计算机仿真得到的电场可实现良好匹配,为植入物射频热效应评估奠定了良好的基础。同时,本研究也为希望采用定制化开发路线进行射频测试环境构建的企业和研究机构提供了清晰的技术路线,填补了国内该领域的空白。
目前,本研究仅提出了64 MHz(1.5 T)射频环境的构建方案,针对3T磁共振设备及其对应的128 MHz射频环境等热点问题将在后续研究中持续开展。
参考文献
[1] AISSANI S, LAISTLER E, FELBLINGER J. MR safetyassessment of active implantable medical devices[J].Radiologe, 2019, 59(Suppl 1): 40-45.
[2] JABEHDAR MARALANI P, SCHIEDA N, HECHT E M, et al. MRI safety and devices: an update and expertconsensus[J]. J Magn Reson Imaging, 2020, 51(3): 657-674.
[3] HENDERSON J M, TKACH J, PHILLIPS M, et al. Permanent neurological deficit related to magnetic resonance imaging in a patient with implanted deep brainstimulation electrodes for Parkinson's disease: case report[J]. Neurosurgery, 2005, 57(5): E1063.
[4] WINTER L, SEIFERT F, ZILBERTI L, et al. MRI-related heating of implants and devices: a review[J]. JMagn Reson Imaging, 2021, 53(6): 1646-1665.
[5] KAINZ W, NEUFELD E, BOLCH W E, et al. Advancesin computational human phantoms and their applicationsin biomedical engineering−a topical review[J]. IEEETrans Radiat Plasma Med Sci, 2019, 3(1): 1-23.
[6] ISO. Assessment of the safety of magnetic resonanceimaging for patients with an active implantable medicaldevice: ISO/TS 10974: 2018[S]. Switzerland: IHS Markit,2018.
[7] ASTM. Standard test method for measurement of radiofrequency induced heating on or near passive implantsduring magnetic resonance imaging: ASTM F2182:2019e2[S]. United States: ASTM International, 2019.
[8] ZENG Q, WANG Q, KAINZ W, et al. Impact of RFshimming on RF-induced heating near implantablemedical electrodes in a 3T MRI coil[J]. IEEE TransElectromagn Compat, 2018, 62(1): 52-64.
[9] MCELCHERAN C E, GOLESTANIRAD L, IACONOMI, et al. Numerical simulations of realistic leadtrajectories and an experimental verification support theefficacy of parallel radiofrequency transmission to reduceheating of deep brain stimulation implants during MRI[J].Sci Rep, 2019, 9(1): 2124.
[10] KABSCH W. A solution for the best rotation to relate twosets of vectors[J]. Acta Crystallogr, 1976, 32(5): 922-923.
【文章来源】中国医疗器械杂志研究与论著 2024年 48卷 第3期

来源:Internet


