您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-15 18:49
医疗器械可用性是保障患者安全和提升治疗效果的关键。本文将从可用性法规要求、原理和工程过程等方面带您了解医疗器械可用性。
定义
可用性工程又称人因工程、人机工效学,是指运用人类的行为、能力、限制和其它特性等知识来设计医疗器械(含软件)、系统和任务,以获得足够的可用性。医疗器械可用性是指使医疗设备易学、高效、好记、容错和令人满意的人机接口特性。可用性旨在识别与正确使用和使用错误相关的风险。
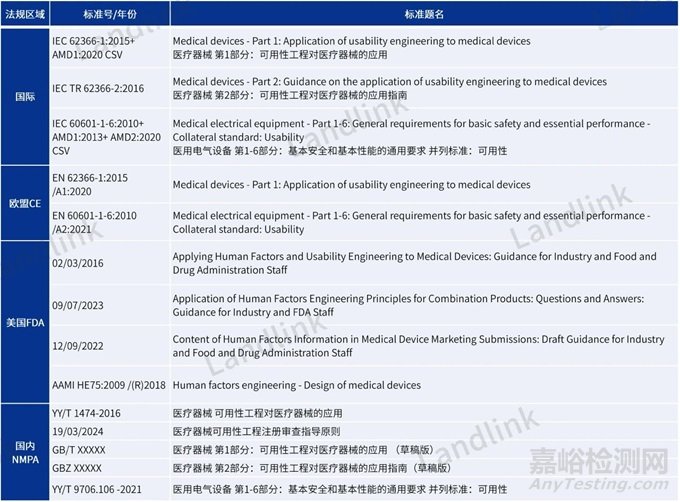
法规要求
原理
1、通用要求
可用性工程过程:
制造商应建立、实施和保持可用性工程过程(IEC 62366-1第5章所定义的)并将其形成文件,以便为患者、用户和其他人员提供安全。该过程应针对用户按照随附文件与医疗器械的交互,这包括(但不限于):运输、贮存、安装、运行、维护和维修、处置。
可用性工程活动:
医疗器械可用性工程活动应得到策划、执行并形成文件。
可⽤性⼯程参与⼈员:
基于教育、培训、技能或经验由能够胜任的人员进行
除可用性专家外,下列人员可以提高用户交互的可用性: 产品研发设计人员、生产制造人员、软件开发工程师、包装工程师;市场销售人员、售后服务人员;临床人员,医学研究人员。
可用性工程的三个核心要素:
User用户
Use scenario使用场景
User interface用户界面
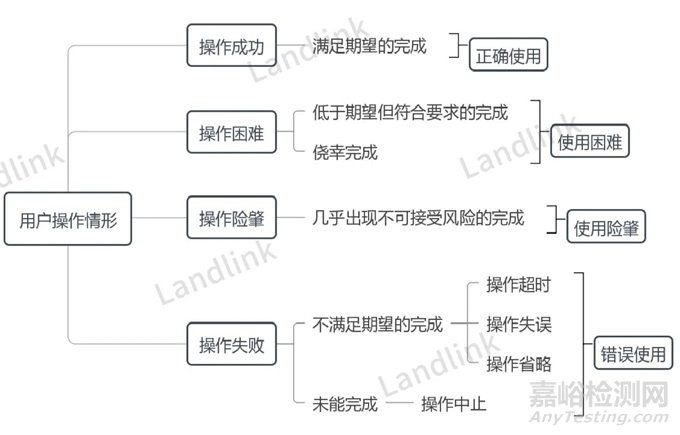
用户操作情形:
根据操作任务完成程度,将用户实际使用情况分为操作成功、操作困难、操作险肇、操作失败。
与用户接口设计有关的风险控制:
为降低与使用有关风险,制造商应按(ISO 14971风险管理对医疗器械的应用)所列的优先顺序使用一个或多个以下风险控制措施选项:
固有的安全设计和制造;
医疗器械上或制造过程中的防护措施;
安全信息和用户培训(适当时)。
与可用性有关的安全信息:
按照采取风险控制措施的优先顺序,当安全信息用作风险控制措施时,制造商应将该信息纳入可用性工程过程以确定该信息在预期的使用环境背景下,对于符合预期用户特征的用户:可感知、可理解、支持医疗器械的正确使用。
2、可用性工程文档
可用性工程过程的结果应保存在可用性工程文档中。构成可用性工程文档的记录和其他文件可以是其他文件和文档的一部分。
3、可用性工程工作的定制/裁剪
用于进行可用性工程过程的工作量水平以及方法和工具的选择可以不同,基于:
用户接口的规模和复杂程度;
与医疗器械使用相关伤害的严重度;
使用规范的范围和复杂程度;
未知来源用户接口的存在,UOUP;
对经受过可用性工程过程的现有医疗器械用户接口修改的程度。
可用性工程过程
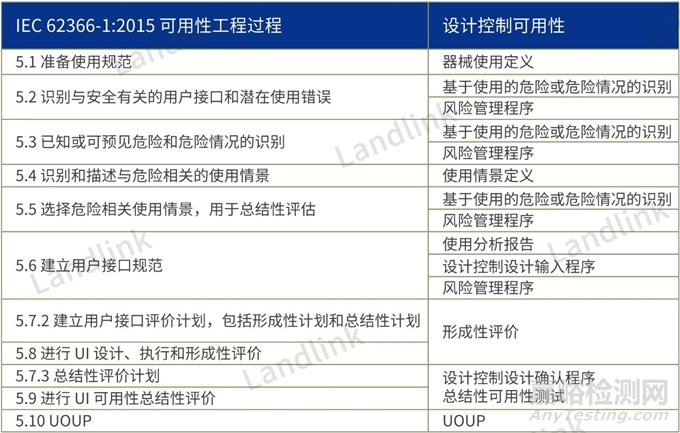
准备使用规范:
包括预期的医疗适应证;预期的患者群体; 预期应用的或与之交互的身体部位或组织类型;预期的用户特征;预期的使用环境;工作原理。
识别与安全有关的用户接口和潜在使用错误:
识别基本的操作功能及可能的使用错误。
识别与安全相关的用户接口及可能的使用错误。
已知或可预见危险和危险情况的识别:
制造商应识别可能影响患者、用户或其他人,与医疗器使用有关的已知或可预见的危险和危险情况。
该识别应按照ISO 14971风险管理的风险分析的一部分进行。
在识别危险和危险情况时,应考虑以下方面:
使用规范,包括用户特征;
如果可获得,相似类型医疗器械现有用户接口已知的危险和危险情况信息;
已识别的使用错误;
异常使用条件也应识别。
识别和描述与危险相关的使用情景:
制造商应识别和描述与所识别的危险和危险情况相关的可合理预见的与危险有关的使用场景。
所识别的每个与危险有关的使用场景的描述应包括所有任务及其顺序,以及相关伤害的严重度。
建立用户接口评价计划:
形成性评价(用户界面验证)
制造商可以规划进行多次形成性评价。
与总结性评价相比,通常规模较小且不正式,但随着设计从早期概念演变为一种与产品等同的原型,其往往会变得规模更大、更正式。
尽量选择让最后的形成性评价与总结性评价方法相匹配(即总结性评价计划的早期版本)。
最后一次形成性评价可以称为总结性预评价。是发现需要解决的任何剩余的用户接口缺陷的时机,以便在总结性评价期间不会发现新的问题
总结性评价(用户界面确认) - 可用性测试
可用性测试涉及在用户使用医疗器械执行任务时对其进行观察。招募代表性的用户组/用户,并要求这些用户完成相关的测试任务,涉及相关的使用场景进行。
每个用户组的测试参与人员数量原则上不少于15用户组。
可采用模拟测试,现场测试,第三方实验室测试(模拟测试)。
不能在临床试验中进行测试。
直接负责用户接口设计的人员不宜实施总结性评价。
测试期间可以通过音频和视频来记录,以使以后能够评审并确认或补充测试活动期间收集的数据。
可用性测试可以在最终的或与量产等同的用户接口上进行(完整的医疗器械)。
UOUP 未知来源用户接口的评价
可用IEC 62366-1中的附录C代替标准中5.1至5.9的全部要求对未知来源的用户接口(UOUP)进行评价。
使用规范
生产后信息的评审
与可用性有关的危险和危险情况
风险控制
剩余风险评价
将可用性工程项目形成文件
为与内部和外部利益相关者沟通,可以创建一份可用性工程报告以对可用性工程项目进行总结。重要的是, 可用性工程报告与总结性评价报告是不同的,但可用性工程报告宜引用总结性评价的结果。
生产后评审和分析
根据IS0 14971,风险管理过程要求进行生产后监督。
根据IEC 62366-1,所有使用错误都应在开发过程中的可用性评价中识别。
生产后监督过程可以提供丰富的客户投诉数据资源,可用于支持可用性工程活动。制造商能使用这些数据来识别与使用有关的问题,包括与使用错误有关的问题。
CE的PMCF中有系统性的误用和off-lable使用,有必要对这些可能的数据进行收集和分析。

来源:Internet


