您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-17 11:02
摘 要 Abstract
为应对全球复杂监管环境带来的挑战,推动医疗产品全球化监管协同,世界卫生组织(WHO)制定了一套统一的全球基准评估工具(GBT),并在此基础上发布WHO 列名监管机构(WLAs)清单,为监管机构获得全球认可提供透明且基于证据的途径。长久以来,我国高度关注与WHO 的交流合作,在疫苗监管和全球化领域已取得了丰硕的成果。在药品监管领域,我国已重塑了整个药品监管生态系统,具备了独立审查创新产品的能力,但在国际社会尚未形成普遍认知。本文从GBT 和WLAs 清单关注的监管透明度建设角度出发,探索分析我国药品监管体系面临的挑战,并提出改进建议,以期助力我国更加深入地融入全球监管协同、监管信赖的国际大趋势中。
To address the challenges posed by the complex global regulatory environment and promote global regulatory coordination of medical products, the World Health Organization (WHO) has developed a unified Global Benchmarking Tool (GBT) and released a list of WHO-Listed Authorities (WLAs). This provides a transparent and evidence-based path for regulatory agencies to gain global recognition. China has long prioritized exchanges and cooperation with the WHO, achieving fruitful results in vaccine regulation and globalization. In the field of drug regulation, China has reshaped its entire drug regulatory ecosystem and developed the ability to independently review innovative medical products, but these achievements have yet to gain widespread international recognition. From the perspective of regulatory transparency, which is a key focus o the GBT and WLAs, this article explores the challenges faced by China’s drug regulatory system and proposes suggestions to help China more deeply integrate into the international trend of regulatory collaboration and reliance.
关键词 Key words
全球基准评估工具;成熟度水平;世界卫生组织列名监管机构;监管能力评估;监管国际化;国际互信;透明度
Global Benchmarking Tool; maturity level; WHO-Listed Authorities; regulatory capacity assessment; regulatory internationalization; international mutual reliance; transparency
世界卫生组织(World Health Organization,WHO)是联合国系统内世界卫生问题的指导和协调机构,其职责在于引导全球公共卫生事务,拟定全球卫生研究议程,制定相关规范和标准,向成员国提供所需的技术支撑,以及监测和评估全球卫生趋势[1]。WHO 官方调查统计显示,截至2022 年4 月,其194 个成员国中约71% 缺乏能够满足人民健康需求的药品监管体系,且难以耗费大量人力、物力和财力筹建一个运行良好的监管系统,绝大多数国家和地区仍需要依赖其他值得信赖的成熟监管体系国家或地区的监管决策结果作为其药品注册审批的参考依据[2]。
对此,早在1997 年,WHO就开始制定并发布评估指标用于评估监管系统的体系和能力,后将其作为申请疫苗预认证(prequalification,PQ) 的先决条件,为欠发达国家和地区药品监管部门的审批、联合国采购等提供指引。在多年的评估实践中,WHO 不断优化、多次调整其评估指标,于2014 年着手开发适用于药品和疫苗的统一评估指标,并于2016 年正式引入了药品和疫苗全球基准评估工具(Global Benchmarking Tool,GBT)(现行为2021 年修订第六版)。GBT不仅能够帮助WHO 评估医疗产品的监管制度,各成员国监管部门也能使用其对监管体系进行自评估,以实现提升和改进。在GBT 评估基础上,WHO 进一步发布了列名监管机构(WHO Listed Authorities,WLAs) 标准和清单供全球参考,其本质上是一种国际资质认可,目的是推进国际监管协同。
目前, 我国监管机构的国际化认可水平仍处于起步阶段,疫苗国家监管体系先行一步,被WHO 评为监管成熟度水平(maturity level,ML)3 级;药品国家监管体系尚未获得相关认证。需要看到,我国药品研发管线和上市新药数量均稳居全球第二梯队之首,药品监管体系建设取得了飞跃式进步,但我国药品监管决策结果尚不能在国际社会获得认可,我国创新药出口仍任重道远。
1、 WHO 致力于推动基于证据的国际协同
1.1 监管机构能力评估
根据药品监管全生命周期各个环节监管能力、资源配备和监管要点的要求,WHO 将GBT 指标分为9 个模块,62 个相关指标,268 个子指标[3], 从而基于证据实现对药品、疫苗等医疗产品国家整体监管体系和相关组成部门的监管职能的系统性评估,即ML 评估。9 个模块分别为:国家监管体系(National Regulatory System,RS)、注册和上市许可(Registration and Marketing Authorization,MA)、临床试验监管(Clinical Trials Oversight,CT)、实验室检验(Laboratory Testing,LT)、市场监管(Market Surveillance and Control,MC)、药物警戒(Vigilance,VL)、监督检查(Regulatory Inspection,RI)、机构许可(Licensing Establishments,LI) 及批签发(NRA Lot Release,LR)。268 个子指标可进一步分为1~4级,其中ML4 级为最高级别指标,代表达到先进水平且已具备在持续改进的监管体系中应当具备的能力要素;ML3 级代表具备稳定、功能良好、一体化的监管体系,该级子指标数量最多,占比达56%,是逐步构建较为健全的国家监管体系并能够实现充分履行监管职能的关键要素;ML1级和ML2 级代表存在监管体系某些要素及满足部分执行基本监管职能的国家监管体系应当满足的要求(表1)。
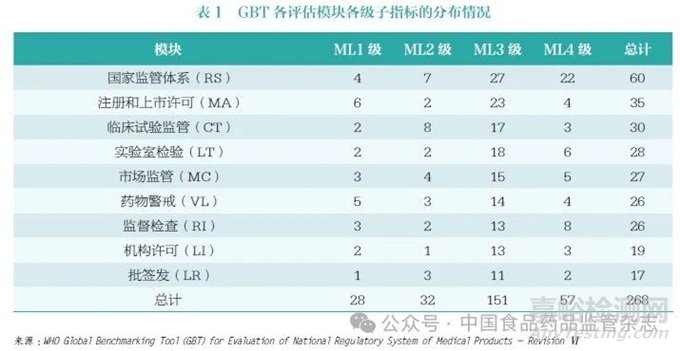
WHO 对监管机构的评估基于自愿原则,有意愿的监管机构提出申请, 随后WHO 基于证据对申报监管机构每个级别子指标的完成情况进行评估,最终确认监管机构ML 水平。如以认证为ML3 级为评估目标,需要所有ML1 级和ML2 级子指标以及不少于90% 的ML3 级子指标达到完全实施。评估为ML3 级和ML4 级的监管机构代表有较高水平的监管能力。在WHO 194个成员国中,只有56 个(占比29%)被认为能够达到ML3 级和ML4 级, 其他138 个( 占比71%)监管体系欠佳(表2)[2]。

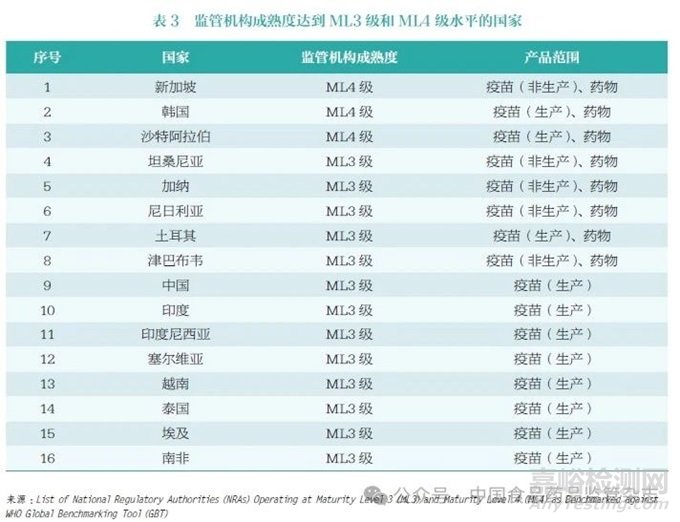
目前,全球仅有16 个国家正式申请并通过了WHO GBT 评估, 被评为ML3 级或ML4 级,涉及16 个疫苗监管体系、8 个药品监管体系(表3)。其中,新加坡药品监管机构积极推动,成为全球首个获WHO 最高评级(ML4 级)国家监管机构;韩国、沙特阿拉伯是全球唯二同时在药品和疫苗(生产)方面达到ML4级水平的国家;另有土耳其、加纳、尼日利亚、坦桑尼亚、津巴布韦5 个发展中国家的疫苗和药品监管体系达到ML3 级水平。2022年,我国第3 次通过WHO 疫苗领域评估,确认疫苗国家监管体系达到ML3 级水平[4]。当然我国在药品监管体系成熟度方面仍有较大提升空间,未来在药品国际化认可方面仍有较长的路要走。
1.2 达到ML3 级和ML4级是列为WLAs 的前提
GBT 评估是监管机构在全球范围内进行统一评估的基础,能有效识别监管机构的优势与差距,并帮助其进行持续改进。WHO认为出于推进全球化监管信赖与依赖的目的,需要引入一套更加全面的监管机构评估体系,以促进监管机构之间的合作和信息共享,加强全球监管体系的连通性和一致性。经GBT 评估并公开为ML3 级和ML4 级的监管机构,再次评估符合WHO WLAs 要求后,代表该国家监管体系在质量和标准上达到了国际水平,可被列为WLAs,以供全球参考。
因此,WLAs 诞生的重要意义在于逐步取代以往WHO 各个指导原则、技术标准, 以及在全球采购和国际监管互信与依赖实践中广泛运用的严格监管机构(Stringent Regulatory Authorities,SRAs)的概念。同时,由于WLAs 是建立在证据基础上的推动国际认可、互信的体系,在监管能力方面,WLAs 与SRAs 名单内机构监管能力相同,且在监管透明度和基于证据进行决策方面优于SRAs[5]。
在国际协调与互信实践中,GBT 评估和WLAs 列名在全球推广应用效果良好。例如,WHO 引入WLAs 用以替代SRAs,成为WHO 秘书处和全球基金各种全球药品采购程序的可信赖监管机构库;东盟联合评估程序将参考国家监管机构资质条件设置产品分类为获得WHOPQ 认证产品、SRAs 名单中国家监管机构批准产品以及被评为ML3 级或ML4 级的监管机构批准产品。
1.3 WLAs 效能评估框架概述
WLAs 效能评估框架( performance evaluation framework,PEF) 是在GBT基础上建立的( 图1)。国家监管机构(national regulatoryauthority,NRA) 及监管机构(regulatory authority,RA) 若想被列为WLAs, 除需要通过GBT 评估外, 还需要通过3 项评估程序:①满足相关模块中所有GBT ML3 级子指标(151 个)和强制性的GBT ML4 级子指标(36 个) 要求,ML3 级和ML4级监管机构若想被列为WLAs,则必须符合特定ML4 级子指标要求。②满足相关模块中的效能评估(performance evaluation,PE)指标要求。③满足相关模块中PE 工具要求。

GBT 中ML3 级和ML4 级子指标的设置致力于促进药品监管质量管理规范(good regulatory practice,GRP)的实施,关注风险管理理念和外部控制机制,以保证国家监管的效率、透明度、一致性及灵活性。PE 指标关注监管体系中所有监管机构的职能实施和产出,在实际评估过程中,监管机构能够提供的证据越多,评估流程就越快。利用PE工具根据不同模块的特点进行评估,如:针对MA、CT 及LT 模块设计专家评估量表,组建专家小组进行评估;针对VL 模块进行实地考察;针对RI 模块通过设计检查员评估量表对GxP 实施执行过程进行观察审计。由此形成了WLAs PEF,根据相应的要求,监管机构经评估合格后即可被列为WLAs。
此外, 对于SRAs 等通过WHO 以往其他认证资质的监管机构,则可采用简化的PEF 评估程序,经评估合格后被列为WLAs。2024 年5 月20 日,WHO 更新了正式WLAs 清单,涉及34 个国家和地区的监管机构,包含美国食品药品监督管理局、欧洲药品管理局、欧盟各国国家药品监管机构、韩国国家药品监管机构、新加坡国家药品监管机构等[6],这表明WLAs 正逐渐取代SRAs,成为新一轮的国际认证趋势。
2、WHO 框架下监管协同的特点
2.1 WLAs 评估指标关注重点
在长期应对全球复杂监管环境带来的挑战中,WHO 认识到无论成员国监管机构的规模和监管成熟度如何, 促进国际协同、信赖始终是加强全球监管体系能力和效率建设最核心、有效的战略方法。协同、信赖建立在证据之上,WLAs 正是提供了这样一个基于证据的、透明的框架, 来为指定的监管机构获得全球认可奠定科学的循证基础。因此,WLAs 评估关注的重点内容极具参考意义,能够帮助监管机构更快、更深地融入全球化监管体系。
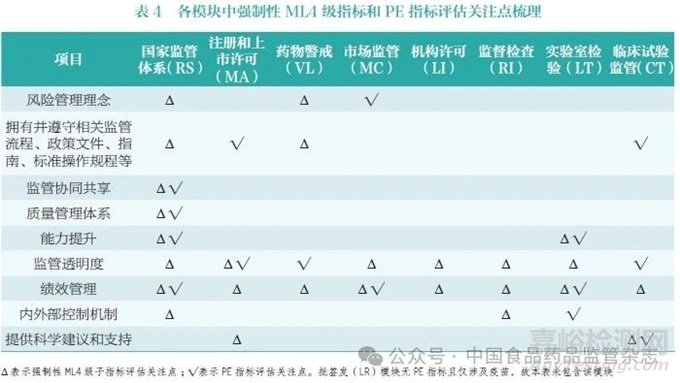
笔者对上述所有强制性ML4级子指标和PE 指标进行了梳理,汇总了各模块中强制性ML4 级子指标和PE 指标的评估关注点(表4)。两者关注重点有所不同,但又高度相似,主要集中在监管公开透明、监管活动质量和效率、风险管理理念等方面。
2.2 WHO 高度重视监管体系透明度
监管活动和决策的透明度是在全球和区域建立信任、实现依赖以及提高监管效率的重要推动力量,因此,WHO 将其作为WLAs体系组成的一个重要领域[7]。首先,在药品监管体系GBT 评估中,每一模块均有专门的系列指标用于考察监管体系透明度;其次,WHO 强调整个监管体系的公开透明,而不仅局限于监管决策信息的公开;最后,以促进全球和区域监管信赖与协同为目标的WLAs 框架体系中,透明度亦是其考察重点。
笔者以国家监管体系(RS)为例, 对该模块所有涉及提高监管活动透明度的GBT 子指标、PE 指标进行了梳理,具体见表5。

3、 我国药品监管体系面临的挑战
公开、透明的监管体系不仅是对本国公众、产业和政府负责,也是开展良好合作与协调的基础,有利于推进国际监管协同。对标WHO 关于国家监管体系(RS)模块的指标要求,我国自2015 年以来贯彻落实一系列变革性实践,药品监管科学性、可预期性、规范性全面升级,药品监管透明度建设取得了飞跃式进展,如《药品管理法》从法律法规角度强调对批准上市药品的审评结论和依据以及产品召回信息的公开,符合WHO GBT 中子指标“RS01.06”要求。当然也需要看到,我国药品监管体系仍存在一些优化调整空间。
3.1 关键决策信息公开还不够全面
根据WHO WLAs 要求,子指标“RS09.03” 属于强制性ML4 级指标,必须完全实现,即NRA 必须系统地公布积极和消极的监管决定。同时,GBT 工具指南也指出,一些国家法律规定不允许公布负面的监管决定,在这种情况下,评估可以仅限于公布积极的监管决定[3]。我国法律法规并未有此类规定,但在一些方面,如上市许可环节,国家药品监督管理局(National Medical Products Administration ,NMPA)仅公布积极的批准上市决策和依据,对于不批准上市和终止加快上市等负面情况有时未及时公布。
对于已公布的信息,WHO要求公众能够获得监管流程中支持最终决策的所有信息和报告。同样以注册上市环节为例,2020 年国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)发布《药品审评审批信息公开管理办法》[8],详细阐述了技术审评环节信息公开内容,我国药品审评工作透明度取得了巨大进展。同时,专家咨询委员会在药品注册审评工作中发挥专业优势,有力支持我国药品审评工作的开展[9]。然而,与CDE 审评环节高度透明化不同,尽管我国药品注册审评专家咨询委员会名单是向社会公示的,但专家评审意见是保密的,这不完全符合WHO 及国际社会推行的提高监管透明度的理念,逐渐成为推动国际监管互信的重要掣肘因素之一。
3.2 公开信息的维护需进一步加强
子指标“RS09.04”“RS09.05”“RS09.08”“RS09.09”分别从信息发布、维护、信息公开工具与媒介角度对国家监管体系的公开透明度提出了要求。
当前,我国药品监管信息基本能够做到及时高效公开。例如, 根据子指标“RS09.04”的要求,NMPA 每季度更新发布药品编码本位码, 公开上市产品相关授权、生产等信息,以促进对监管过程透明度的支持。根据子指标“RS09.09” 的要求, 国家药品监管信息主要通过门户网站方式进行公开, 利益相关者可以通过检索直接查询其所需要的法律法规、指导方针及监管决策等信息。
根据子指标“RS09.05”的要求,国家监管体系应当有书面文件或信息发布指南,规定发布信息的类型、格式、负责人及更新频率,以便公众能够查阅到最新更新的信息。为完善药品监管信息公开制度,NMPA 定期开展年度直属事业单位网站评估工作,作为药品监管的两个重要职能部门,CDE 和国家药品监督管理局食品药品审核查验中心(Center for Food and DrugInspection,CFDI) 分别发布了《药品审评审批信息公开管理办法》和各年度信息公开工作年度报告,以提升信息公开质量,提高药品监管的透明度。需要注意的是,当前除《政府信息公开条例》外,我国已有的信息公开指南仍有待细化和健全,公开信息被审查和更新频率、信息公开的范围等内容应当予以明确。此外,新旧指导原则衔接性和时效性需进一步优化,部分已废止指南未进行标注,造成查询和使用不便。
在实操层面,近年来我国数字化产业发展迅速,有待高效应用于药品监管领域,尽管子指标“RS09.08”只属于一般性ML4级子指标,并不要求强制性执行,但WHO 在评估体系中反复强调药品监管电子数据库的建立、应用和共享,我国建立统一的药品监管数据库、强化药品科学监管建设任重道远。
3.3 监管流程及规则的透明度有待提高
监管流程及规则的公开、可预见也是提升药品监管活动透明度的重要方面。根据子指标“RS09.02”的要求,有关监管部门应当确保公众和利益相关者能够获得医疗产品的法律法规、指南和程序的信息。随着药品审评审批制度改革持续深化,国家不断推进药品全生命周期监管相关法律法规、部门规章、技术指南等的制定与颁布,公众和利益相关者可便捷地通过门户网站查询使用,我国药品监管可预期性大大提升。
以技术指导原则为例,为规范药品研发过程,指导产业研发走向高质量发展道路,2015 年以来,CDE 不断加强共性和个性技术指导原则制定工作。但从技术指导原则制定计划角度来看,我国尚未公布每一年度拟修订及制定原则主题清单,使得产业无法更广泛地参与并提出相关建议及从产业角度进行监督;从技术指导原则整体数量和体系分类上来看,2015 年以来,CDE 已累计发布技术指导原则约400 个,其中共性技术指导原则覆盖有效、多学科、安全性等方面与美国基本一致,但在质量相关共性和个性技术指导原则整体数量和体系分类上仍有明显差距,相关指导原则的制定需要更加细化[10],以增强药品研发生产过程规则的清晰性;从技术指导原则发布效率来看,我国在国际人用药品注册技术协调会(ICH)指导原则转化方面仍需加速,部分草案与最终指导文件的发布时间相隔较远,需要进一步提升制定和发布效率。同时,率先发布相关指南可能会对国际规则的制定产生重要影响,我国药品监管部门还需持续保持未来发展战略目光,加速前沿技术领域指导布局。
3.4 尚未迈出与海外监管机构信息共享步伐
从提升药品监管规则透明度以增强国内外监管机构间信赖的角度来看,国家监管体系可以从两方面发力。一是积极参与所在区域或全球协作组织信息共享、监管趋同和协同活动(符合子指标“RS09.01” 要求), 转化落实已获得广泛认可的国际标准,参与新的监管标准的制定,在推动国家监管规则加速与国际接轨的同时,增强新兴技术监管的透明度。二是建立适当的法规、指南及标准操作规程,从而支持与海外监管机构共享监管信息(符合PE 指标“PE.RS.04”要求),在国际合作中提高效率,促进更透明的监管决策。
近年来,NMPA 的身影始终积极活跃在药品监管国际协调组织工作中,我国在与ICH 国际标准和规则接轨方面取得了丰硕成果。同时,面对新兴技术带来的机遇与挑战,我国需要更加重视提升监管国际化水平,探索促进全球协作网络下的融合。
在与国际社会交流与合作方面,NMPA 与60 余个国家和地区药品监管机构建立了工作联系,并与印度尼西亚、韩国、德国、英国、巴西、意大利等近30 个国家和地区的药品监管机构签署了30 余份合作文件[11],以加强药品监管机构之间法律法规和监管信息交流。总体而言,我国与海外药品监管机构的信息和工作共享还有待深入,指导国际交流与合作的相关法规、指南和程序尚未建立,合作形式较为单一,监管信息共享机制有待真正建立。
4、 对于我国进一步融入全球监管体系的思考
从当前药品监管全球化协同趋势来看,推动我国药品监管体系获得国际认可至关重要,这将有利于展现大国担当,推动我国创新药品国际化,广泛惠及全球人民。对于我国而言,药品监管部门参与WHO WLAs 药品监管体系评估和列名,正是为提升我国药品监管在国际的声誉和影响力提供了重要机会。未来,我国仍需以更深层次的变革、更高水平的开放建立科学高效权威的药品监管体系,迎接国际化发展带来的机遇与挑战。
建议进一步完善顶层制度设计,提高对药品全生命周期监管信息公开的重视程度。数据具备可分享性才更具价值,建议药品监管部门建立数据管理机制,确保临床试验数据、检查数据、药物警戒数据等真实、准确、完整和可追溯。如此,既有助于提高我国药品监管质量和效率,提高行业声誉,又能挖掘数据的潜在价值,助力中国医药创新。
对于关键决策信息,建议全面公开,包括积极和消极的监管决策结果,也包括对决策起到决定性作用的依据。这不仅有利于提高监管决策的透明性,也有利于规范决策者的行为,科学高效问责。例如在上市许可环节,药品监管部门除了公布批准的产品信息及其技术审评报告外,还应当公布撤回、拒绝及专家审评意见等信息。
对于提升药品监管可预期性,建议持续细化完善相关政策法规、技术指导原则等。近年来,我国药品监管部门不断落实改革成果,在监管实践中积累了丰富的经验和共识。同时需要看到,部分领域可对外公开的文件和指南有待进一步落实,从而有利于规范和引导新药研发,以及统一各地监管标准和尺度。
在加强我国药品监管体系在全球的影响力和话语权方面,核心在于持续深化药品监管改革,提升药品监管能力建设。建议在参与全球和区域协作组织时发挥更大的主观能动性,深耕已有平台或创建新的国际协作平台,牵头前沿技术和新兴领域的探索与国际规则的制定和探讨,积极参与国际监管协作网络决定和决议,促进在全球和区域协作组织框架下的融合、协调、协作和依赖。同时,建议药品监管部门在已有的与海外监管机构战略合作框架基础上,探索监管机构间信息和工作共享与交流机制,促进监管机构间从建立相互受理,到药品检查互认协议的签订与执行,再到实现互信。
此外,建议制定并颁布相应的指南和文件,明确和细化药品监管法律法规等的公开方式和程序,以及决策信息公开的类型、范围、方式、更新频次等,建立公开信息的维护和考核工作机制,进一步提高信息公开工作质量及其透明度。
在持续深化药品监管改革的新时期,我国融入全球监管体系应当具有新的内涵、迈上新的台阶,相关政策制定者应当具备更加广阔的国际化视野和自我革新精神,时刻关注国际药品监管动态,及时根据国情调整本国政策,塑造中国药品监管体系的国际新形象,助力中国创新药品和药品监管体系走出国门、走向国际。

来源:中国食品药品监管杂志


