您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-03 11:27
反相液相色谱(RP-HPLC)在用于定量分析的高效液相色谱(HPLC)中占主导地位,它被用于80%的HPLC应用中(1-3)。RP-HPLC使用一种疏水性固定相和一种极性流动相,分析物主要依靠疏水作用来保留。由于优秀的精确度和可靠性,带有UV检测器的RP-HPLC被用于绝大多数药物纯度评估、质量控制和稳定性测试当中。其中在稳定性预测分析(Stability-Indicating Analyses)中使用RP-HPLC的另一个原因是出于物料守恒的考虑。RP-HPLC中化合物的保留和其log P(即水和正辛醇中的分配系数)高度相关,在这种色谱模式中,分析物与固定相较弱的相互作用力确保分析的样品中的所有杂质在方法梯度结束前都从柱子上洗脱下来,从而计入样品中的所有成分(4)。
关于流动相在调控RP-HPLC中的中性和离子化分析物的保留和选择性的作用已经在教科书中被广泛地讨论,详细信息请参考相关文献资料(1-3)。分析物在RP-HPLC中的保留能力可以通过线性溶剂强度模型(5)来预测,在这个模型中,分析物保留因子的对数与强溶剂的比例成反比。然而,由于溶质和周围极性溶剂分子的作用而使得这个模型变得非常复杂,因此Horvath等人提出了“疏溶剂作用模型(Solvophobic Interactions Model)”(6),也指出了吸附在疏水固定相表面的单层强溶剂的作用(1)。同时也存在二级作用,比如碱性基团与固定相表面存在的硅醇基团的相互作用,这个作用也会导致峰拖尾(7)。
在这篇文章,我们将简单阐述RP-HPLC中流动相涉及的基础理论以及流动相选择的最新趋势,如TABLE I所示。最明显的趋势集中在三个方面:小分子药及生物药的稳定性预测分析、提高UV和MS检测器灵敏度以及碱性分析物峰形的优化。

流动相选择的基础
在这部分中,我们会讲述在RP-HPLC中常见的弱流动相(水相)和强流动相(有机相)以及流动相的添加剂的选择标准。
总体趋势是流动相变得更简单
虽然色谱柱被称作液相色谱的心脏,但是流动相在分析物保留和选择性的调节方面也起着重要的作用。色谱柱中填料通常是一种键合固定相的高表面积、孔径可变的硅胶或高分子材料,在固定相和流动相的共同作用下,分析物有了不同的保留时间和迁移速率。在方法开发过程中,共洗脱的峰可以通过不同的流动相条件无限组合来进行微调,比如溶剂类型、pH、添加剂和操作条件(如温度、流速和梯度时间)。
然而我们发现在仪器和色谱柱方面不断推陈出新时,对流动相中使用的新试剂的开发却几乎处于停滞状态。回顾HPLC的使用历史,有几个很实际的理由来支持使用更简单的流动相这一趋势。
首先,色谱柱技术的进步大大减少了峰形优化或者色谱柱的批次重现性中对流动相添加剂或者缓冲液的依赖(8)。第二,使用简单的二元流动相、线性梯度可以简化方法转移中的调试过程进而增强方法的稳健性(9);最后,LC-MS作为一种标准技术在高通量筛选、过程监控、生物科学研究、临床诊断作为标准的迅速崛起也要求更简单的流动相(10)。
在RP-HPLC中有机溶剂(或流动相B)的选择
按照传统,流动相B代表RP-HPLC中泵混合梯度洗脱中强流动相(有机溶剂)。类似的,流动相A是弱的水相。
总结来看,目前RP-HPLC中三种最常用的有机溶剂是乙腈、甲醇和四氢呋喃。洗脱强度顺序是甲醇<乙腈<四氢呋喃(1,2)。比如,一种甲醇:水=44:56的流动相和乙腈:水=35:65以及四氢呋喃:水=28:72在参考的应用中有相同的洗脱能力(11)。这三种溶剂在质子接受能力、质子贡献能力、偶极作用方面都有显著的差异(1,11)。在等度分离进行条件优化时可以有效的利用这三种溶剂的选择性差异,如Glajch等人在模型软件的辅助下的实验对此进行了证实(12)。
绝大多数实验人员更喜欢乙腈,因为其更强的洗脱强度,更低的粘度(0.37 cP)的特点可以带来更高的柱效,同时它有更低的截止波长(190 nm)。乙腈是一种非质子性溶剂,也是一个带有π-π作用的质子受体(3)。
甲醇是一种质子性溶剂,它可以同时作为质子给体和质子供体。甲醇比乙腈价格更便宜,但是会产生更高的背压(粘度0.55 cP),特别是和水混合的时候(当甲醇:水=50:50时粘度为1.62 cP)(11),甲醇的截止波长为210 nm。
四氢呋喃在RP-HPLC中很少用到,除非需要利用其强溶解能力和洗脱强度。毒性和安全性问题(会形成过氧化物)让它在凝胶渗透色谱(GPC)以外的使用非常受限。因此,对于流动相B,一般在甲醇和乙腈两者之间选择。
甲基叔丁基醚可以作四氢呋喃在低浓度使用时的替代品,因为它在水中的溶解度有限,同时也不会形成过氧化物。由于粘度过高,长链脂肪醇比如乙醇、丙醇和丁醇在反相中一般很少使用,但在正相色谱分离手性化合物或者反相色谱分离大分子蛋白中例外。最近几年很多文章中用到乙腈和正(或异)丙醇甚至正丁醇,据说有助于提高一些单克隆抗体(mAbs)的回收率。DMSO有非常强的溶解能力但是有非常高的粘度和截止波长(3),同时也不与一些HPLC仪器中使用的高分子材料(比如PEEK)兼容。
含有水和添加剂的流动相B的使用
我们经常看到HPLC方法中使用规定的流动相B为类似乙腈:水=95:5这样的溶液,这是为了使两种流动相在粘度和表面张力更接近而实现更充分的混合。但是缺点是降低了流动相B的洗脱强度,也增加了流动相配置的步骤。随着现代泵和在线混合技术的提升,这个额外的步骤就逐渐显得不再那么重要。
另一个常见的操作是同时在A相和B相中使用同样比例的添加剂,比如在乙腈中添加0.1%的三氟乙酸作为B相,同时在水中添加0.1%的三氟乙酸作为A相。从技术上讲,100%的乙腈和添加了0.1%的三氟乙酸的乙腈对于分离重现性或者洗脱顺序方面没有明显差异,但是同时在乙腈中添加0.1%的三氟乙酸在梯度方法下可以降低低波长UV检测时的基线漂移(后面将会更详细讲到)。
流动相A:pH调节剂和缓冲剂
正如上文所述,RP-HPLC中弱的流动相被称为流动相A,它主要含有水,往往也有少量的改性剂,缓冲剂或盐来控制pH和离子强度,纯水通常被用于分离中性分子。
在药物分析中,绝大多数药物是可离子化的,也就是酸性、碱性或者两性离子。因此,流动相A的pH必须被调节,因为它对分析物的保留有极大的影响。可离子化的分析物在不同的pH条件下可以以离子化或非离子化的形式存在,而在RP-HPLC中离子态比分子态保留要弱得多。
TABLE II列出了常用的流动相添加剂以及它们各自的pKa和截止波长,可用于LC-MS的挥发性的缓冲盐被标注了星号。这些添加剂可以作为酸化或者碱化试剂或者通过添加它们对应的共轭盐来作为缓冲液。
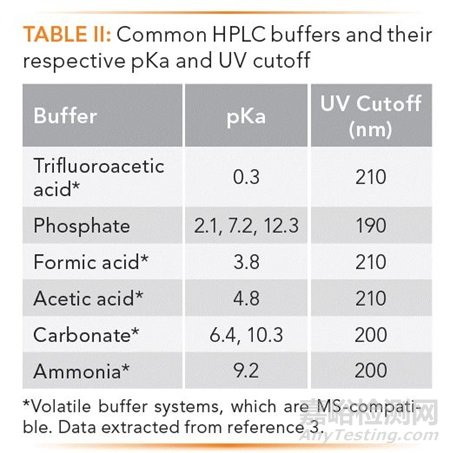
酸性添加剂
pH 2-4这个酸性pH范围被用于多数的药物分析,因为这个低的pH可以抑制弱酸性分析物的电离从而获得更好的保留;碱性分析物在低的pH值下虽然会离子化,但绝大多数的碱性药物都有足够强的疏水性从而可以在离子态下依然有足够的保留(3),同时一个酸性的pH也可以抑制色谱柱上残留的硅醇基团的电离,从而减少碱性分析物与这些硅醇的二级作用而形成的拖尾。
常用的酸是TFA、甲酸和乙酸,浓度为0.05-0.1% v/v。在水溶液中,pH情况为:0.1% 三氟乙酸(2.1),0.1%甲酸(2.8),0.1%乙酸(3.2)。这些简单0.1% v/v的流动相可以通过在1 L纯化水中加入1.0 mL的酸,无需进一步过滤即可直接使用。它们经常被用于LC-MS应用,虽然由于它们离子强度较低,可能会使非常碱性的药物的峰形较差(7,13)。
相对传统上更喜欢用的磷酸盐缓冲液, 0.1%的磷酸溶液却没这么被广泛使用。事实上,磷酸溶液具有易制备、截止波长低(200 nm)等优点,它在低UV波长下测定原料药或者试剂纯度的方法中往往有奇效。
缓冲剂
在流动相A的pH需要严格控制的实验中,缓冲液的使用就非常关键。根据Henderson-Hasselbalch方程,缓冲液在它们pKa±1.0的范围内最为有效(1,11)。缓冲液是通过混合一种弱酸和它的共轭碱的盐(或者一种弱碱和它的共轭酸的盐)而获得。
从历史上来看,HPLC中最常用的缓冲剂是磷酸盐。因为磷酸有三个可电离的氢,磷酸盐在pH值为2, 7和10都是有效的。它的截止波长是200nm,但是由于其不可挥发性,因此不兼容MS。另外,它还有一个缺点是在乙腈里的溶解性差,特别是高浓度的时候(比如50 mM),会在泵混合的时候发生析出,当流动相B为85%的乙腈水或者甲醇可以缓解这个问题。
挥发性酸的铵盐也被用于开发兼容MS的HPLC方法。一种常见的MS兼容的缓冲盐系统是20 mM甲酸铵,使用甲酸调节其pH至3.7。这种流动相条件可以使大多数的碱性药物和多肽在现代的色谱柱上有优秀的峰形,也有助于保留很多碱性和两性离子分析物,特别是当载样量增加的时候(7,14)。当为了增加RP-HPLC体系中分析物的保留,可以通过利用“盐析”效应或者Le Chatelier规则,通过增加缓冲盐浓度来驱使分析物进入疏水的固定相中(1,11)。
碱性流动相
在上世纪90年代前,硅胶基质的色谱柱不能用于高pH的流动相,因为硅胶基质会在pH >8时发生溶解。随着杂化硅胶颗粒和新的键合技术的发展,现在的硅胶颗粒可以把耐用的pH范围扩展到1-12(当柱温>40℃时耐受pH为2-10)(3,15-16)。典型的高pH流动相时0.05-0.1%的氨水、10-25 mM的碳酸铵或者磷酸盐。通过比较发现,随着流动相pH的升高,流动相缓冲液里硅胶的溶解性显著增加,因此可以预料到在高pH和高温条件下色谱柱的稳定性会大大降低(16)。值得注意的是,氢氧化铵目前碱性条件下最安全的选择,也能和ESI-MS检测器有很好的兼容。使用高pH来分离的优点包括可以增强水溶性碱(比如分析阿片类药物,传统上需要离子对色谱)的保留、碱性分析物更好的峰形和MS兼容(15);缺点是一些药物在碱性流动相不稳定,同时如果流动相pH和碱性分析物的pKa(比如绝大多数的胺的pKa值在8-10)接近时,会导致可能的方法稳定性出现问题(3,15)。
图1为一个检测含有两种API以及过程杂质和降解产物的色谱图(3)。我们可以看到所有的峰在高pH条件下都有非常好的峰形,没有峰裂分的情况出现。这个方法的缺点是它对流动相pH比较敏感,需要保持在pH 9.10到9.15以防止化合物的共洗脱(3,15)。
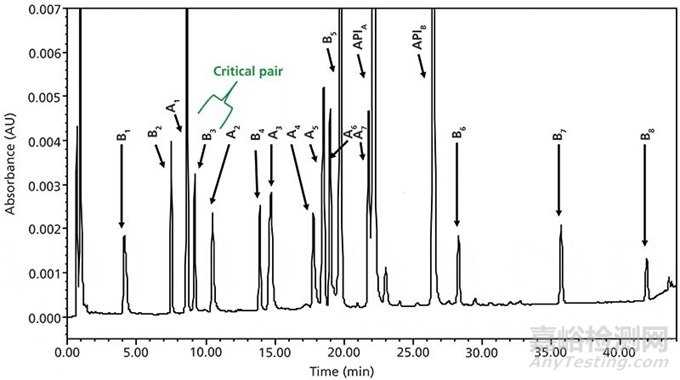
图1 两种水溶性碱性API(阿片类)及其潜在的杂质和一个复方药稳定性预测实验的降解产物的“鸡尾酒”色谱图(数据源于参考文献3)
图2进一步说明流动相pH对酸性和碱性药物保留和洗脱顺序巨大影响(17)。使用色谱柱筛选酸性和碱性pH的流动相A已经在很多实验室中最为高通量筛选和方法开发的常用方法。(3,8-10)。
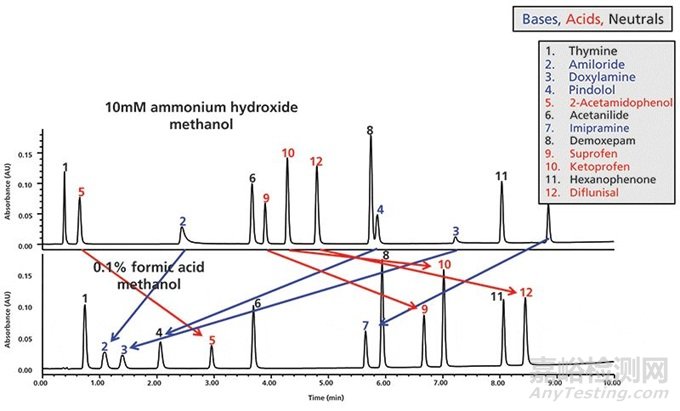
图2 一个使用酸性和碱性流动相、梯度方法来分离12个含有酸性(红色)、碱性(蓝色)和中性(黑色)药物分子的色谱柱筛选案例(数据源自参考文献17)
减少使用硅醇屏蔽、离子对和离序试剂
在上世纪90年代前,对于硅胶基质的HPLC柱,最被吐槽的是质控(QC)方法转移时存在难度,这是由裸硅胶和固定相键合时存在批次差异导致。这种不可重现性主要是由于活性硅醇基团的存在造成的,同时当硅胶基质上残留有金属离子(比如铝离子,铁离子等)时,这些硅醇基团的活性更高(1,3)。在当时,如果不使用硅醇屏蔽试剂(比如三乙胺),这种带有酸性硅醇基团的固定相会导致碱性分析物无法被洗脱。在药物分析的常规检测当中,为了获得优秀的峰形以及稳定的重现性,三乙胺往往被频繁使用(18)。
随着高纯硅胶的普及以及碱性硅胶中金属杂质的消除,色谱柱的硅胶基质的硅醇活性逐渐降低,键合相的批次重现性也得到很大的改善。使用三乙胺作为添加剂的操作逐渐被淘汰,原因有三:第一是三乙胺会永久改变色谱柱的选择性;第二是它会抑制正离子模式的所有MS信号;第三是新的色谱柱技术使用了表面带电或者其他技术从而提供了改善碱性分析物峰形的更好的解决方案。
一种最近的创新是在键合固定相的表面键合一种正电荷(比如胺)。强碱性药物可以在这些色谱柱上有非常优秀的峰形,及时流动相离子强度很低(比如0.1%的甲酸),正如图3a和3b所示。
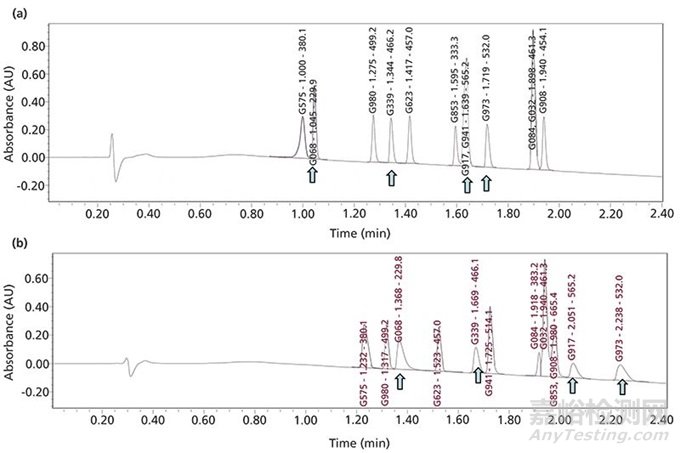
图3 (a)一种通用使用亚3 µm的表面带电杂化(CSH)色谱柱来分析12种新化合物;(b)使用常规表面不带电的色谱柱的对比分析图谱
另一种方法是使用先进的包膜技术来减少存在的硅醇基团的活性。这个方法的附加的好处是使色谱柱可以在高pH条件下使用。
离子对和离序试剂
离子对试剂是像洗洁剂一样的分子,它们被加入到流动相A中来为酸性或者碱性分析物提供保留(1)。长链烷基磺酸盐(C5到C12)在酸性pH条件下和碱性分析物结合以形成中性的“离子对”,这种“离子对”就可以在RPLC中保留。保留和离子对试剂的疏水烷基链长度以及离子对试剂的的浓度正相关。需要注意的是,三氟乙酸也有一些离子对能力,也常被用于蛋白和多肽的RP-HPLC分析中。然而由于存在柱效降低、柱平衡变慢、不易使用梯度分析以及质谱不兼容等问题,离子对试剂的使用在逐年减少(1,2)。同时,一些公司已经生产出有特别表面修饰的HPLC柱从而减少了离子对试剂的使用,通过使用低有机相甚至无有机相条件来解决“固定相坍塌”或者“孔去润湿”问题(3)一些色谱填料在不依赖离子对作用的情况下直接为大极性碱或者酸提供良好保留,保证更好的MS兼容性以及更短的再平衡时间。
另一类用于增加碱性化合物保留和选择性的添加剂是无机离域盐(比如PF6-,BF4-,ClO4-等),这些添加剂可以在酸性条件下和碱性分析物形成中性离子对(1,2)。离序试剂更适合梯度分析,产生的基线偏移更少,但是同样不兼容MS。。
另外我们可以选择能高pH的挥发性流动相缓冲液(比如氢氧化铵),当使用合适的硅胶基质比如杂化硅胶基质色谱柱时,可以提供分析水溶性的碱性药物非常好的MS兼容的分析方法,因此降低了分析这类化合物时离子对试剂和离序试剂的使用(15)。
其他用于手性分离和离子色谱的流动相添加剂
手性添加剂往往作为衍生化试剂来与手性分析物形成非对映异构体,从而使手性分离能够在传统的反相柱上实现(1)。然而,随着高效广谱的手性固定相(比如经过化学修饰的多糖)的普及,这种间接的手性分离方法的使用逐渐减少(1-3)。
离子色谱有时候需要用到一种有机相添加剂(比如3 mM邻苯二甲酸钠),通过传统的HPLC-UV系统用间接的光度测定这个离子复合物从而实现离子色谱分析(21)。然而,随着带有电导和MS检测器的离子色谱仪器的普及,这些应用有限的方法也逐渐消失。
平衡吸附流动相的使用
当在梯度分析中使用UV检测器设置的波长比较低(比如230 nm使用兼容MS的流动相)时,我们经常可以观察到基线的漂移,这是由于流动相A和B的吸收和折射指数的不平衡导致的。基线漂移的程度和方向与检测器流通池的设计、波长和流动相组成密切相关。这些不平衡也可以归咎于这些添加剂在不同的溶剂条件下其基团(比如羧基)在UV下吸收的漂移(3),同时流动相A和B的不充分混合也可能造成周期性的基线波动。同样的,这种基线波动的程度也和在线混合器的设计、体积以及流动相A和B的吸收差异有关。
图4a展示了在稳定性预测实验方法开发过程中观察到的基线漂移。使用了流动相A(0.1%三氟乙酸水溶液),流动相B(含0.1%三氟乙酸的乙腈)(3)。由于三氟乙酸在远紫外区(200-230 nm)的吸收,可以观察到明显的基线漂移(230 nm时~0.1 AU)。当把三氟乙酸的浓度降低到0.05%时,这些基线问题显著减少(如图4b);当把流动相B中三氟乙酸的浓度降低至0.03%时,基线偏移也减少到0.002 Au,这与0.05%三氟乙酸水溶液在230 nm时吸收类似(如图4c)。
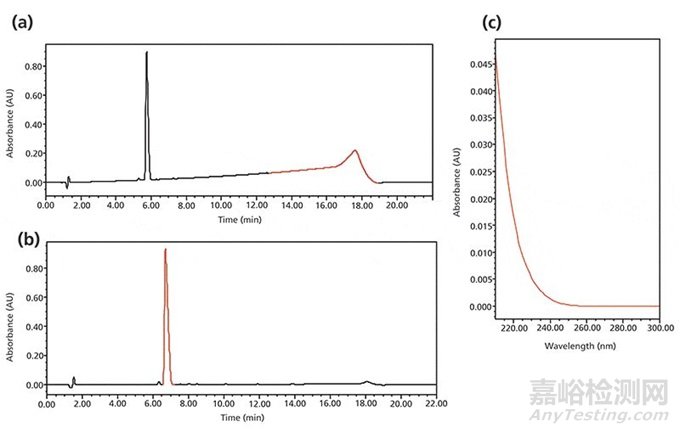
图4 药物稳定性预测实验中出现的梯度漂移问题 。(a)流动相A和B中都添加0.1%的三氟乙酸;(b)使用平衡吸附流动相,其中流动相A为添加0.05%三氟乙酸的水,B为添加0.03%三氟乙酸的乙腈;(c)0.05%三氟乙酸比水的UV光谱。梯度:25-65% B 15 min;基线漂移:(a)0.1 AU,(b)0.0002 AU,检测波长:230 nm。
当使用UV-vis吸收检测器时,为获得最高程度的UV灵敏度,正如上所说,需要对基线性质进行合适的调整。
流动相配制的现代趋势
流动相制备的最新发展趋势包括使用更低的缓冲盐浓度、避免过滤步骤以及调节缓冲液pH。
流动相A的更低的缓冲液浓度
虽然在很多比较古老的方法里要求缓冲盐浓度为50 mM,现在的趋势是使用更低的缓冲盐(比如5-20 mM),在这绝大多数的应用中都可以提供足够的缓冲能力(3)。现在使用的更低硅醇基团残留或者CSH(表面带电)的现代色谱柱,已经可以使用带有低离子强度的流动相A,比如0.1%的甲酸溶液的同时保证强碱性分析物的优秀峰形(11,13,20)。
避免过滤步骤
很多实验室已经开始使用高纯试剂(比如99.995%的甲酸铵)和HPLC级的有机溶剂和水,从而避免了使用0.2或0.5 µm的过滤膜过滤的步骤(22)。绝大多数HPLC泵中的内部过滤系统(在维护保养中更换)已经足够保证绝大数实验室在常规HPLC操作中不使用过滤操作。这种过滤操作的省略可以减少在过滤过程中潜在的流动相污染。但是当使用含有离子对试剂的流动相以及高浓度缓冲盐或者不能使用高纯试剂的时候例外。
类似的,使用真空过滤来对流动相进行脱气也已经很大程度被在线脱气所取代,这种在线真空脱气已经成为最新HPLC仪器的标准配置。
调节流动相A的pH
很多分析工作者在配置缓冲液时会把pH计直接浸泡到流动相A中,然后滴定溶液直到达到设计的pH值。这种操作存在一定的问题,那就是微量的污染物(比如pH校准液中的防腐剂)会吸附在pH计上,从而造成梯度洗脱时明显的鬼峰的出现(如图5)。为了防止这种污染,分析工作者在测定pH值时,每次都从待测液中取出的少量溶液来测定,直到达到目标pH,取出的少量溶液也不再倒回流动相A中(3)。通过这样的谨慎操作,我们就可以把高灵敏度分析中可能出现的引入污染物的风险尽量最小化。
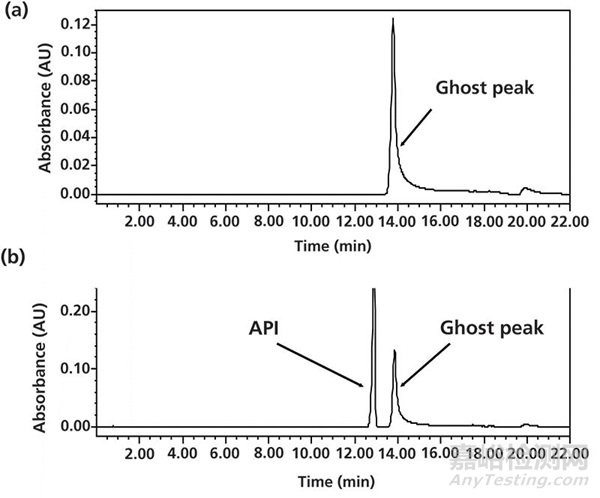
图5 在调节pH时直接把pH计直接浸泡到流动相A时造成的鬼峰的案例研究。(a)空白梯度;(b)进样。鬼峰随后被证实是pH校准液中使用的防腐剂(苯酚钠)(数据源自参考文献3)。
梯度方法的最新趋势
梯度方法的最新趋势包括使用简单的二元流动相(比如0.1%的甲酸或者0.1%的氨水),色谱柱内填充了高效的表面多孔、硅醇活性低的填料(8)。对于很复杂的药物的稳健的稳定性预测方法可以通过交叉双线性梯度来完成(23)。虽然在方法开发中四元泵也被广泛使用,在QC方法中使用三元或者四元流动相还是很少见,因为会给跨实验室或者仪器平台的方法重现造成困难,对于这种情况,非常不提倡使用凹或者凸的梯度。使用容易操作的二元流动相时,方法转移时出现的问题就少得多。
流动相稳定性的讨论
对于流动相配制后的稳定性还没有普遍的指南或者科学数据。很明显,当需要的时候,新鲜的流动相可以每天配置,虽然这种费时的过程既没有必要也不环保。流动相的储存寿命很难被估计,因为这取决于流动相组成、pH值、储存容器、储存条件以及流动相组成的微小变化对分离的影响的灵敏程度等。微生物(细菌、藻类和霉菌)生长对系统污染的可能性和色谱柱使用寿命产生了最大的影响。使用保护柱(比如C18,33×4.6 mm id,10 µm)可以针对流动相产生的颗粒和污染物提供非常好的保护(24),然而这会增加系统的滞留体积。
一种常用的操作是标记所有流动相的日期,水相缓冲液使用一周,简单酸化的水(比如0.1%的甲酸或者三氟乙酸)使用1-2个月,有机溶剂最少三个月。对于弱酸性缓冲流动相或者接近中性pH的缓冲液,可以储存一个浓缩液(10-50倍)。对于特定的缓冲液,冷藏(5℃)可以允许浓缩液使用很多个月,这个方法已经很好地被用于储存乙酸盐或者甲酸盐缓冲液。在这种情况下,可以通过定期检查pH和空白进样来确保流动相制备的清洁度和准确性。在一些实验室中可以建立一些标准操作,比如根据历史数据来规定试剂的储存寿命。在任何情况下,很多规范的实验室都应该鼓励甚至要求标记流动相的配制日期。
蛋白和多肽RP-HPLC分析的新添加剂
用RP-HPLC分离蛋白和多肽是一个挑战,因为实现这类物质的分离需要低硅醇活性的色谱柱,也需要特殊的流动相添加剂以实现低UV波长(210-220 nm)检测和高的柱温(>60℃)以改善峰形,同时也可能存在回收率的问题(2,3)。
蛋白和多肽的传统流动相A是0.1%的TFA,具有离子对能力的三氟乙酸可以让峰形更佳,同时可以让肽键可以在210-220 nm波长下有一定的UV灵敏度。虽然从沸点的角度来看,三氟乙酸兼容MS,但是当MS使用ESI模式时其灵敏度将大打折扣,因为三氟乙酸会产生离子抑制。三氟乙酸对于一级ɛ-氨基赖氨酸基团以及N-末端 α-氨基基团可以发挥非常优秀的离子对作用。除了作为一种酸性添加剂外,三氟乙酸还可以增强酸性多肽的保留,因为与N-末端氨基形成了离子对,这种离子对作用在甲酸流动相里并不明显存在。然而,和甲酸相比,使用三氟乙酸对于使用MS作为蛋白和多肽的检测器时灵敏度会受到很大的影响。随后出现受到一定欢迎的方法,那就是在流动相A和B中加入更低浓度的三氟乙酸,同时加入相等或者更高浓度的甲酸以在ESI的气相交换过程中和三氟乙酸竞争(25,26)。
最近Boyes等人通过研究发现了两种非常有潜力的添加剂,它们可以在峰形和MS灵敏度间取得好的平衡:二氟乙酸和3-氟丙酸(26)。图6展示了这四种添加剂(甲酸,甲酸铵/甲酸,三氟乙酸和二氟乙酸)在HPLC-UV-MS中分析五种多肽混合物相对表现。HPLC-UV和TIC(Total Ion Chromatogram)数据显示二氟乙酸在峰形和选择性方面在UV和MS检测器条件下都表现优秀。
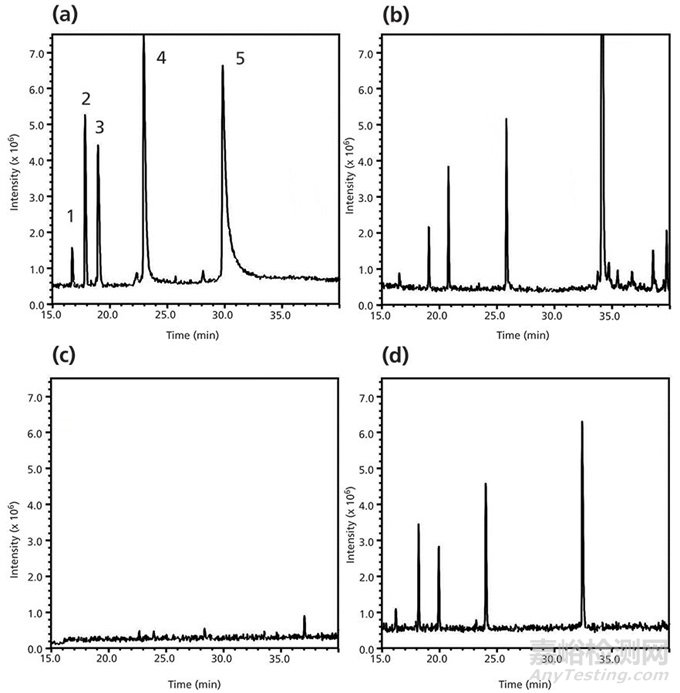
图6 (a)甲酸,(b)甲酸和甲酸铵的混合物,(c)三氟乙酸,(d)二氟乙酸作为流动相添加剂在MS检测器条件下测试其峰强度,保留,峰宽和分离度(数据源自参考文献25)。
图7展示了在一种蛋白分析中在流动相A中使用三氟乙酸、二氟乙酸和甲酸的色谱图。
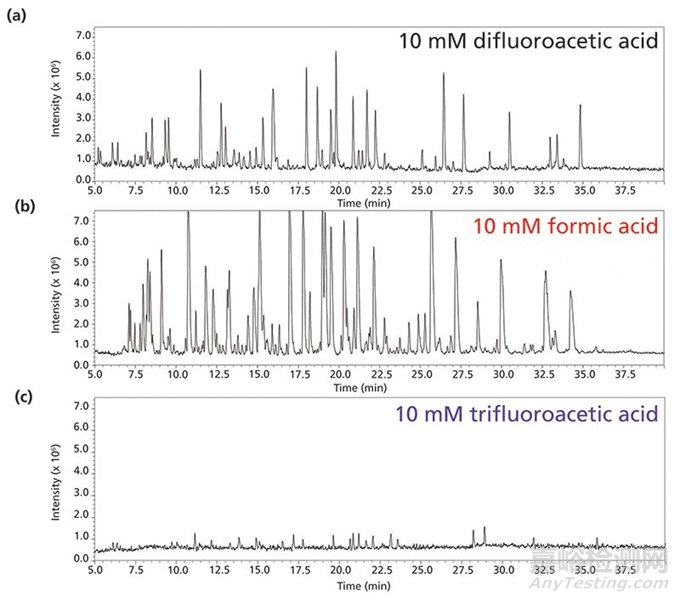
图7 一个完整的单克隆抗体使用10 mM(a)二氟乙酸,(b)甲酸,(c)三氟乙酸作为酸性流动相添加剂的分离结果比较
传闻二氟乙酸作为一种替代品在多肽和小蛋白比大至免疫球蛋白的大蛋白在ESI信号强度方面的优势更加明显。不管怎样,二氟乙酸比TFA在液相体系中更容易被清洗出来,毕竟LC-MS系统中彻底的清洗需要一个特殊且费时的过程。基本上TFA倾向于比二氟乙酸更容易“粘”在液相系统的部件上。经过六年多的使用,二氟乙酸在标准和毛细管柱分离中没有出现对仪器的不良影响。
由于TFA造成的离子化抑制,另一个方法是在流动相A中使用添加剂来增加或者补救离子化效率。DMSO被建议用做添加剂来改善高度复杂或者高灵敏度蛋白质组学的LC-MS分析质谱响应(27,38)。虽然这种方法存在损伤LC-MS零部件的隐患,同时DMSO(或杂质或碎裂产物)会在MS系统中累积,但在蛋白质组学研究中还是有一些相关应用案例。很多弱“BrØnsted”碱在作为流动相A的添加剂时可以作为“增强试剂”来提高溶解在反相中的蛋白质的MS信号强度(29)。这些化合物的添加没有阻碍液相发挥作用,同时会减少由于三氟乙酸抑制而损失的信号强度。但是目前还不清楚这些添加剂对MS系统稳定性和维护的影响。
总结
在这篇文章中,我们聚焦于药物分析,针对改善峰形、增强UV和MS的检测效果,概述了反相液相中流动相选择和配制的最新趋势和最佳操作。这些趋势包括使用简单的酸性流动相A或低浓度的MS兼容的缓冲液与乙腈或者甲醇的二元模式、使用宽的线性梯度或对于复杂分离的多段梯度方法、尽量减少过滤操作和相关流动相添加剂的使用、新的添加剂(二氟乙酸和3-氟丙酸)作为三氟乙酸的替代品可以提高质谱灵敏度。
参考文献
(1) L. R. Snyder and J. J. Kirkland, Introduction to Modern LiquidChromatography (Wiley, Hoboken, New Jersey, 3rd Ed., 2010, Chapters 2, 6and 7.
(2) Y. V. Kazakevich and R. LoBrutto, Eds., HPLC forPharmaceutical Scientists (Wiley, Hoboken, New Jersey, 2007), Chapter 4.
(3) M. W. Dong, Modern HPLC for Practicing Scientists (Wiley,Hoboken, New Jersey, 2006), Chapters 1, 2, 5, 6, 8 and 10.
(4) M. W. Dong, LCGC North Am. 31(6), 472-479(2013).
(5) L. R. Snyder and J.W. Dolan, High-Performance Gradient Elution:The Practical Application of the Linear-Solvent-Strength Model (Wiley,Hoboken, New Jersey, 2006).
(6) W. R. Melander and C. Horváth, in HPLC, Advances andPerspectives Vol. 2, C. Horváth, Ed. (Academic Press, New York, 1980).
(7) D. V. McCalley, J. Chromatogr. A, 1217(6), 858–880(2010).
(8) D. Guillarme and M. W. Dong, Amer. Pharm. Rev. 16(4),36-43 (2013).
(9) M.W. Dong,. LCGC North Am. 31(8), 612–621 (2013).
(10) M. Wong, B. Murphy, J. H. Pease and M. W. Dong, LCGC NorthAm. 33(6), 402-413 (2015).
(11) K. Schug and T. Taylor, The Essential CHROMacademy Guide:Mobile Phase Optimization Strategies for Reversed Phase HPLC, Webcast, http://www.chromacademy.com/essential_guide_webcast/mobile_phase_optimization_strategies_for_reversed_phase_hplc/mobile_phase_optimization_strategies_for_reversed_phase_hplc.pdf (accessed on 6/27/2018).
(12) J. L. Glajch, J.J. Kirkland, K. M. Squire and J.M. Minor, J.Chromatogr. 199, 57 (1980).
(13) K. J. Fountain, H.B. Hewitson, P.C. Iraneta, and D. Morrison,Waters Corporation, Milford, Massachusetts, 720003720EN, Sep. 2010.
(14) D. Johnson, B.E. Boyes, and R.C. Orlando, J. Biomol. Technology 24, 187–197 (2013).
(15) M. W. Dong, G. Miller, and R. Paul, J. Chromatogr. 987,283–290, (2003).
(16) J. J. Kirkland, M.A.van Straten, and H.A.Claessens, J. Chromatogr. A 691, 3–19 (1995).
(17) J. E. Turner, A Chemistry Focused Approach to Column Screening, HPLC Method Development Workshop, Parsippany, New Jersey, 13 June, 2018.
(18) D. W. Hill and A.J. Kind, J. Anal. Toxicol. 19,233–242 (1994).
(19) M. W. Dong, LCGC North Am. 33(10), 764–775 (2015).
(20) M. W. Dong, LCGC North Am. 34(6), 408–419 (2016).
(21) M. W. Dong and R.M. Woods, LCGC North Am. 34(10),792–797 (2016).
(22) M. W. Dong, LCGC North Am. 32(8), 552–557 (2014).
(23) M. W. Dong, D. Guillarme, S. Fekete, R. Rangelova, J. Richards, D. Prudhomme, and N.P. Chetwyn, LCGC North Am. 32(11), 868–876 (2014).
(24) M. W. Dong, J. R. Gant and P.A. Perrone, LCGC 3,786-795 (1985).
(25) B. Boyes, S. Schuster, J.J. Kirkland, B. Wagner, B. Libert, J.DeStefano. Proceedings ASMS, St. Louis MO (2015), ID 234745
(26) B. E. Boyes, W. Miles and B. Libert, J. Biomol. Technology(2018), in press.
(27) F. E. Kuhlman, A. Apffel, S. M. Fischer, G. Goldberg, and P. C. Goodley, J Am Soc Mass Spectrom. 6, 1221–1225 (1995).
(28) H. Hahne, F. Pachl, B. Ruprecht, S. K. Maier, S. Klaeger, D. Helm, G. Médard, M. Wilm, S. Lemeer and B. Kuster, Nat. Methods 10(10), 989–992 (2013).
(29) M. Nshanian, R. Lakshmanan, H. Chen, R. R. Ogorzalek Loo, and J. A. Loo, Int. J. Mass Spectrom. 427, 157–164 (2018).
(30) J. Nawrock, J. Chromatogr. A, 779(1), 29-71(1997).

来源:爱色谱


