您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-12 10:04
由于大部分候选化合物在生物药剂学分类系统(Biopharmaceutical Classification System,BCS)中属于BCSⅡ类、BCSⅣ类,其低水溶性增加了其作为药物开发的难度。低水溶性或低溶出率可导致药物生物利用度低,严重影响药物临床药效的发挥,为了应对这一趋势,评估提高口服生物利用度的方法已经在制剂开发计划的早期成为常规流程。在此背景下,无定型固体分散体 (ASDs) 已成为提高生物利用度的首选技术之一。
无定型药物处于高表面自由能的无定形态,在储存过程和溶出过程中易于向结晶态转变从而丧失相应制剂优势。同时,在正常制药过程中,也可能有意或无意形成无定型杂质,但这些无定型特性也可能产生不利的影响。因此,针对无定型物质的研究是十分必要的:通过控制无定型的形成,以保证药物的最终成品性质。
无定型药物特性
因为无定型药物固态的特征在于缺少组成分子的长短有序性,所以得到的固体分散体系通常倾向于不均一性。无定型固体的结构不均一性源于结构的不均一和样品在制备、后续处理和储存过程中成分的可能变化。显然,分子内和分子间的相互作用都存在于这些系统中,这导致了一个高度复杂的表征系统。
对于无定型更重要的一点是,当固体药物存在多种无定型形式时,不同无定型形式会表现出显著差异。特别是在对同一种化合物采用不同的无定型制备技术时,可能会产生不同的无定型,不同的无定型性质差异可能体现在吸湿性、玻璃化转变温度、重结晶趋势以及整体稳定性等。因此,在进行无定型药物研发时,还需要对存在多种无定型形式的药物进行晶型分析。
无定型的定性与定量分析相比于晶型要相对复杂,特别是API占比低的情况下,取决于化合物的性质和特定技术对化合物的敏感性。复杂制剂中结晶和无定型形式的混合物(特别是含有无定型赋形剂)的结晶度的定量可能无法用普通技术来完成。
无定型表征技术
与表征结晶态物质的方法不同,无定型更强调结构的流动性和变化,通过衍射和光谱方法对结晶物质的结构解析不完全适用于无定型结构。由于结晶形式和无定型之间的相似性,同时鉴于固体分散体的多样性及其复杂性,推荐使用组合分析技术来对无定型进行分析,进而获得无定型形式的完整表征。
使用粉末X射线衍射法(PXRD)测定物质形态时,结晶态物质的PXRD图谱呈锐峰,无定型态物质PXRD图谱呈弥散峰。若判断两个无定型态样品的状态一致时,应满足弥散衍射峰几何拓扑形状完全一致。但是,无定型PXRD图谱中弥散衍射峰几何拓扑形状无法直接分辨,需要通过PDF技术(Atomic Pairwise Distribution Function Analysis)进行变换来进行分析。
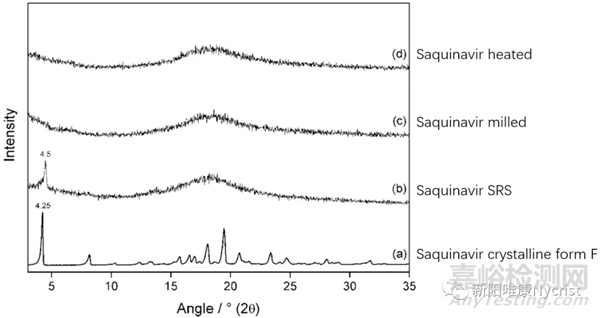
沙奎那韦样品的粉末X射线衍射图谱
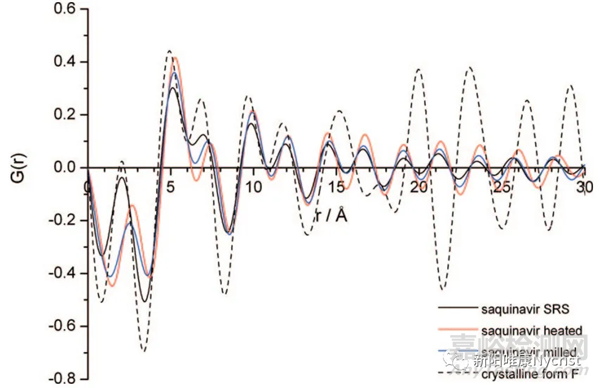
沙奎那韦样品的粉末X射线衍射PDF图谱
水蒸气吸附法与其他技术如差示扫描量热法、傅里叶变换红外光谱和核磁共振结合时,它可以提供无定型分子水平属性的各种信息,如表面性质、非晶化程度、相变、玻璃化转变和结晶的临界相对湿度以及新制备和老化材料的物理稳定性等较全面的信息。
在工业生产中,化合物表面可能会形成一些少量的结构破坏,进而成为无定型。常规仪器比较难以测量到这种少量的无定型。即使少量的结晶也会影响无定型的表征,极可能影响到后期的药物生产和储存时的稳定性,从而导致整个开发失败。因此,针对无定型产品,必须确定制备的无定型形式的相对含量,同时重要的是要有一个好的分析工具来监测样品的结晶度。目前实验室中常用的技术是根据晶相和非晶相之间物理化学性质的差异来量化结晶度。
结语
在正常的制药过程中,也可能有意或无意形成无定型杂质,这些无定型特性可能会产生不利的影响。研究人员应注重对于这类少量或微量无定型的研究,确保产品最终质量。此外,药物研发中大量药物水溶性差给了研发人员很大挑战,因此,无定型药物(固态分散体)的研究提供了一种可行方案。针对无定型药物固体的进一步研究和开发,有可能通过克服物理稳定性和大规模制造工艺等技术挑战,充分利用无定型来提高难溶性药物的口服生物利用度。
参考文献:
[1] Gao P. Amorphous pharmaceutical solids: characterization, stabilization, and development of marketable formulations of poorly soluble drugs with improved oral absorption. Mol Pharm. 2008 Nov-Dec;5(6):903-4. doi: 10.1021/mp800203k. PMID: 19040385.
[2] Karthik Nagapudi and Janan Jona, Amorphous Active Pharmaceutical Ingredients in Preclinical Studies: Preparation, Characterization, and Formulation, Current Bioactive Compounds 2008; 4(4) . doi: 10.2174/157340708786847852.
[3] Murdande SB, Pikal MJ, Shanker RM, Bogner RH. Aqueous solubility of crystalline and amorphous drugs: Challenges in measurement. Pharm Dev Technol. 2011 Jun;16(3):187-200. doi: 10.3109/10837451003774377. Epub 2010 Apr 30. PMID: 20429826.
[4] Nanubolu J B , Burley J C . Investigating the Recrystallization Behavior of Amorphous Paracetamol by Variable Temperature Raman Studies and Surface Raman Mapping[J]. Molecular Pharmaceutics, 2012, 9(6):1544.
[5] Zhang Z, Dong L, Guo J, et al. Prediction of the physical stability of amorphous solid dispersions: relationship of aging and phase separation with the thermodynamic and kinetic models along with characterization techniques[J]. Expert Opinion on Drug Delivery, 2021, 18(2): 249-264.
[6] 施秦. 无定形态药物结晶行为的研究进展[J]. 中国药科大学学报, 2017, 48(6):9.

来源:Internet


