您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-19 08:22
无定型固体分散体是提高难溶性药物口服生物利用度的有效策略之一,应用前景广泛。但由于存在固态物理稳定性,即“老化”的问题,会影响药物的体外溶出和体内吸收,给无定型固体分散体制剂的开发带来了较大挑战。固态物理稳定性易受处方组成、制备工艺和贮存条件等多种因素的影响。文章讨论了无定型固体分散体制剂的处方组成、制备工艺和质量控制,以期为其研究和开发提供参考。
研究[1-3]表明约 40%已上市药品的活性成分难溶于水,而近年来新开发的候选化合物中,难溶性化合物的比例上升至约 90%。这些 BCS Ⅱ类和Ⅳ类化合物,由于低水溶性或低溶出速率,导致其口服生物利用度低,影响了药品疗效,显著增加了药物制剂开发的难度。为了应对这一趋势,众多制剂学策略已被用于提高难溶性药物的口服吸收,如自乳化系统、固体分散体 (soliddispersion,SD)、纳米晶和环糊精包合物等技术[4-5]。其中,SD 技术由于增溶效果显著、安全性良好、生物个体间差异小和易于工业化生产等优势,已成为提高难溶性药物口服生物利用度的重要技术手段[6]。
SD 是指将药物以分子、微晶或无定型状态高度分散在适宜的高分子聚合物载体中形成的一种固态分散体系。其中,药物以无定型态高度分散的体系又称无定型固体分散体 (amorphous solid dispersion,ASD)[7]。
与晶态药物相比,ASD 属于热力学不稳定系统,其中高度分散的药物分子有自发聚集、形成晶核的趋势,导致 ASD 在贮存过程中易出现相分离和重结晶等固态物理稳定性问题 (即“老化”),使 ASD 的溶出度下降,进而降低药物口服生物利用度[8-9]。上述固态物理稳定性问题大幅限制了ASD 的广泛应用。ASD 作为制剂中间体,添加适宜的辅料可被进一步制成片剂、胶囊等剂型。目前,全球范围内上市的 ASD 制剂有 40 个左右[10],绝大多数是片剂[11]。
ASD 制剂的固态物理稳定性和其他关键质量属性受到其处方组成和制备工艺的显著影响。本文以市售药品为参考,从产品开发角度论述了 ASD制剂的处方组成和制备工艺对其关键质量属性的影响,以期为 ASD 制剂的研究和开发提供一些借鉴和参考。
1、ASD制剂的处方组成
1.1聚合物载体的种类
ASD 一般由难溶性药物和聚合物载体所组成,有的还包含表面活性剂,如维生素 E 聚乙二醇琥珀酸酯、SDS 或聚山梨酯等[12]。载体的性质、药物与载体的比例及其之间的相互作用均对 ASD 的质量属性影响重大。ASD 中的载体不仅有助于增加药物的溶出速率和溶解度、维持溶液过饱和状态,还可通过降低分子迁移速度及提高玻璃化转变温度 (Tg),增加 ASD 制剂的固态物理稳定性[13-15]。
目前市售 ASD 制剂中采用的水溶性聚合物载体主要有 PVP、乙烯基吡咯烷酮及乙酸乙烯酯共聚物(如 PVP-VA64)、HPMC 和聚乙烯己内酰胺 - 聚乙酸乙烯酯 - 聚乙二醇接枝共聚物 (Soluplus®) 等,水不溶性聚合物载体主要有醋酸羟丙甲纤维素琥珀酸酯 (hydroxypropylmethylcellulose acetate suceinate,HPMCAS)、羟丙甲纤维素邻苯二甲酸酯和聚丙烯酸树脂 ( 如 Eudragit EPO) 等[16-17]。聚合物载体需要能与药物形成单相的均匀分散体系,以避免发生相分离和重结晶。在选择适合候选化合物的聚合物载体时,可先测定药物与载体间的相互作用力,作为载体选择的参考。药物与载体间的相互作用力主要是氢键或离子键作用,作用力越强则药物形态越稳定 [18]。SHIM 等[19]以 HPMC 为载体材料制备雷洛昔芬 ASD。雷洛昔芬的酰胺基团能与 HPMC 功能基团上的醚基形成氢键,从而提高 ASD 的稳定性。在 ASD 的小试开发阶段,可采用加速试验快速评价采用不同载体制备的 ASD 的固态物理稳定性,筛选合适的载体。RAHAMAN 等[20]采用不同载体材料 (共聚维酮 Plasdone S630、聚维酮 PlasdoneK-29/32、HPMCAS M 型、Eudragit L100-55),通过喷雾干燥制备中枢神经系统药物 XY-123 的 ASD(药物与载体的质量比均为1∶3),并在制备完成及于加速试验条件下放置 65 h 时,以 DSC 法测定 ASD中药物的形态。结果显示,以 Plasdone S630、PlasdoneK-29/32 和 HPMCAS M 型为载体制备的 ASD 中的药物为无定型态,而以 Eudragit L100-55 为载体制备的 ASD 中的药物为晶体。此外,将低 Tg 的药物与高 Tg 的载体经过适当的方法制备,所得 ASD 的 Tg会显著高于药物,从而具有更好的固态物理稳定性。
1.2ASD中药物与聚合物载体的比例
ASD 中药物与载体的比例会影响 ASD 的稳定性。如果药物比例过高,有可能会导致 ASD 在贮存过程中析晶[20]。此外,很多载体本身具有一定的增溶作用,当载体比例太低时会导致增溶效果不显著。而从载药量的角度来看,药物与载体的比值无疑越高越好。载体用量越少,下游工艺进行处方设计时辅料的使用空间就越大。确定合适的载药量需要评价的因素有:固态物理稳定性、溶出速率和溶解度、片重以及生产成本等。
通常建议在处方研究初期进行快速筛选,用极端的稳定性试验条件 (如高温、高湿等条件) 测试不同载体比例制品的稳定性。评估风险后,若出现转晶、析晶或溶解度变化等情况,则需要对不同载体比例制品的稳定性做进一步筛选,从而最终确定ASD 中药物与载体的比例。
1.3ASD片剂的辅料选择
一般来说,ASD 片剂的处方组成中除了聚合物载体,还包括填充剂、崩解剂、助流剂和润滑剂等辅料。例如,恩扎卢胺薄膜包衣片 (Xtandi®) 片芯中的 ASD 采用喷雾干燥技术制备,其他辅料包括聚合物载体 HPMCAS、填充剂微晶纤维素 (microcrystallinecellulose,MCC)、助流剂胶态二氧化硅、崩解剂交联羧甲纤维素钠和润滑剂硬脂酸镁。其中,MCC 是制备 ASD 片剂的常用填充剂。通常,当 ASD 片剂的崩解时间过长 (>15 min) 时,可考虑用乳糖替代MCC,以促进崩解。需要注意的是,乳糖会降低片剂的抗拉强度,因此应选择适当的处方比例[21]。LIU 等[22]采用不同类型的填充剂 (MCC、乳糖和磷酸氢钙 ) 制备了盐酸苯丙醇胺的 ASD 片剂,并研究了 3 种制品的体外溶出速率。结果显示,与含磷酸氢钙的制品相比,含有 MCC 或乳糖的 ASD 片剂表现出更高的溶出速率。由于 ASD 片剂的生产工艺多采用干法制粒或直接压片,而填充剂在处方组成中占比较大,在选择填充剂型号时,需要综合考虑可压性、黏合性、流动性和含水量等因素对压片过程、溶出度和固态物理稳定性的影响。
由于 ASD 片剂中含有大量聚合物载体,当其处于含水环境中时会表现出胶凝性质,因而药物需要能快速溶出,以免在溶出介质中转晶而破坏过饱和状态。因此,ASD 片剂的处方组成中常需添加崩解剂,如交联羧甲纤维素钠或交联聚乙烯吡咯烷酮,且用量可由常规用量 (质量分数)2%~ 3%增至5%~ 10%[23]。此外,由于大部分 ASD 的载体为亲水性材料,具有较强的吸湿性,而从环境中吸收的水分作为增塑剂能降低体系的 Tg 值,从而降低固态物理稳定性[24]。因此,目前上市的 ASD 片剂绝大多数采用防潮膜包衣,以避免片剂吸潮后,水分引起药物由无定型状态转变为晶体。
2、ASD制剂的制备工艺
2.1ASD中间体的制备工艺选择
目前市售的 ASD 制剂中间体采用的制备工艺主要是喷雾干燥和热熔挤出。由于喷雾干燥适用性强、工艺开发时间短、获得性能良好 ASD 产品的可能性高,可作为 ASD 制剂研发初期的首选技术。与喷雾干燥工艺相比,热熔挤出工艺的重现性高,较易实现大规模生产,且生产过程中无需使用有机溶剂,大幅降低了后处理的难度,节约了生产成本,对环境更友好,但需考虑药物的热稳定性。
2.2喷雾干燥工艺
2.2.1 喷雾干燥有机溶剂的选择
喷雾干燥工艺中常用的有机溶剂及其沸点和ICH 限度要求如表1 所示。在能溶解药物与载体的前提下,尽量选择沸点较低且毒性较小的溶剂,以降低操作温度并减少终产品中的溶剂残留。如果单一溶剂无法满足要求,可选择共沸物作为制备 ASD的溶剂。此外,还应注意残留有机溶剂对 ASD 体系的影响,部分残留的有机溶剂可能会降低 ASD 体系的Tg值,导致ASD 不稳定而出现药物转晶[10]。此外,由于喷雾干燥工艺需要消耗大量有机溶剂,考虑到商业化生产的经济因素和环境因素,一般要求固含量 (固体与有机溶剂的质量比) 至少达到5%。
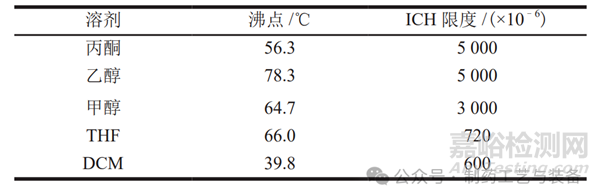
表1 喷雾干燥工艺中常用的有机溶剂及其沸点和ICH限度
2.2.2 喷雾干燥工艺参数的影响
喷雾干燥法的整个工艺过程分为 4 个步骤:液体的雾化、液滴与干燥气体的接触、溶剂挥发,以及干粉与气体的分离。每个步骤的工艺参数,如溶液浓度、进液速度、雾化压力、进风温度和抽风风量等都对ASD中间体的质量或收率等有影响[25-26]。例如:溶液浓度较低时,黏度较低,喷雾时形成的液滴也较小,所得的喷干粉末往往圆且细;而浓度较高的溶液会导致喷干颗粒具有中空的结构、粗糙的表面以及较高的孔隙率和密度,所得颗粒较粗且易于分离,从而提高收率。溶液浓度相同时,在较高的雾化压力下可得到较细的液滴,从而得到较细的干燥粉末。较快的进液速度会降低出风温度,使所得颗粒的粒径变大,导致比表面积减小、溶出度降低,同时溶剂残留量可能增加。较高的进风温度可使出风温度随之增加,残留溶剂量变少,并增加产品收率。较高的抽风风量会降低溶剂残留量,增强旋风分离效果,同时也可能增加出风温度。上述影响因素中,进风温度和进液速度是较重要的 2 个工艺参数,对 ASD 的性质有显著影响[10],如图1 所示。
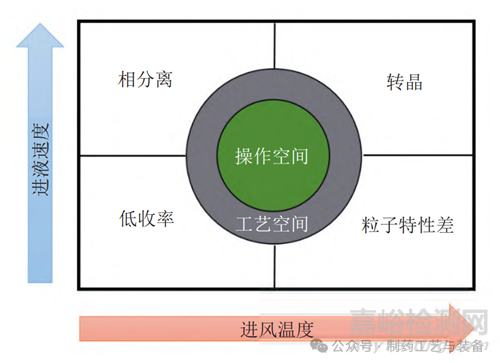
图1 进风温度和进液速度对ASD性质的影响
2.2.3 喷雾干燥后的工艺操作
喷雾干燥得到的 ASD 中间体粒径较小、比表面积较大、呈现多孔结构,存在明显的聚集倾向,因此吸湿性更强[11]。一般而言,吸水 1%就可能使分子运动加快 2 个数量级[27];并且,ASD 中水分含量增大会降低体系的 Tg 值,从而引起无定型药物的转晶。因此,喷雾干燥得到的 ASD 需要减压干燥以除去水分 (勿设定高温),在干燥后也需要密封保存,以避免 ASD 中间体从环境中吸收水分而造成药物结晶。一般,ASD 中间体的贮存温度宜在 Tg 以下50 ~ 100 ℃,并应注意防潮[28]。
喷雾干燥得到的 ASD 中间体具有疏松、多孔的性质,因此下游工艺操作的第一步需要提高 ASD 中间体的密度或进行制粒,以增加堆密度和流动性[29]。由于 ASD 中间体在含水环境下不稳定,所以多采用干法制粒工艺。在干法制粒过程中,需考察工艺参数对药物结晶行为的影响。例如:压片过程中的机械力和热量可能诱导结晶;包衣过程中的溶剂、温度和包衣材料等因素也会引起药物结晶。因此,在研发过程中,对每个工艺步骤得到的中间体都需要检查药物是否结晶,以确保药物处于无定型态。
2.3热熔挤出工艺
2.3.1 热熔挤出工艺参数的影响
目前,制剂领域应用较多的热熔挤出设备可分为单螺杆和双螺杆热熔挤出机。与单螺杆热熔挤出机相比,双螺杆热熔挤出机具有混合效果更好、操作参数可控性更强的优点。
热熔挤出工艺主要是利用高温和机械力对药物和高分子载体进行熔融和混合,较适于连续生产。实际生产中的关键工艺参数包括加料速度、挤出温度、挤出速度和螺杆直径等,同时在运行时需要重点监控的参数有扭矩和熔体压力等。其中,挤出温度和物料黏度是热熔挤出工艺中需要重点关注的 2个要素。热熔挤出需要经历高温过程,因此需保证药物和高分子材料在挤出过程中不发生热降解,还要兼顾药物的熔点和高分子材料的 Tg 值,以保证二者能充分、均匀混合。同时,在扭矩不过载的前提下,热熔挤出需要保证挤出物的黏度在合适范围,以确保挤出产品的成型性良好。不同种类的高分子载体均有其对应的挤出温度范围,也可通过加入合适的增塑剂来扩展高分子材料的挤出温度范围。在设计热熔挤出参数时,流变学测试是一种有效的辅助手段。通过流变学测试可获得 ASD 黏度跟随温度变化的情况,据此可确定合适的挤出扭矩和挤出温度范围。另外,通过考察流变学参数,特别是检测损耗因子随温度而发生的变化情况,还能够确定结晶态药物向无定型态转变的温度。
2.3.2 热熔挤出后的工艺操作
采用热熔挤出工艺制得的挤出物,需经粉碎或研磨等工艺进行破碎。因此,ASD 中间体的粒径和表面形态取决于下游粉碎工艺。粉碎过程一般会产生热量,从而增加 ASD 中药物结晶的可能性。因此,在粉碎过程中需控制产热对体系转晶的影响。与喷雾干燥法相比,热熔挤出法所制备的挤出物经粉碎后,所得颗粒的形态不规则、内部结构致密、无孔状结构,因此吸湿性较小。但粉碎得到的颗粒流动性和可压性均较差,在后续粉末直压制备片剂的过程中,需加入助流剂 (如胶态二氧化硅) 以增加物料的流动性,采用可压性较好的填充剂 (如 MCC 或乳糖),并优化 ASD 中间体在片剂中的处方比例[24]。
3、ASD制剂的质量控制
ASD 制剂在贮存过程中易出现“老化”问题,使药物的溶出度降低,进而造成口服生物利用度的降低。此外,由于 ASD 制剂的处方组成中含有大量聚合物载体,多数 ASD 片剂的片重在 0.6 g 以上,可能会造成患者吞咽困难。因此,与其他片剂相比,市售 ASD 片剂的关键质量属性除了含量、有关物质、含量均匀度、溶出度和微生物限度以外,还增加了固态物理稳定性和易吞咽性的评价。
ASD 制剂固态物理稳定性的评价方法主要有 PXRD、DSC 和偏振光显微镜(polarized lightmicroscopy,PLM) 法等,可用于检测 ASD 制剂中可能含有的药物晶体[30]。当 ASD 制剂中药物的结晶度低于 10%时,由于信噪比下降,PXRD 法所得的测定值并不准确。而 PLM 可观察到 ASD 制剂中极微量的药物晶体[31]。值得注意的是,ASD 制剂并非完全不能含有药物晶体,而是需要将晶体含量控制在一定范围内,以保证在药品货架期内口服生物利用度不发生显著变化。
制剂的易吞咽性通常与药品物理属性 (如大小、形状、质地等) 相关,也受到患者主观服药意愿的影响。可接受的研究设计包括:在目标治疗人群参与的临床试验中增加易吞咽性评估指标,作为次要终点评估;在独立开展的患者口尝试验中增加易吞咽性评估指标。无论采用何种设计,试验数据应包括足够的可评价样本。当满足“完全吞咽”标准的受试者比例达到 90%以上,无受试者发生窒息反射或咳嗽,且 2 次重复测量结果具有一致性时,可视为易吞咽性良好。
ASD 制剂需要快速溶出以避免难溶性药物在溶出介质中转晶,因此 ASD 制剂一般为速释制剂,要求在短时间内达到较高的溶出度。此外,由于人体胃肠道排空时间为 4 ~ 6 h,为了提高难溶性药物的口服吸收,需要药物能在聚合物载体的作用下较长时间地维持过饱和溶液状态。ASD 制剂快速溶出与维持过饱和溶液状态的现象,被称为“弹簧 - 降落伞”现象。这是 ASD 制剂在体外和体内溶出时需要达到的目标。如图2 所示,黑色虚线表示难溶性药物晶体在溶出介质中非常低的溶解度;绿色虚线表示 ASD 在溶出介质中快速溶出药物,并且药物在聚合物载体的作用下维持足够时间的过饱和状态,期间溶出度缓慢下降;红色虚线表示在处方工艺筛选过程中性质不理想的 ASD 不能使药物维持足够时间的过饱和状态,溶出的无定型药物形成晶核,导致溶出度快速下降[32]。
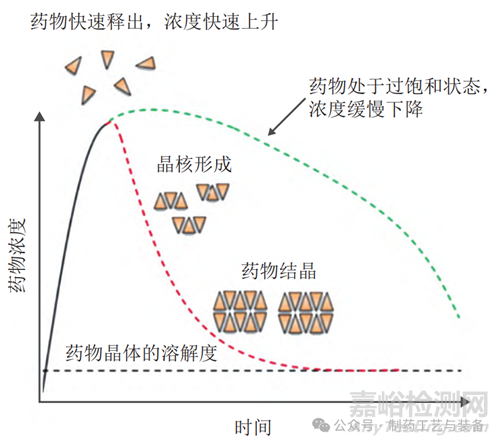
图2 ASD溶出过程中的“弹簧-降落伞”现象
4、结 语
ASD 技术能显著提高难溶性化合物的溶出度,改善其口服生物利用度。然而,ASD 中分散的药物呈无定型态,与晶体药物相比热力学性质更不稳定,在贮存过程中易发生相分离和重结晶等固态物理稳定性下降的问题,导致溶出度下降、口服生物利用度降低。这是限制 ASD 制剂开发的重要因素之一。ASD 制剂产品的开发和生产存在较高的技术壁垒,在针对特定药物设计 ASD 时,需通过聚合物载体选择、生产工艺选择、工艺参数优化和处方组成优化等,防止产品在制备和贮存过程中发生相分离和重结晶。
近年来,随着制剂辅料尤其是聚合物载体的发展,以及 ASD 制备技术和表征技术的不断进步,对ASD 制剂的研究与开发范围正在不断深入和拓展。ASD 作为提高难溶性候选化合物口服生物利用度的重要手段,显示出了良好的应用前景,市场潜力巨大。
参考文献
[1] TRAN P, PYO Y C, KIM D H, et al.Overview of themanufacturing methods of solid dispersion technology forimproving the solubility of poorly water-soluble drugs andapplication to anticancer drugs [J].Pharmaceutics, 2019,11(3): 132.
[2] MAHMOOD T, SARFRAZ R M, ISMAIL A, et al.Pharmaceutical methods for enhancing the dissolution ofpoorly water-soluble drugs [J].Assay Drug Dev Technol,2023, 21(2): 65-79.
[3] BRUNA R, DE MORAIS L A, VIANA M C, et al.Promisingstrategies for improving oral bioavailability of poor watersoluble drugs [J].Expert Opin Drug Discov, 2023, 18(6):615-627.
[4] JOSHI K, CHANDRA A, JAIN K, et al.Nanocrystalization:an emerging technology to enhance the bioavailability ofpoorly soluble drugs [J].Pharm Nanotechnol, 2019, 7(4):259-278.
[5] DI L, FISH P V, MANO T.Bridging solubility between drugdiscovery and development [J].Drug Discov Today, 2012,17(9/10): 486-495.
[6] 吴昊旻 , 张 杰 , 蔡 挺 , 等.无定形固体分散体的溶出与吸收研究进展 [J].药学学报 , 2022, 57(5): 1312-1321.
[7] HATE S S, REUTZEL-EDENS S M, TAYLOR L S.Insightinto amorphous solid dispersion performance by coupleddissolution and membrane mass transfer measurements [J].Mol Pharm, 2019, 16(1): 448-461.
[8] WANG X L, ZHANG L, MA D Y, et al.Characterizing andexploring the differences in dissolution and stability betweencrystalline solid dispersion and amorphous solid dispersion [J].AAPS PharmSciTech, 2020, 21(7): 262-269.
[9] 胡 洋 , 杨 奕 , 杨子毅 , 等.固体分散体制备工艺对其物理稳定性的影响 [J].沈阳药科大学学报 , 2022, 39(1):98-104.
[10] BHUJBAL S V, MITRA B, JAIN U, et al.Pharmaceuticalamorphous solid dispersion: a review of manufacturingstrategies [J].Acta Pharm Sin B, 2021, 11(8): 2505-2536.
[11] AGRAWAL A M, DUDHEDIA M S, PATEL A D, et al.Characterization and performance assessment of soliddispersions prepared by hot melt extrusion and spray dryingprocess [J].Int J Pharm, 2013, 457(1): 71-81.
[12] BAGHEL S, CATHCART H, O'REILLY N J.Polymericamorphous solid dispersions: a review of amorphization,crystallization, stabilization, solid-state characterization, andaqueous solubilization of biopharmaceutical classificationsystem class Ⅱ drugs [J].J Pharm Sci, 2016, 105(9): 2527-2544.
[13] SHI Q, CHEN H B, WANG Y N, et al.Amorphous soliddispersions: role of the polymer and its importance in physicalstability and in vitro performance [J].Pharmaceutics, 2022,14(8): 1747-1771.
[14] MARSAC P J, SHAMBLIN S L, TAYLOR L S.Theoreticaland practical approaches for prediction of drug-polymermiscibility and solubility [J].Pharm Res, 2006, 23(10): 2417-2426.
[15] AYENEW Z, PAUDEL A, VAN DEN MOOTER G.Cancompression induce demixing in amorphous soliddispersions? A case study of naproxene-PVP K25 [J].Eur JPharm Biopharm, 2012, 81(1): 207-213.
[16] BUTREDDY A.Hydroxypropyl methylcellulose acetatesuccinate as an exceptional polymer for amorphous solid dispersion formulations: a review from bench to clinic [J].Eur J Pharm Biopharm, 2022, 177(10): 289-307.
[17] CHAVAN R B, RATHI S, JYOTHI V G S S, et al.Cellulosebased polymers in development of amorphous soliddispersions [J].Asian J Pharm Sci, 2019, 14(3): 248-264.
[18] ROSIAK N, WDOWIAK K, TYKARSKA E, et al.Amorphous solid dispersion of hesperidin with polymerexcipients for enhanced apparent solubility as a more effectiveapproach to the treatment of civilization diseases [J].Int JMol Sci, 2022, 23(23): 15198-15217.
[19] SHIM J B, LEE J K, JO H, et al.Effect of acidifier on thedissolution property of a solid dispersion of raloxifene HCl [J].Macromol Res, 2013, 21(1): 42-48.
[20] RAHAMAN M A, KESHTMAND M.喷雾干燥制备固体分散体中聚合物的筛选和优化以提高生物利用度 [EB/OL].[2023-04-16].https://www.ashlandchina.com/uploads/2015/05/071050416350.pdf.
[21] AGRAWAL A, DUDHEDIA M, DENG W, et al.Development of tablet formulation of amorphous soliddispersions prepared by hot melt extrusion using quality bydesign approach [J].AAPS PharmSciTech, 2016, 17(1):214-232.
[22] LIU J, ZHANG F, MCGINITY J W.Properties of lipophilicmatrix tablets containing phenylpropanolamine hydrochlorideprepared by hot-melt extrusion [J].Eur J Pharm Biopharm,2001, 52(2): 181-190.
[23] AGRAWAL A M, DUDHEDIA M S, ZIMNY E.Hot meltextrusion: development of an amorphous solid dispersion foran insoluble drug from mini-scale to clinical scale [J].AAPSPharmSciTech, 2016, 17(1): 133-147.
[24] SIRIWANNAKIJ N, HEIMBACH T, SERAJUDDIN A T M.A q u e o u s d i s s o l u t i o n a n d d i s p e r s i o n b e h a v i o r o fpolyvinylpyrrolidone vinyl acetate-based amorphous soliddispersion of ritonavir prepared by hot-melt extrusion with andwithout added surfactants [J].J Pharm Sci, 2021, 110(4):1480-1494.
[25] SOLOMOS M A, PUNIA A, SABOO S, et al.Evaluatingspray drying and co-precipitation as manufacturing processesfor amorphous solid dispersions of a low Tg API [J].J Pharm Sci, 2023, 112(8): 2087-2096.
[26] NESPI M, KUHN R, YEN C W, et al.Optimization ofspray-drying parameters for formulation development atpreclinical scale [J].AAPS PharmSciTech, 2021, 23(1):28-39.
[27] HERMANS A, MILSMANN J, Li H L, et al.Challenges andstrategies for solubility measurements and dissolution methoddevelopment for amorphous solid dispersion formulations [J].AAPS J, 2022, 25(1): 11.
[28] JELI■ D.Thermal stability of amorphous solid dispersions [J].Molecules, 2021, 26(1): 238.
[29] HASER A, ZHANG F.New strategies for improving thedevelopment and performance of amorphous solid dispersions[J].AAPS PharmSciTech, 2018, 19(3): 978-990.
[30] BHUJBAL S V, PATHAK V, ZEMLYANOV D Y, et al.Physical stability and dissolution of lumefantrine amorphoussolid dispersions produced by spray anti-solvent precipitation[J].J Pharm Sci, 2021, 110(6): 2423-2431.
[31] LI J H, WANG Y H, YU D Y.Effects of additives on thephysical stability and dissolution of polymeric amorphoussolid dispersions: a review [J].AAPS PharmSciTech, 2023,24(7): 175.
[32] WILLIAMS H D, TREVASKIS N L, CHARMAN S A, et al.Strategies to address low drug solubility in discovery anddevelopment [J].Pharmacol Rev, 2013, 65(1): 315-499.
本文作者杨茜、李慧义,国家药典委员会,来源于中国医药工业杂志,仅供交流学习。

来源:Internet


