您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-21 22:04
摘 要 / Abstract
特应性皮炎在成人和多个年龄段儿科人群中均有发生。度普利尤单抗注射液是首个靶向白介素-4 受体亚基α(IL-4Rα) 的全人源化的免疫球蛋白G4(IgG4)亚类单克隆抗体,用于治疗成人和儿童人群不同程度的特应性皮炎。本文详细梳理了度普利尤单抗注射液儿科人群特应性皮炎适应症的研发历程和临床药理学研究内容。该产品采用年龄顺序从大到小、分阶段交错、逐步递进的研发策略,开展多个儿科临床研究,同时充分利用儿科人群暴露量数据与成人暴露量进行匹配,并结合暴露- 效应分析进行儿科人群的剂量选择。本文还深入分析了当前我国儿科特应性皮炎适应症研发的进展和现状,以期为我国儿童用药研发提供参考。
Atopic dermatitis occurs in adults and pediatric populations of all ages. Dupilumab injection is the first fully humanized immunoglobulin G4 (IgG4) subtype monoclonal antibody against targeting the interleukin-4 receptor subunit α(IL-4Rα), used to treat varying degrees of atopic dermatitis in both adults and children. This article reviews the development process and clinical pharmacology studies of dupilumab injection for pediatric atopic dermatitis indications. The product development strategy involved a stepwise, age-sequential approach, starting from older children to younger age groups. Multiple pediatric clinical studies were carried out progressively, utilizing pediatric exposure data to match adult exposure and combining exposure-effect analyses for dose selection in pediatric patients. The current progress and status of the development of pediatric atopic dermatitis indications in China were also analyzed, aiming to provide references for domestic pediatric drug development.
关 键 词 / Key words
度普利尤单抗;特应性皮炎;儿童用药;临床药理
dupilumab; atopic dermatitis; children's medication; clinical pharmacology
特应性皮炎(atopic dermatitis)是一种慢性、复发性、炎症性皮肤病,以皮肤干燥、慢性湿疹样皮损和明显瘙痒为基本特征,严重影响患者精神状态和生活质量。发达国家和地区儿童患病率约10%~25%, 青少年患病率约5%~20%, 成人患病率约2%~8%。儿科人群特应性皮炎患病率高于成人[1-2],临床用药需求迫切。
为鼓励儿科人群用药特应性皮炎适应症的研发,2018 年美国食品药品监督管理局(Food and Drug Administration ,FDA)发布指南[3],对药物研发过程中儿科研究的时机予以明确,建议在成人早期研究中获得有效性和安全性的初步证据之后,就开展儿科人群特应性皮炎患者的临床研究。此外,对于研究人群,FDA 建议采用年龄顺序策略,即在开展年龄较大的儿科亚群研究之后,再开展年龄较小的儿科亚群。国家药品监督管理局药品审评中心发布《成人用药数据外推至儿科人群的定量方法学指导原则(试行)》(以下简称《指导原则》),针对采用成人用药数据进行儿科人群的安全有效性外推进行了整体的指导[4],其中对于儿科外推的整体策略以及外推过程中采用的定量方法进行了较为详细和系统的介绍。《指导原则》强调“对于创新药,在首次制定儿科药物研发策略或外推计划时,通常尚无药物在成人中安全性和有效性的充分数据(例如,成人药物研发仅进行到II 期研究),在成人中的治疗窗数据往往也不够充分,无法评价暴露- 效应关系在儿科人群和成人中的相似性,因此面临更多的不确定性和知识缺口。此时的外推计划通常需收集较全面的儿科人群数据”。此外,对于剂量选择《指导原则》提出“在选择儿科人群研究中的初始剂量时,可通过匹配成人中的目标暴露量为儿科人群选择科学合理的初始剂量提供依据” 。虽然《指导原则》给予了一些针对性建议,但对于如何设计开展临床药理学研究支持儿科人群的剂量选择等暂未具体建议。
度普利尤单抗(dupilumab)是一种靶向白介素-4 受体亚基α(IL-4Rα)的全人源化的免疫球蛋白G4(IgG4) 亚类单克隆抗体, 通过与IL-4Rα 亚基结合, 抑制IL-4 和IL-13 信号传导, 从而抑制辅助型T 细胞2 介导的炎症反应,有效地阻断2 型炎症引起的皮肤屏障破坏和瘙痒,从而达到治疗作用。度普利尤单抗注射液是全球范围内首个靶向用于治疗12 岁及以上中重度特应性皮炎的靶向生物制品[5],此前皮质类固醇(topical corticosteroids,TCS) 是唯一被批准用于儿科人群的系统性用药。度普利尤单抗注射液首先于美国获批上市,目前已批准用于6 月龄以上婴幼儿中重度特应性皮炎患者,适用人群涵盖了婴幼儿至青少年的全年龄段儿科人群[6]。
本文以度普利尤单抗注射液儿科人群特应性皮炎适应症的研发为例,重点介绍了该类产品的整体研发策略以及不同年龄段剂量选择的关键考虑,并深入分析我国儿科人群特应性皮炎适应症的研发进展,以期为我国儿科人群药物研发提供参考。
1、度普利尤单抗注射液特应性皮炎儿科人群开发整体策略
在全球范围内,度普利尤单抗注射液首先在美国获批上市。本文以FDA 批准时间线为引导,梳理了度普利尤单抗注射液特应性皮炎适应症的获批情况(表1),并结合支持目标年龄段人群上市的临床试验开展情况,分析度普利尤单抗注射液儿科人群特应性皮炎适应症的整体研发策略。
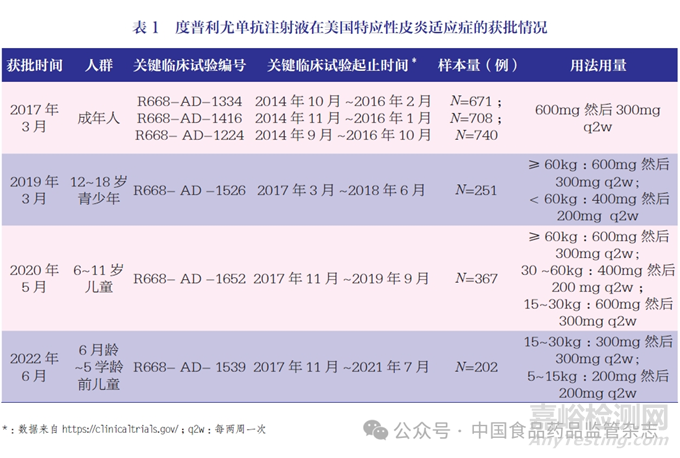
通过梳理FDA 审评报告[7-10],并结合临床试验的起止时间,笔者梳理了度普利尤单抗注射液特应性皮炎适应症的研发过程,主要情况如下。
早在2010 年5 月, 针对度普利尤单抗注射液成人特应性皮炎适应症的新药临床试验申请前会议(Pre-IND),首次对儿科人群的研发提出建议。FDA 建议申请人开始在儿科人群中的研究之前,需要确定度普利尤单抗注射液在成人(18 岁及以上)中的安全性和有效性。
2014~2016 年,申请人开展了3 项成人特应性皮炎适应症的关键临床试验。2015 年11 月,在成人临床试验期间FDA 与申请人就初步儿科人群用药研究计划(initial pediatric study plan,iPSP) 达成一致。根据商定的iPSP,申请人将在特应性皮炎儿科人群中进行以下临床研究:①一项随机、双盲、安慰剂对照的Ⅲ期临床研究,旨在研究度普利尤单抗注射液在12~18 岁中度至重度特应性皮炎患者中的疗效和安全性。②一项随机、双盲、安慰剂对照的Ⅲ期临床研究,旨在研究度普利尤单抗注射液在6~11岁严重特应性皮炎患者中的疗效和安全性。③一项Ⅱ / Ⅲ期临床研究,旨在评估度普利尤单抗注射液在6 月龄~5 岁严重特应性皮炎患者中的安全性、药动学(pharmacokinetics,PK) 和疗效。④一项开放标签扩展临床研究,评估度普利尤单抗注射液在6 月龄~18 岁以下特应性皮炎患者中的长期安全性和有效性。
此外,根据商定的iPSP,由于度普利尤单抗注射液正在研发用于治疗未充分控制或对局部外用TCS 药物不耐受的中度至重度特应性皮炎[ 例如,研究者总体评估(investigator's global assessment , IGA)≥ 3],在6月龄以下婴幼儿进行研究是不可能的或非常不切实际的,因此拟定的开发计划不包括6 月龄以下的婴幼儿。
申请人基于3 项成人Ⅲ 期临床研究结果,于2016 年7 月提交成人特应性皮炎适应症上市申请, 于2017 年3 月获批成人适应症。2017 年, 同期开展12~18 岁青少年关键临床试验(R668-AD-1526), 半年后又开展了6~11 岁儿童关键临床试验(R668- AD -1652),以及6月龄~5 岁关键临床试验(R668-AD 1539)。由于试验进度不同,以上3 项儿科人群关键研究分别为2018 年6 月,2019 年9 月以及2021 年7 月完成。度普利尤单抗注射液于2019 年3 月获批12~18 岁青少年人群,2020年5 月获批6~11 岁儿童,2022年后获批6月龄~5岁学龄前儿童。
需要注意的是, 早在2015年3 月, 即成人特应性皮炎适应症关键临床研究进行过程中,申请人同步启动了儿科人群的R668-AD-1412 临床试验, 以期了解特应性皮炎儿科人群的安全耐受性和PK 等特征。R668-AD-1412 临床试验于2016 年3月结束,早于12~18 岁青少年关键临床试验的开始时间。
基于以上整体儿科人群的研究策略,可以看出儿科人群特应性皮炎的临床表现和治疗方法与成人有一定的相似性, 并基于ICH《E11A :儿科外推》,采用部分外推的策略进行儿科人群的研发。同时,综合以上关键临床试验和支持性临床试验的研究进程可知,度普利尤单抗注射液儿科人群特应性皮炎适应症的研发具体采用了基于年龄从大到小的顺序、交错和逐步递进的方式开展儿科人群临床研究。
2、12~18 岁青少年给药方案
2.1 12~18 岁青少年的PK 数据
支持12~18 岁青少年人群的PK、安全性有效性度普利尤单抗注射液数据来自以下临床试验,见表2。
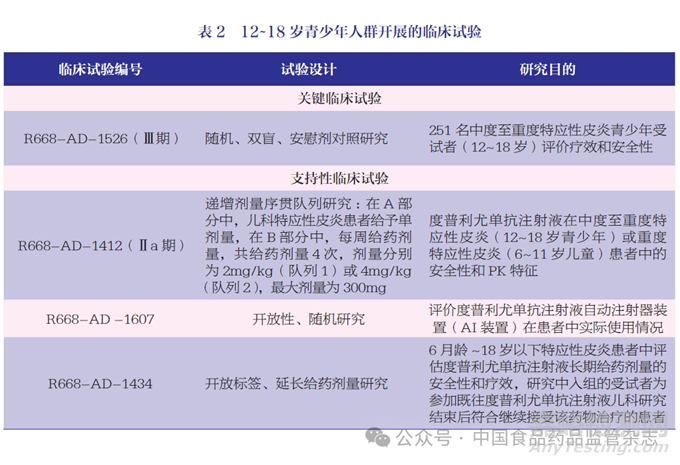
在开展目标人群关键临床试验前, 需先开展R668-AD-1412 临床试验, 以获得12~18 岁青少年较全面的PK 特征。该研究中PK 采血点包括半密集的采血以支持采用非房室模型获得药物峰浓度(Cmax)和药时曲线下面积(AUC)等PK 参数,以及多次给药的第71 天和第85天给药前进行采血,即第三、第四次重复给药剂量以获得谷浓度(Ctrough)。通过整合补充采样时间,以构建每个组完整的平均浓度-时间曲线。结果显示,12~18 岁青少年2mg/kg 和4mg/kg qw给药剂量方案下的平均稳态浓度分别与成人中300mg q2w 和300mg qw 给药剂量方案结果相似,300mg q2w 和300mg qw两个剂量是成人Ⅲ期关键临床试验中探索的剂量[11]。2mg/kg qw和4mg/kg qw 方案之间的Ctrough呈线性剂量比例趋势,为Ⅲ期临床试验剂量水平和暴露的选择提供了支持,并表明靶点介导途径饱和(即达到最佳疗效所需的最低条件)。
基于成年健康人群和特应性皮炎患者的PK 数据建立了群体PK 模型[12]。群体PK 模型显示,体重对度普利尤单抗暴露具有显著影响并具有临床意义。为了进一步支持12~18 岁青少年人群的剂量选择,解释与成人的体型差异,确定了接受体重分级给药剂量方案的青少年的度普利尤单抗注射液稳态暴露情况与批准的成人给药剂量方案的暴露情况进行比较。12~18 岁青少年人群在关键临床试验R668-AD-1526 的给药剂量设置如下:①基于固定体重分层的度普利尤单抗注射液q2w 给药剂量治疗,患者基线体重60kg 以下, 皮下注射(SC)度普利尤单抗,第1 天给予负荷剂量400mg, 然后从第2 周~第14 周200mg q2w 给药剂量;患者基线体重60kg 及以上, SC度普利尤单抗,第1 天给予负荷剂量600mg, 然后从第2 周~第14 周300mg q2w 给药剂量;患者基线体重60kg 以上12~18岁的青少年给药剂量剂量同成人获批剂量一致。②未基于体重分层的度普利尤单抗注射液 q4w 治疗:SC 度普利尤单抗,第1 天给予负荷剂量600mg,然后从第4周~ 第12 周300mg q4w 给药剂量。
同时在关键临床试验R668-AD-1526 中在基线( 第1 天给药剂量前), 第2、4、8、12 和16 周给药剂量前,第28 周研究结束时持续采集药物浓度获得PK数据,结果显示:各给药剂量方案在第12 周达到了稳态。在第16 周,200mg/300mg q2w 和300mg q4w 给药剂量方案的度普利尤单抗Ctrough 的x¯±s分别为(54.5±27.0)mg/ml和(19.8±15.9)mg/ml。
2.2 基于暴露匹配的儿科外推过程
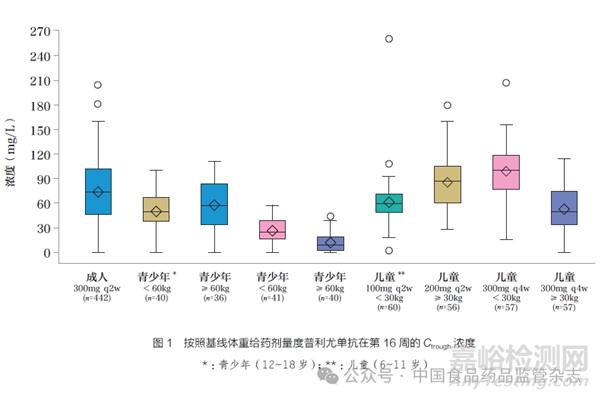
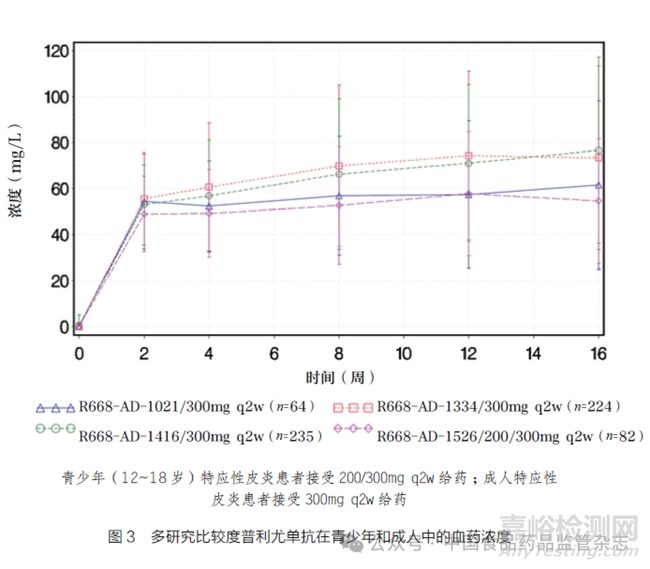
在外推过程中收集儿科人群的PK 信息,一方面要表征儿科人群的PK 特征,另一个非常重要的方面是将儿科人群的暴露与成人进行比较。在青少年中,体重60kg 以下患者200mgq2w (51.3mg/L) 给药剂量和体重60kg 及以上患者300mgq2w(57.9mg/L) 给药剂量的Ctrough 中位值低于成人300mg q2w(74.6mg/L)给药剂量。体重60kg 以下患者300mg q4w(27.2mg/L) 给药剂量和体重60kg 及以上患者300mg q4w(12.7mg/L) 给药剂量的平均Ctrough 分别为成人300mg q4w给药剂量的37% 和17%(图1)。同时,基于模型模拟表明,在青少年中总体暴露量略低于成人。
2.3 暴露- 效应关系
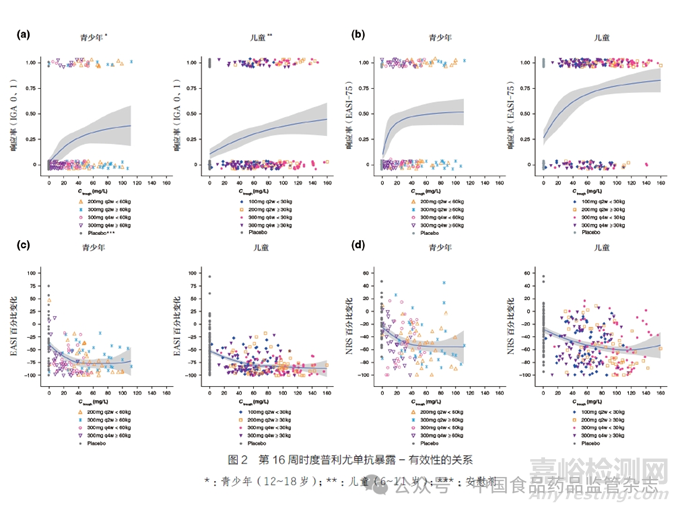
除了对青少年人群的PK 特征进行探索和比较外,申请人也对度普利尤单抗注射液青少年人群的暴露- 效应关系进行了分析。使用度普利尤单抗暴露与药物效应的散点图[ 湿疹面积和严重程度指数(eczema area andseverity index,EASI) 评分和每日峰值瘙痒(numeric ratingscale,NRS) 评分中基线的百分比变化] 或二元疗效终点的逻辑回归( 达到IGA 0 或1 和EASI-75 的比例)进行暴露- 有效性的关系研究。采用第16 周时度普利尤单抗的Ctrough 作为主要暴露指标;有效性终点的非线性logistic 回归分析采用非线性Emax函数表征E-R 曲线[13],如图2所示。结果显示,在度普利尤单抗注射液治疗的青少年特应性皮炎患者中,观察到暴露与有效性呈正相关。同时, 根据青少年200/300mg q2w 的体重分级给药剂量方案表明,对于有效性指标IGA 得分为0 或1,模型预测的稳态浓度谷值接近其各自E-R曲线的平台值。在第16 周时,EASI-75 的E-R 关系、EASI与基线的百分比变化以及NRS与基线的百分比变化在各年龄组中都观察到了类似的结果。
在成人和青少年特应性皮炎Ⅲ期临床试验中,度普利尤单抗组患者的结膜炎发病率高于安慰剂组患者,因此对第16 周度普利尤单抗Ctrough 与结膜炎发生概率之间的潜在关系进行了评估。线性逻辑回归分析显示:①结膜炎的发生率与度普利尤单抗的浓度之间没有关系;②缺乏剂量限制性不良事件和暴露- 安全关系。
2.4 给药剂量方案合理性评估
度普利尤单抗注射液的获批青少年剂量为体重60kg 以下:400mg 然后 200mg q2w ;体重60kg 及以上:600mg 然后 300mg q2w。Ⅲ 期临床试验R668-AD-1526 的有效性和安全性数据全面支持体重分级给药剂量方案的合理性,具体评估流程包括:① Ⅲ 期临床试验R668-AD-1526 中, 体重60kg以下接受200mg q2w 方案的青少年和体重60kg 及以上接受300mg q2w 方案的青少年在第16 周时获得了相似的度普利尤单抗血清浓度。群体PK 分析还表明,体重分级的200mg/300mg q2w方案在两个体重组之间度普利尤单抗-x、峰值和Ctrough 的稳态下暴露相似。②整个给药剂量期间,接受200/300mg q2w 给药剂量方案的青少年特应性皮炎患者的度普利尤单抗浓度与接受批准的300mg q2w 给药剂量方案的成人特应性皮炎患者的浓度相似,如图3 所示。③在度普利尤单抗注射液治疗的青少年特应性皮炎患者中,观察到疗效与E-R 呈正相关。④在青少年关键临床试验R668-AD-1526 中观察到的最常见的不良事件是结膜炎。发生结膜炎的患者百分比与度普利尤单抗浓度四分位数的增加顺序相似,也能够表明结膜炎缺乏E-R关系 。
3、6~11 岁儿童的给药方案
3.1 6~11 岁儿童的PK数据
度普利尤单抗注射液支持6~11 岁儿童的PK、安全性有效性数据来自以下研究:①关键临床试验R668-AD-1652 是一项随机、双盲、安慰剂对照研究,纳入367 名(6~11 岁)患有严重特应性皮炎的儿童,评价度普利尤单抗联用外用TCS 的疗效和安全性。② 2 项支持性临床试验的PK 结果,分别来自临床试验R668-AD-1412 和R668-AD-1434。
在开展目标人群Ⅲ 期关键临床试验前, 需先开展临床试验R668-AD-1412, 以获得6~11 岁儿童的PK 结果。在度普利尤单抗注射液儿科项目的早期阶段,Ⅱa 期临床试验R668-AD-1412 被用于预测Ⅲ期临床试验的血药浓度。Ⅲ期临床试验的剂量选择、剂量调整和体重临界值的选择是基于Ⅱa 期临床试验设计期间进行的模拟, 目的是确保青少年的Ctrough 与成人300mg q2w 的数据相似, 且不超过成人的Cmax。因此,Ⅲ期临床试验的剂量设置为,①基于固定体重分层的度普利尤单抗q2w治疗组:基线体重在15~30kg 以下的患者:第1 天给予200mg负荷剂量,之后在第2~14 周进行度普利尤单抗100mg q2w SC给药。基线体重在30kg 及以上的患者:第1 天给予400mg 负荷剂量,之后在第2~14 周进行度普利尤单抗200mg q2w SC 给药。②未基于体重分层的度普利尤单抗q4w 治疗组:在不考虑体重的情况下,第1 天给予600mg负荷剂量,之后在第4~12 周进行度普利尤单抗300mg q4w SC给药;将所有基线体重15kg 及以上的患者随机分配至q4w 组接受该方案(注:按照体重30kg以下和30kg 及以上对该治疗组患者进行分层)。
同时在关键临床试验中持续收集PK 数据,即在第0、4、8、12、16 周(治疗结束)给药前收集血清样本,然后在第24 周和48 周(研究结束)随访时收集血清样本。结果显示, 在主要临床试验终点评估之前( 即第16 周), 药物已达到稳定状态;q2w 给药方案在第8 周达到稳定状态,q4w 给药方案在第12 周达到稳定状态。在第16 周时,300mg q4w、200mg q2w和100mg q2w 给药方案中度普利尤单抗的血药浓度x¯±s 分别为(76.3±37.2)、(84.5±36.2)mg/L 和(61.5±33.1)mg/L。
3.2 基于暴露匹配的儿科外推
通过对6~11 岁儿童PK 结果与12~18 岁青少年以及成人比较可知, 体重30kg 以下组300mg q4w(98.7mg/L)和体重30kg 及以上组200mg q2w(86.0mg/L)的第16 周Ctrough 都超过成人的300mg q2w 给药组,而体重30kg 以下组100mg q2w给药剂量(62.6mg/ L) 和体重30kg 及以上组300mg q4w 给药剂量(53.9mg/L)的第16 周Ctrough 较低,但与成人和12~18岁青少年患者q2w 给药剂量方案在一个相似的范围内。
基于模型分析表明,在体重30kg 及以上接受200mg q2w 给药剂量的6~11 岁儿童和体重30kg 以下接受300mg q4w 给药剂量的6~11 岁儿童,稳定状态下Ctrough与接受300mg q2w 给药剂量的成人相似或更高。所选给药方案在儿童中的暴露量通常高于接受300mg q2w 给药剂量的成人,但在体重30kg 及以上接受200mg q2w 给药剂量的6~11岁儿童和体重30kg 以下接受300mg q4w 给药剂量的6~11岁儿童中,稳态下最大浓度的第95 百分位数低于接受300mg qw给药剂量的成人(成人测试的最大暴露量)。
3.3 暴露- 效应关系
暴露- 有效性关系显示,在第16 周达到IGA 0、1 和EASI-75 的概率表明,与100mg q2w给药方案相比,300mg q4w 给药方案在体重30kg 以下6~11岁儿童中的平均Ctrough 暴露更接近各自E-R 关系的平台期,100mg q2w 给药剂量在稳态下Ctrough 较低。暴露- 安全性关系显示,6~11 岁儿童使用度普利尤单抗至第16 周发生结膜炎的logistic 回归相关概率显示,较低药物浓度下发生结膜炎的概率最高,较高药物浓度下发生结膜炎的概率最低,呈E-R 负相关趋势。该观察结果与安全性研究结果一致,表明100mg q2w 给药剂量方案(低剂量暴露)的结膜炎不良事件发生率较高。
3.4 给药剂量方案合理性评估
6~11 岁儿童度普利尤单抗注射液上市获批剂量为30~60kg:400mg然后 200mg q2w ;15~30kg :600mg 然后 300mg q4w。Ⅲ期临床试验R668-AD-1652 的有效性和安全性数据全面支持体重分级给药剂量方案的合理性,PK和E-R 分析结果进一步支持剂量合理性,具体给药剂量方案如下:①在Ⅲ期临床试验R668-AD-1652 中, 体重15~30kg的6~11 岁儿童接受300mgq4w 给药方案;体重30kg 及以上的6~11 岁儿童接受200mgq2w 给药方案,在第16 周获得相似的度普利尤单抗血药浓度。②基于群体PK 模型模拟的度普利尤单抗暴露比较表明,在体重30kg 以下的6~11 岁儿童中,给药剂量方案为300mg q4w 的度普利尤单抗暴露(Ctrough, Cmax和AUC) 高于12~18 岁青少年(200/300mg q2w) 和成人(300mg q2w),而在体重30kg以下的6~11 岁儿童中, 给药剂量方案为100mg q2w 的度普利尤单抗暴露与批准剂量下12~18 岁青少年和成人的预测暴露更具可比性。③ 暴露- 有效性关系以及暴露- 安全性关系均证明,给药剂量方案为:体重30kg 以下6~11 岁的儿童中300mg q4w,有更多患者达到有效性平台,且发生结膜炎的概率较低。
4、6 月龄~5 岁学龄前儿童给药方案
4.1 6 月龄~5 岁学龄前儿童的PK 数据
6 月龄~5 岁学龄前儿童特应性皮炎患者的PK、安全性、有效性数据来自一项单随机、多中心、安慰剂对照的Ⅱ / Ⅲ期临床试验R668-AD-1539[14]。临床试验R668-AD-1539 A 部分是一项开放标签、多中心、Ⅱ期序贯、两年龄队列、双剂量水平的研究。首先入组的是年龄较大的患者(2~5 岁),其次是年龄较小的患者(6 月龄~1 岁)。每个队列中有10 名患者的亚组接受较低体重剂量(3mg/kg)治疗,然后另一个亚组接受较高剂量(6mg/kg)治疗。在单次SC 度普利尤单抗后的4 周内,给药后第1、 3、8、18 以及29 天进行PK 采样,同时进行安全性监测和疗效评估。预计6 月龄~5 岁学龄前儿童6mg/kg 给药剂量与成人患者单次给药度普利尤单抗 300mg的药物暴露相当。Part A 在2017 年12 月20 日~2019 年7 月22 日期间进行,共入组了40 例患者(20 例/ 年龄队列,10 例/ 剂量水平)。
临床试验R668-AD-1539B 部分:主要目的是证明在16周的治疗中,6 月龄~5 岁患有中到重度特应性皮炎的学龄前儿童受试者中,同时使用局部外用TCS 时,多剂量度普利尤单抗的疗效。162 名患者随机分配接受度普利尤单抗(n=83)或安慰剂(n=79)加局部外用TCS。患者被随机(1 ∶ 1)分配到皮下安慰剂或度普利尤单抗组(给药剂量:体重5~15kg :200mg ;体重15~30kg :300mg)4w, 加低效外用TCS(1% 醋酸氢化可的松乳膏),共给药16 周。同时临床试验R668-AD-1539 B 部分需持续收集PK 样本:在基线和第4、8、12 和16 周采集血样检测度普利尤单抗血药浓度。
临床试验R668-AD-1539A 部分研究结果显示,在每个年龄队列中,单次SC 度普利尤单抗后的PK 暴露以大于给药剂量比例增加的方式。在每个年龄队列中,较高的6mg/kg 度普利尤单抗给药剂量比较低的3mg/kg给药剂量血清中浓度高,持续时间长。在各个剂量水平下,年龄队列之间的血清中度普利尤单抗的最大浓度相似,并且大部分患者在SC 度普利尤单抗后2 天观察到最大浓度。
临床试验R668-AD-1539B 部分结果显示,体重5~15kg接受度普利尤单抗 200mg q4w给药和体重15~30kg 接受度普利尤单抗 300mg q4w 给药的受试者中,度普利尤单抗随时间变化的平均浓度表现出相似的特征。300mg q4w 给药方案度普利尤单抗的全身浓度约在第12 周达到稳定状态,而200mg q4w 给药方案的最高平均浓度在第16 周观察到。在6 月龄~5 岁患有特应性皮炎的学龄儿童受试者中,给药300mg q4w ( 体重15~30kg)或200mg q4w ( 体重5~15kg)后,度普利尤单抗稳态浓度的x¯±s分别为(110±42.8)mg/L 和(109±50.8)mg/L。
合并既往度普利尤单抗开展的22 项临床研究(包括健康人和特应性皮炎患者,成人和儿科人群)的全部暴露数据进行群体PK 建模和分析。结果显示,在所有研究人群中,体重是最终综合群体药动学(PopPK) 模型中线性清除率和中央分布体积的重要协变量。虽然年龄不是影响6 岁以上患者PK 的因素,但6月龄~5 岁学龄前儿童受试者经历一个影响度普利尤单抗清除的成熟过程。因此,在该儿童亚组中,度普利尤单抗清除率受到年龄和体重的影响,清除率随着年龄的增长而增长,估计在大约6岁时达到最终成熟。值得注意的是,PopPK 分析中纳入小于2岁学龄前儿童受试者数量有限,预测2 岁以下学龄前儿童受试者暴露的能力可能会受到限制,因为该亚年龄组的成熟过程以及评估的受试者数量有限。
4.2 基于暴露匹配的儿科外推
6 月龄~5 岁的学龄前儿童在体重5~15kg 的受试者中使用度普利尤单抗 200mg q4w 给药剂量, 在体重15~30kg 的受试者中使用300mg q4w 给药剂量后,其平均度普利尤单抗Ctrough高于已批准方案的成人和12~18 岁青少年,但6 月龄~5 岁的学龄前儿童受试者的总体度普利尤单抗Ctrough 与已批准方案的6~11 岁儿童的总体度普利尤单抗Ctrough大致相似。同时,6 月龄~5 岁学龄前儿童受试者的平均度普利尤单抗Ctrough 低于先前研究的成人300mg qw 的给药方案,如图4所示。
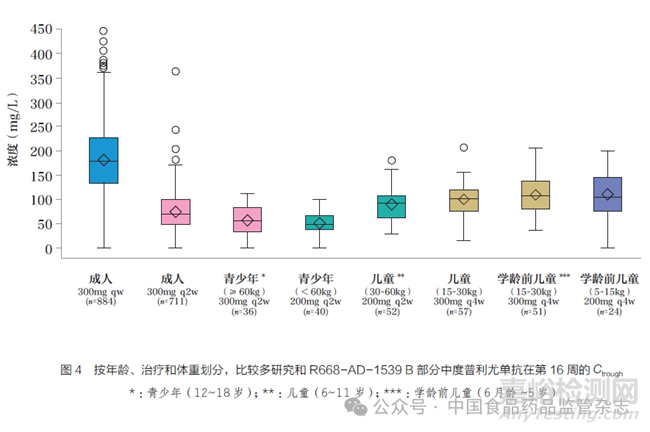
鉴于PopPK 分析表明, 在考虑体重差异后,6 月龄~5 岁学龄前儿童受试者中, 年龄的增加与清除率的增加有关, 因此,进一步分析了年龄较小亚组(即2 岁以下)的度普利尤单抗Ctrough,并与2~5 岁学龄前儿童特应性皮炎患者的Ctrough 进行了比较。结果显示,在第16 周时,2 岁以下受试者的平均度普利尤单抗Ctrough 高于2~5 岁受试者的200mg q4w 给药剂量的度普利尤单抗Ctrough,但两个年龄亚组的度普利尤单抗平均Ctrough 均低于成人300mg qw 给药剂量的平均Ctrough。
4.3 暴露- 效应关系
暴露- 有效性的关系:暴露指标为第16 周度普利尤单抗Ctrough,有效性指标为在第16 周达到IGA 评分0、1 和EASI-75。结果显示,随着血清中度普利尤单抗Ctrough的增加, 有效性增加。暴露- 安全性的关系:未发现度普利尤单抗第16 周时Ctrough 与结膜炎发生率之间的关系。
4.4 给药剂量方案合理性评估
6 月龄~5 岁学龄前儿童人群的上市获批剂量为体重5~15kg :200mg,然后200mg q4w SC ;15~30kg :300mg,然后300mgq4w SC。Ⅲ期临床试验R668-AD-1539 的有效性和安全性支持给药剂量方案是合理的,PK 和E-R 分析结果进一步支持了给药剂量合理性,分析结果为:①两个主要临床试验终点的统计分析表明,与接受安慰剂的患者相比,接受度普利尤单抗治疗的患者在第16 周达到IGA 0、1 的受试者比例和在第16 周达到EASI-75 的受试者比例均较高。②Ⅲ期临床试验R668-AD-1539 B部分主要疗效终点的暴露- 反应结果表明,随着血清度普利尤单抗Ctrough的增加, 有效性增加。③根据Ⅲ期临床试验R668-AD-1539 B 部分数据,在第16周时未观察到广义或狭义结膜炎的E-R 关系。④先前临床试验中成人给药剂量为300mg qw,其安全性数据为6 月龄~5 岁学龄前儿童人群提供了支持性的安全性数据。
5、我国儿科特应性皮炎适应症临床研究概况
《中国新药注册临床试验进展年度报告(2023 年)》[15] 显示“2023 年仅在儿童人群中开展的临床试验数量和在新药临床试验中的占比均增长,且Ⅲ期临床试验占比最高”。“在 104 项儿科试验中,Ⅲ期临床试验占比最高,达 34.6%(36 vs 104);在36 项Ⅲ期临床试验中,位于前两位的适应症分别为预防性疫苗和皮肤及五官科药物”。因此,为了进一步全面了解我国儿科特应性皮炎适应症临床试验的开展情况,笔者通过药物临床试验登记与信息公示平台检索关键词“特应性皮炎”,截至2024 年6 月19 日,共检索201 条相关临床试验,排除“生物等效性研究”、仅成人受试者的研究、局部用药、中药以及细胞治疗等条件,共得到22 项临床试验涉及儿科人群。其中Ⅲ期临床试验共13 项,上市后/ 真实世界研究共4 项,5 项Ⅰ / Ⅱ期临床试验。
登记的13 项Ⅲ期临床试验中,9 项研究同时纳入青少年和成人患者;4 项Ⅲ临床试验仅纳入12 岁以上的青少年。4 项上市后/ 真实世界研究中,2 项研究仅纳入6~18 岁(不含18 岁)儿科患者,另2 项研究同时纳入12 岁以上青少年和成人患者。
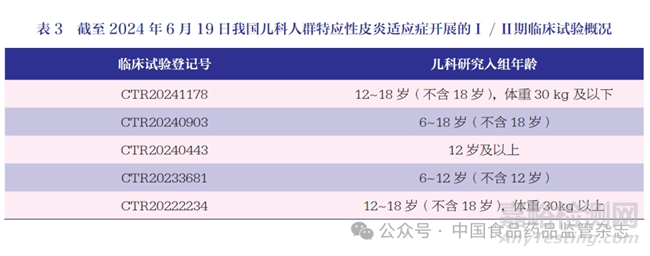
5 项Ⅰ / Ⅱ期临床试验均仅纳入儿科人群,具体入组人群特征,见表3,仅1 项研究试验状态显示已完成,其他4 项研究正在进行中。
4 项上市后/ 真实世界研究的药物为乌帕替尼缓释片和度普利尤单抗注射液,其中2 项研究仅纳入6~18 岁(不含18 岁)患者,均为在境外已完成较充分的儿科临床研究,在我国继续收集我国儿科人群的安全性数据。
此外,目前提交至监管机构的沟通交流问题,在临床药理学方面多与PK 采样点设置、PK样本量以及儿科人群给药剂量有关。表明我国研发机构已经切实考虑儿科人群特应性皮炎临床研究的试验设计,前瞻性的收集相应数据。
综上,根据我国相关企业登记的儿科人群临床研究显示,我国创新药临床研究入组人群最低年龄6 岁,体重30kg 以上均处于Ⅰ / Ⅱ期临床试验阶段,6~12岁(不含12 岁)儿科人群尚未进入Ⅲ期临床试验阶段。同时与度普利尤单抗临床试验儿科人群相比,尚未开展6 岁以下的更小年龄段人群的临床研究,表明未来我国对整体儿科特应性皮炎的研发还有待进一步深入。同时,儿科人群的PK 采样点设置较稀疏,样本量较小可能对后续表征儿科人群PK 特征以及后续进行暴露-效应分析有一定的局限性。
6、总 结
本文通过以度普利尤单抗注射液儿科人群特应性皮炎适应症的研发过程为例,全面梳理了该产品的整体研发策略以及不同年龄阶段的临床试验开展和给药剂量选择。通常情况下,成人用药数据外推至儿科人群,将不同年龄段儿科人群的暴露量,与成人暴露量进行匹配,进而对儿科人群的暴露- 效应关系进行分析,获得儿科人群给药剂量,再利用成人数据外推支持儿科人群的安全有效性[16]。度普利尤单抗儿科人群与成人暴露量匹配原则是儿科人群中度普利尤单抗剂量选择重要依据,但由于度普利尤单抗是首个在儿科特应性皮炎患者中具有新的作用机制的全身治疗药物,研发之初儿科人群的暴露-效应关系数据有限,因此与完全外推的情况不同,在利用成人数据外推儿科人群安全有效性时,仍需考虑儿科人群的暴露- 效应关系。
在度普利尤单抗儿科特应性皮炎适应症临床试验研发过程中,一般遵循在儿科人群研发早期阶段首先获得相应年龄人群的PK特征,研究结果用于预测Ⅲ期临床试验的儿科人群暴露,通过暴露量匹配,在Ⅲ期临床试验中设置了2 个剂量组并在Ⅲ期临床试验中同时收集儿科PK 数据,以充分支持不同年龄段人群中的暴露- 效应关系,进而支持给药剂量选择。此外,随着数据的不断丰富,模型也不断更新,表明模型具有“学习- 确认”循环过程。文献以及FDA 审评报告显示,描述度普利尤单抗注射液6 月龄以上儿科人群PK 特征并支持暴露量比较的最终群体PK 模型纳入了度普利尤单抗特应性皮炎适应症研发的全部PK 数据。同时,还需注意到,度普利尤单抗相应儿科人群暴露- 效应分析是充分的。笔者认为有几点值得我国研发人员参考,包括:①制定科学合理的研发策略。对于儿科特应性皮炎适应症,可充分考虑成人安全有效性的数据后再开展儿科人群的临床研究,采用年龄从大到小、分阶段交错、逐步递进的方式开展多个儿科临床研究。②充分评价儿科人群的安全有效性,儿科人群的数据充分性是关键。数据包括但不限于不同年龄段和体重范围的儿科人群的暴露范围,这种设计可以保证剂量组设计较为合理,且样本量足够,同时PK样本采样点设置科学合理,为后续群体PK 模型的建立和暴露-效应分析提供了较充分的数据支持。③进行暴露- 效应分析时,暴露指标选择应进行论证并具有合理性,有效性指标可为临床试验终点指标等,此外还需分析儿科人群中特别关注的不良事件。
度普利尤单抗注射液儿科特应性皮炎适应症的高效成功研发,离不开制定了科学合理的总体研发策略,执行过程中充分的数据收集,持续的数据分析并采用模型引导的研发理念。相关经验值得我国研发机构借鉴,以加速我国儿科人群药物研发,早日惠及我国儿科患者。

来源:中国食品药品监管杂志


