您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-23 08:25
一、使用中稳定性的意义
稳定性研究是确保药品质量的关键因素之一,稳定性研究可分为常规稳定性和使用中稳定性。通过药品常规稳定性研究我们可以确认药品的货架期,指导患者在货架期内购买和使用药品。通过使用中稳定性可以确认药品使用中的存储条件和开启后的使用期限,对保障临床用药安全具有重要作用。
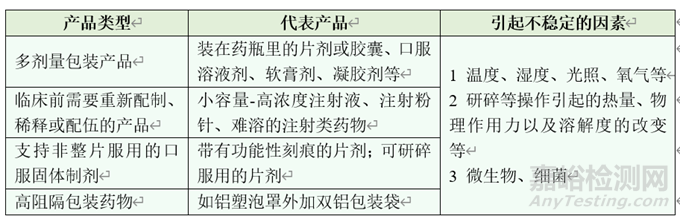
二、使用中稳定性的研究对象
表1 产品使用中稳定性研究对象
三、指导原则
相比于常规稳定性,针对使用中稳定的指导原则行对较少,描述也不够详细,一方面是由于对使用中稳定性的重要性的认识还不够深刻,另一个重要原因是因为使用中稳定性需模拟的使用场景更复杂多变,特别是在家庭用药时,回想一下,你是不是在书柜、餐桌、梳妆台、窗台等等很多地方都看见过临时存放的药品呢,还有短途旅行中药品的存放,这些都增加了模拟使用场景的难度,因此没有哪个指导原则可以清楚明白的指出使用中稳定性应该考察哪些条件,考察多长时间。
但是不管这件工作有多艰难,监管部门还是在积极努力的不断更新现有的指导方针,不断具象化使用中稳定性的试验设计方案,为使用中稳定性研究的开展提供更加明确的指导。药品使用中稳定性相关指导原则见下表。
表2 产品使用中稳定性指导原则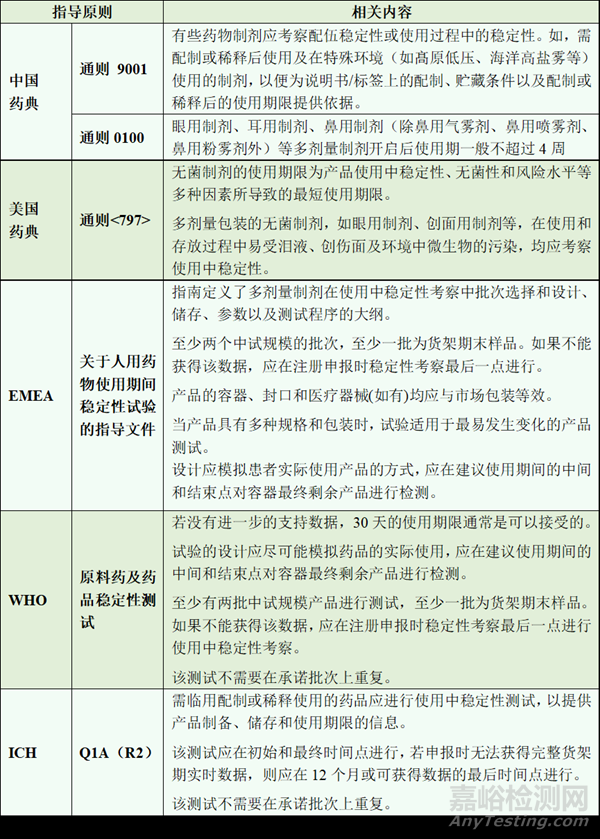
四、试验方案
使用中稳定性试验设计的核心是“模拟实际应用”,模拟有两个层面,一是储存环境,二是使用方法,就是在什么样的条件下,间隔多长时间,取样几次,每次取用多少样品。由于药物自身特点(如剂型、剂量、用法、用量、贮存条件、稳定性等)不同,使用中稳定性试验具有特异性,应具体药品具体分析。
表3 产品使用中稳定性方案设计要点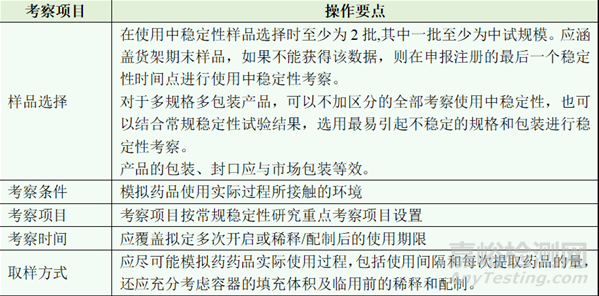
这里还有2个在试验设计之初需要着重考虑的问题:
(1)经过多次取样后,研究结束时最终剩余样本数量有限,样品量是否能满足检测需求,如不能需加大放样量。
(2)对于注射产品(输液)和外用(皮肤)药品等产品,其使用过程中接触环境更为复杂,易接触大量的光照,因此在方案设计时需对光稳定进行慎重全面的思考。
五、案例
案例1 多剂量口服固体制剂
拉西地平片对光及水分均敏感,市售产品采用防潮、防光的HDPE瓶作为容器,在使用过程中,反复打开容器容易造成药品微生物污染和物理化学降解,文献3对多剂量拉西地平片进行使用中稳定性研究。作者分别在稳定性研究初始及拟定的有效期结束时进行2次使用中稳定性考察。取样方案为每天打开一次,每次取出1片,直至考察期结束。其中物理特性(如外观、硬度、崩解度等)每日检测,化学性质(如有关物质、干燥失重、溶出度、含量等)每7天检测,微生物特性每14天检测,结果表明容器开启后28日内可保障使用。
案例2 多剂量口服液体制剂
文献4拟开发氨氯地平口服液制剂,为确定其开启后使用期限开展了使用中稳定性研究,研究方案为将制剂在4°C下保存,每天2量取出冷藏箱进行给药模拟,在每次给药模拟时暴露在空气、光和环境温度下30分钟并取出0.4 mL的样品,直到剩余25 mL,之后继续给药模拟,不采样。结果表明该制剂在使用过程中,稳定性可达18周。
案例3 注射液
文献5研究了奥扎格雷氨丁三醇注射液的配伍稳定性,具体做法为取奥扎格雷氨丁三醇注射液分别注入0.9%氯化钠注射液和5%葡萄糖注射液中,然后将配伍后的溶液贮存于室温正常光线下,分别于0,2,4,6,8,24h取样,考察性状、pH、有关物质、不溶性微粒、可见异物及含量。结果表明,奥扎格雷氨丁三醇注射液于0.9%氯化钠注射液和5%葡萄糖注射液配伍后24h内稳定,可保障临床使用安全。
案例4 鼻用制剂
鼻用制剂通常含有一定量的防腐剂,然而,大多数防腐剂会产生不良的副作用,影响鼻子的清除和防御机制,如抑制纤毛运动,为避免使用防腐剂,研究人员设计了多种多剂量装置,3K体系是其中一种。文献6考察了3K体系中鼻用制剂的使用中稳定性。通过将喷嘴反复浸入含细菌的悬浮液中,同时从系统中排出剂量来模拟喷嘴区域周围的潜在污染。每天重复模拟两次,持续4天,结束3天后测试第一剂。然后在最后一个测试期结束时,对第一剂进行测试(如图1)。结果表明开启后可使用6个月。
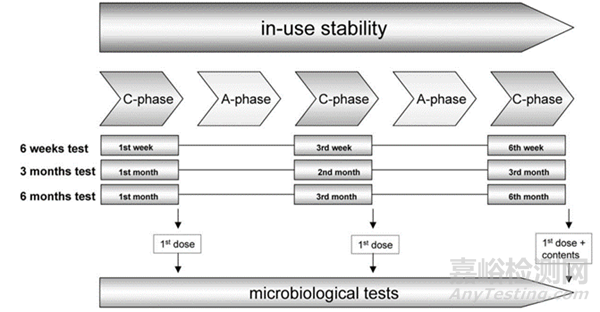
图1 3K稳定性试验取样方案示意图(图片来源于文献6)
案例5 眼用制剂
文献7对几种不同的眼用制剂进行了使用中稳定性研究。依据各制剂推荐的存储条件及用法用量,稳定性考察方案设计如下表。结果表明所研究的几种眼用制剂开启后分别在28天和14天内维持稳定。

六、结束语
虽然针对使用中稳定性的指南、示例相对较少,对稳定性试验设计的描述也详细性欠佳,但使用中稳定性对指导临床用药操作具有不可替代的作用,我们也应以对待正式稳定性的态度同样对待使用中稳定性,尽量设计合理的考察方案,以确保药品在真实的使用场景下能够维持安全、有效。
参考文献
[1]Hitesh Chavda,In-use stability studies: guidelines and challenges,Drug Development and Industrial Pharmacy,Volume 47, 2021 issue 9,page1373-1391
[2]赵娜,药物使用中稳定性研究的技术要求及方法探讨,中国临床药理学杂志,第37卷第 15期2021年8月(总第341期),2108-2112。
[3]Mukharya A, Patel PU, Chaudhary S. Evaluation of “in-Use” stability period of lacidipine tablets in multi-dose plastic container-closure.PCI- Approved-Ijpsn. 2013;6(2):2022–2032.
[4 ]A.C. van der Vossen,Design and stability study of an oral solution of amlodipine besylate for pediatric patients,Eur J Pharm Sci. 2016 Sep 20;92:220-3.
[5]姚贺东,奥扎格雷氨丁三醇注射用浓溶液使用中及低温冻融稳定性研究,食品与药品,2024年第26卷第1期,1-5。
[6]Bagel S, Wiedemann B. Extension of in-use stability of preservative-free nasalia.Eur J Pharm Biopharm. 2004;57(2):353–358.
[7] Shin S, Won Jang K, Sun S, etal. The in-use stability study of multi-use ophthalmic solutions, focused on olopatadine, fluorometholone, dorzolamide. Timolol. J. Korea Acad. Industr. Coop. Soc. 2019;20:681–693.

来源:药事纵横