您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-09-24 18:09
样品制备是 LC-MS 方法的第一步,对于提高灵敏度至关重要。
提高灵敏度的一个常用方法是:增加用于萃取的样品量或进样量。这种简单易行的方法对于纯净的标准溶液非常有效。
然而,对于真实的生物样品,如果缺乏适当的样品制备过程来获得干净的样品提取物,则可能无法达到预期的灵敏度提高效果。有时甚至会导致灵敏度下降,因为增加样品体积或进样体积也会增加提取样品中的基质成分。
除了目标物之外,生物样本中还存在各种内源性成分(如蛋白质、脂类、盐类),它们的含量通常比分析物高得多。如果这些成分被带入提取样品中,并与分析物发生共洗脱,导致在质谱分析过程中(尤其是在使用电喷雾电离时),可能出现抑制或增强分析物的电离(基质效应)。
基质效应会严重影响 LC-MS 生物分析测定的灵敏度、准确度和精确度。回收率是正确的样品制备策略需要考虑的另一个重要因素,因为一般来说,回收率越高,灵敏度就越高。
理想的样品制备方法应能从生物样品中 100% 地回收分析物,并去除所有基质成分,从而最大限度地提高灵敏度。
然而,在实际应用中很难实现理想的样品制备。能提取大部分分析物的样品制备方法可能也会提取大量基质成分,导致严重的基质效应(如果不能通过色谱法解决)。反之亦然,一种方法可以提取出非常干净的样品,但分析物的回收率却很低。
因此,为了提高灵敏度,应同时评估基质效应和回收率,以获得最佳的样品制备方法,而这往往是两者的折衷。
对于小分子分析物而言,蛋白质和盐类相对容易从生物样本中去除。磷脂由于同时具有疏水(两个脂肪酸"尾部")和亲水(磷酸盐"头部")官能团的两亲性质,通常很难去除。血浆中丰富的磷脂已被证明是小分子生物分析 LCMS 检测中基质效应的主要来源之一。
因此,确保在样品提取过程中有效去除磷脂已成为提高小分子生物分析检测灵敏度、质量和稳健性的常用方法。
对于蛋白质分析物的 LC-MS 生物分析,生物样品中的高丰度内源性蛋白质(如血清白蛋白、免疫球蛋白)是基质效应的主要来源。与蛋白质分析物相比,血浆/血清中这些内源性蛋白质的浓度通常要高得多。
其中一些蛋白质(或其消化后产生的肽)可能与蛋白质分析物(或其相应的替代肽)具有相似的理化性质,因此很难将其从感兴趣的蛋白质(或肽)中分离出来,并可能导致严重的离子抑制、高背景噪声以及对 LC-MS 分析的潜在干扰,从而严重降低检测灵敏度。
目前已开发出多种样品提取策略。对于小分子分析物,蛋白质沉淀(PPT)、液液萃取(LLE)和固相萃取(SPE)是最常用的样品制备方法。对于多肽和蛋白质分析物,SPE、PPT 和免疫亲和萃取(IAE)被广泛使用。下表总结了这些样品制备策略的优势和局限性,接下来将详细介绍。
表 1. 不同样品制备方法的比较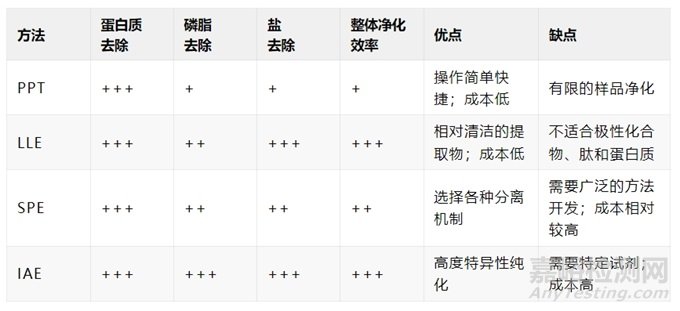
注:+ 表示低;++ 表示中等;+++ 表示高
蛋白沉淀法(Protein Precipitation, PPT)
在 PPT 中,向生物样本中加入变性剂,使大部分蛋白质从溶液中沉淀出来。然后通过离心等方法分离固态和液态成分,并对液态上清液进行分析。PPT 方法简单、快速、成本效益高,通常可以实现很好的回收率,尤其是对小分子分析物而言。然而,由于其样品净化能力有限,在得到的上清液中仍会存在大量基质成分,这可能会对分析物造成严重的基质效应,影响检测灵敏度。
此外,PPT 过程中不存在样品浓缩的因素(事实上,样品经常被稀释!)。因此,PPT 通常不是提高检测灵敏度的首选。

图 1. 蛋白沉淀法示意图
(图片来源:"Multi-step Preparation Technique to Recover Multiple Metabolite Compound Classes for In-depth and Informative Metabolomic Analysis". )
PPT 可用于强蛋白质结合的分析物,因为它能有效地解离结合,将分析物从蛋白质中释放出来,从而提高回收率并最大限度地提高灵敏度。
此外,由于 PPT 比 LLE 或 SPE 快得多,而且可以使用温和的中性萃取条件(LLE 或 SPE 可能需要酸性或碱性条件),因此常用于不稳定化合物的萃取。
PPT 还可与其他样品制备方法轻松结合。例如,维生素 D 及其代谢物主要以蛋白结合形式存在于血浆或血清中。在对其进行分析时,通常首先采用 PPT 步骤将分析物从维生素 D 结合蛋白中释放出来,然后再采用额外的 LLE 步骤进一步纯化样品。
PPT 还可用于多肽和有机可溶性蛋白质的纯化。例如,PEG 化蛋白质和小分子蛋白质在 PPT 所用的水溶性有机溶剂(如乙腈、甲醇和异丙醇)中具有一定的溶解度。只要适当优化 PPT 条件,这些分子就能被有效地保留在上清液中,并很容易从沉淀的背景蛋白中分离出来。
Zhang 等人在优化酸性沉淀溶剂和溶剂与血清比例的条件下,使用 PPT 从人血清中提取干扰素-γ 诱导蛋白-10(分子量为 8.6 kDa),实现了高回收率(近 100%)和最低基质效应。结果,他们获得了一种高灵敏度的 LC-MS/MS方法,其 LLOQ 为 31.62 pM,与在缓冲液中分析纯样品的结果相同,比直接消化方法好 100 倍。
PPT 对于提取大分子蛋白质(如单克隆抗体 (mAb))并不有效,因为大分子蛋白质大多会与血清/血浆样品中的内源性蛋白质发生共沉淀。
最近,Liu 等人开发了一种新型的酸辅助 PPT 方法,可有效去除血浆/血清样品中的白蛋白。白蛋白被保留在上清液中并被去除,而样品中的大分子目标蛋白则被沉淀,然后重新悬浮以备进一步处理。他们评估了不同浓度的四种有机溶剂(丙酮、甲醇、乙醇和异丙醇)和两种酸(甲酸和三氯乙酸)作为沉淀溶剂的组合。
他们发现,异丙醇与 1.0% 三氯乙酸的组合可从血浆中去除 95% 的总白蛋白,并对测试的三种治疗蛋白(一种 mAb、一种结构域抗体和一种融合蛋白)达到令人满意的回收率(>60%)。与传统的 PPT 方法相比,这种新方法的提取物更纯净,因此大大提高了检测灵敏度(对于所测试的治疗蛋白,灵敏度提高了 10 倍)。
他们利用这种新方法成功验证了一种 mAb 的 LC-MS/MS 方法,并将其应用于猴子毒理学研究。
液液萃取(Liquid–Liquid Extraction, PPT)
在液相色谱法中,双相系统(通常是水溶液和不相溶的有机溶剂或溶剂混合物)的设置是为了利用分析物在相间的差异分布,通常是在萃取前通过调节 pH 值使分析物处于不带电状态。
通过适当选择受体相的成分和体积,可以选择性地萃取所需的分析物,并在可能的情况下进行浓缩。
LLE 能有效去除生物样本中的蛋白质、盐类和脂类,通常能得到比 PPT 干净得多的提取物。它还易于在 96 孔板形式中实现自动化,操作简单,可进行高通量提取,而且与 SPE 相比成本相对较低。
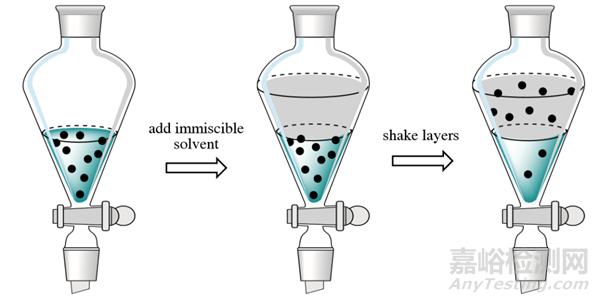
图 2. 液-液萃取示意图
(图片来源:"4.2: Overview of Extraction". Chem.Libretexts.Org, 2024, )
因此,LLE 是一种常用的样品制备方法,通常也是获得清洁样品提取物的首选方法。
为了实现基质效应最小化和分析物回收率最大化的最佳组合,需要仔细评估 LLE 的条件(如有机萃取溶剂、萃取缓冲液、pH 值以及样品和萃取溶剂体积的比例)。有时,即使是萃取时间的长短也会极大地影响该方法的回收率和基质效应。
LLE 可使用多种不溶于水的有机溶剂(如乙酸乙酯、甲基叔丁基醚、正丁基氯、正己烷和甲苯)。用不同的萃取缓冲液和 pH 值组合来筛选所有不同的溶剂既低效又耗时。
一种简单的方法是筛选不同体积百分比的乙酸乙酯和正己烷混合物作为萃取溶剂,以及不同 pH 值(酸性、中性和碱性)的萃取缓冲液。
这种方法可涵盖极性范围广泛的分析物:正己烷对非极性化合物具有良好的萃取效率,乙酸乙酯对中等极性化合物具有良好的萃取效率。
LLE 的一个局限性是其对极性化合物的适用性较差:这些化合物通常更易溶于水,无法被萃取到有机相中并获得良好的回收率。出于同样的原因,LLE 也很少用于肽和蛋白质的萃取。
盐析辅助液液萃取(SALLE)是利用浓盐溶液(如硫酸镁、醋酸铵)在水相混溶的有机溶剂(如乙腈、四氢呋喃)中的盐析效应,将含有目标分析物的有机溶剂“盐析”出来,与水相分离。
与传统的 LLE 方法相比,SALLE 在提取极性化合物方面更为高效。SALLE 还能提供比 PPT 更纯净的提取物,因为高浓度盐和有机溶剂能有效沉淀生物基质中的蛋白质。
SALLE 已被应用于多种化合物的提取。对于传统 LLE 或 SPE 方法难以萃取的极性化合物,SALLE 不失为一种提高灵敏度的有效方法。
固相萃取(SPE)
SPE 是一种基于色谱分离的萃取技术,可通过使用不同的吸附剂提供多种分离机制(如反相/RP、离子对、离子交换、混合模式)。
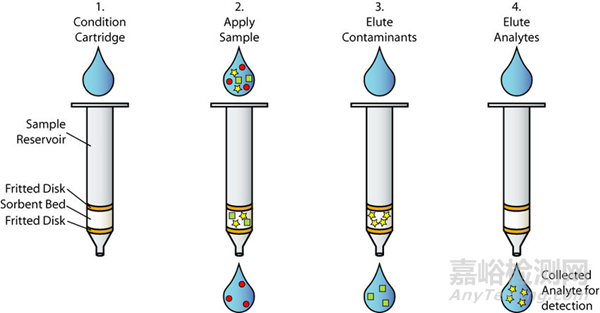
图 3. 固相萃取示意图
(图片来源:"Solid Phase Extraction". Mavink.Com, 2024)
因此,SPE 可对各种类型的分析物(包括非极性和极性化合物、肽和完整蛋白质)进行高效萃取。要获得高灵敏度的检测结果,最好选择对分析物具有选择性的分离吸附剂和机制。
SPE 方法的选择性越高,得到的样品提取物就越干净,灵敏度也就越高。这种方法尤其适用于具有独特物理化学特性的分析物,可通过选择合适的 SPE 相加以利用。
例如,对于可离子化的化合物,使用离子交换分离机制的吸附剂具有高度的选择性,因此可以实现高效的样品纯化并显著提高灵敏度。使用强阳离子交换(SCX)固相萃取技术萃取碱性化合物就证明了这一点。
此外,固相萃取(SPE)还能方便地对样品进行预浓缩或富集,这对于 96 孔板形式的 LLE 或 PPT 方法来说往往很不方便。例如,可将大量样品(如 1 mL 或更多)装入 SPE 板或滤芯,清洗后,分析物可在更小体积(如 100 μL)的溶剂中洗脱和复溶,这将使样品得到显著(10 倍或更多)富集。
这种预浓缩是提高灵敏度的一种非常有用的方法,尤其是在有足够样品量的情况下。
固相萃取也被广泛用于从生物基质中纯化肽和蛋白质。选择合适的 SPE 吸附剂主要取决于分析物的极性和电荷(等电点,pI)。最常用的是反相吸附剂,也有报道称使用离子交换材料。
对于小分子蛋白质和 PEG 化蛋白质,SPE 样品制备可有效去除大部分内源性背景蛋白(如白蛋白和免疫球蛋白),并在提取物中保留完整的蛋白质分析物。对于单克隆抗体(mAbs)等大分子蛋白质,很难通过 SPE 直接从内源性蛋白质中分离出来。
另外,SPE 还可用于提取消化目标蛋白质的代肽。实现更好样品纯化的有效方法是使用与色谱分离正交的 SPE 分离机制。与使用与分析分离机制相同的 SPE 相比,采用与色谱分离机制不同的正交样品制备通常能获得更好的样品纯化效果。
在采用 RP 色谱分离的 LC-MS 方法中,Yuan 等人系统地比较了 SCX SPE、RP SPE 和二维 (2D) SPE(RP SPE 后 SCX SPE)对消化血清样品的提取效果。SCX SPE 与 RP 色谱分离正交,在去除血清胰蛋白酶消化液中的背景肽方面比 RP SPE 更有效。虽然 2D SPE 对样品进行了额外的净化,但与单独使用 SCX SPE 相比效果并不显著。
组氨酸、半胱氨酸和色氨酸等氨基酸具有很强的电子供体基团,可以与 Ni2+、Zn2+ 和 Co2+ 等过渡金属螯合。利用这种螯合作用,基于固定金属亲和力的萃取方法可以选择性地萃取表面暴露有这些氨基酸的肽或蛋白质。
Wilffert 等人应用固定金属亲和层析法(IMAC)提取了血清中的重组人 TNF 相关凋亡诱导配体(rhTRAIL),这是一种 60 kDa 的蛋白质,含有大量表面暴露的组氨酸。rhTRAIL 的组氨酸与 IMAC 树脂上固定的 Ni2+ 离子之间的强相互作用使样品得以有效纯化:95% 的血清蛋白被去除,而 rhTRAIL 被很好地保留下来,提取回收率为 72%。
二维固相萃取(2D SPE)具有额外的净化维度,可进一步纯化感兴趣的多肽。
Wilffert 等人在 IMAC SPE 步骤之前增加了 SCX SPE 步骤,以定量检测血清中的 rhTRAIL。这种 2D SPE 方法可去除 >99.9% 的血清蛋白。虽然 rhTRAIL 的总体回收率从 72% 降到了 49%,但更清洁的提取物使灵敏度提高了 10 倍以上。
在另一个例子中,Yang 等人在分析血清中的治疗用 mAb 时,采用了先 RP SPE 后 SCX SPE 的方法。RP SPE 能有效去除盐类和高度疏水的成分,而 SCX SPE 则能去除碱性与相关肽段差异很大的背景肽段,因此大大降低了背景噪声、离子抑制和干扰,提高了 LC-MS/MS 分析的灵敏度。
免疫亲和提取(IAE)
IAE 利用免疫亲和捕获试剂(如抗体或分析物的受体/配体)从生物样品中选择性地高效捕获感兴趣的分析物(蛋白质、肽或小分子化合物)。
对于蛋白质生物分析而言,由于样品中存在高丰度的内源性蛋白质(或消化后的背景肽),传统的样品制备方法(如 SPE)往往无法提供足够的样品净化,从而无法达到所需的灵敏度。
免疫亲和素具有极佳的选择性,非常适合从复杂的生物基质中提取和富集蛋白质或肽。近年来,基于免疫亲和的样品制备方法在蛋白质的 LC-MS 生物定量分析中引起了极大的兴趣和关注。
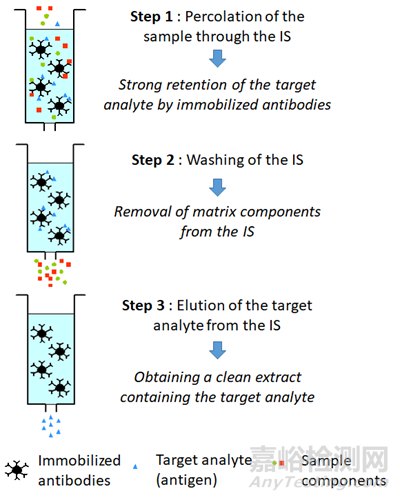
图 4. 免疫亲和提取法示意图
(图片来源:Pichon, V. Immunoaffinity Extraction. In Reference Module in Chemistry, Molecular Sciences and Chemical Engineering; Elsevier, 2016;)
如果有合适的捕获试剂,IAE 无疑是实现超灵敏方法的最有效的样品制备方法,蛋白质分析物的 LLOQ 通常可低至 ng/mL。IAE 的纯化效率取决于检测中使用的捕获试剂的选择性:试剂的选择性越高,目标分析物的富集和纯化效果就越好,检测灵敏度也就越高。
蛋白 A 或蛋白 G 可选择性地与免疫球蛋白 G(IgG)的可结晶区片段(Fc 区)结合,因此可用于含有 IgG Fc 区的抗体的 IAE。然而,由于它们不能区分血浆/血清中的内源性 IgG 与相关分析物,因此只能提供有限的样品纯化和灵敏度提高。
与蛋白 A 或蛋白 G 相比,抗人类 IgG 抗体能大大提高选择性,因为它只与人类 IgG 的 Fc 区域结合,而不与其他物种的 IgG 结合。它可以从动物基质中高效、高选择性地纯化各种人类 mAbs,从而显著提高灵敏度。
这已成为提取动物血浆/血清和组织中人 mAbs 的通用免疫捕获方法,也可用于同时提取多种 mAbs。
为了获得更纯净的样品提取物,IAE 需要选择性更好的捕获试剂。有两种常用的蛋白质和多肽高特异性免疫捕获策略。一种策略是使用抗生物体抗体或目标分析物的受体/配体来实现高选择性纯化和有效富集完整的分析物。这种方法已广泛应用于各种蛋白质分析物,包括蛋白质或肽生物标记物。
另一种常用的方法是抗肽方法,名为 "稳定同位素标准和抗肽抗体捕获"(SISCAPA),由安德森等人首次提出。在这种方法中,含有蛋白质(或大肽)分析物的样品首先被消化成肽,然后使用抗肽抗体特异性地捕获消化样品中分析物的特征肽。
这种方法已应用于多种基质,包括血浆/血清、唾液、细胞裂解液、组织和 DBS。抗肽免疫捕获具有高度的选择性和高效性。通常可以获得富集度大于 100 倍的极其干净的样品提取物;因此,这可以使灵敏度提高约两个数量级。
与之前描述的抗接触分析物方法相比,这种策略消除了抗药物抗体 (ADA)、可溶性靶标或其他抗靶标蛋白抗体的潜在干扰,因为样品在提取前已被消化。
为进一步提高灵敏度,可对目标蛋白及其特征肽进行连续免疫捕获,以生成超净、高富集的样品提取物。
例如,Neubert 等人首次使用基于磁珠的抗神经生长因子(NGF)多克隆抗体从血清样本中提取 NGF。样本提取物经胰蛋白酶消化后,使用针对胰蛋白酶 NGF 特征肽生成的多克隆抗肽抗体进一步在线纯化。
他们利用这种顺序免疫捕获方法实现了高灵敏度测定(LLOQ 7.03 pg/mL),可定量检测血清中的人β-NGF。该方法已成功通过验证,并已用于多项临床研究的大规模样本分析。
IAE 也被用于纯化小分子分析物,但不如用于蛋白质和肽那么普遍。对于生物标记物而言,相关生物途径中可能会产生同分异构体内源化合物,这可能会对分析物的 LC-MS/MS 分析造成干扰,影响检测灵敏度。
IAE 可以有效消除样品中的异构体干扰。在对血清中的 1α,25-二羟维生素 D 进行 LC-MS/MS 分析时,观察到基质成分的严重干扰:多种异构体化合物与分析物发生共洗脱,并且它们具有相同的离子对。传统的样品制备方法无法完全去除或分离这些干扰化合物。
通过使用市售的 1α,25-二羟基维生素 D 提取试剂盒进行 IAE 步骤,成功地去除了所有干扰峰,实现了超灵敏方法,1α,25-二羟基维生素 D3 的 LLOQ 为 3.4 pg/mL,1α,25-二羟基维生素 D2 的 LLOQ 为 3.9 pg/mL。

来源:仪器小知识