您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-27 08:44
软骨无血管、无神经,其内在再生能力有限,因此需要在受伤后进行外部干预。目前的临床策略主要侧重于通过止痛药和消炎药来缓解症状,目前尚无特效治疗方法。
为了解决这一问题,来自北京大学第三医院的张辛与北京化工大学的蔡晴/喻盈捷团队合作提出了一种压电导电支架,由压电软骨脱细胞细胞外基质(dECM)和压电导电改性明胶(Gel-PC)组成。支架的压电性是通过在孔表面改性二苯丙氨酸(FF)组件实现的,而支架的导电性是通过加入聚(3,4-乙烯二氧噻吩)实现的。支架上层积聚的正电荷吸引BMSC,促使其向上层迁移并向软骨分化;同时,下层的负电荷诱导BMSC向成骨分化(方案1),为有效修复骨软骨缺损提供了一个有希望的平台。
相关研究成果以“Biodegradable Piezoelectric-Conductive Integrated Hydrogel Scaffold for Repair of Osteochondral Defects”为题于2024年9月13日发表在《Advanced Materials》上。
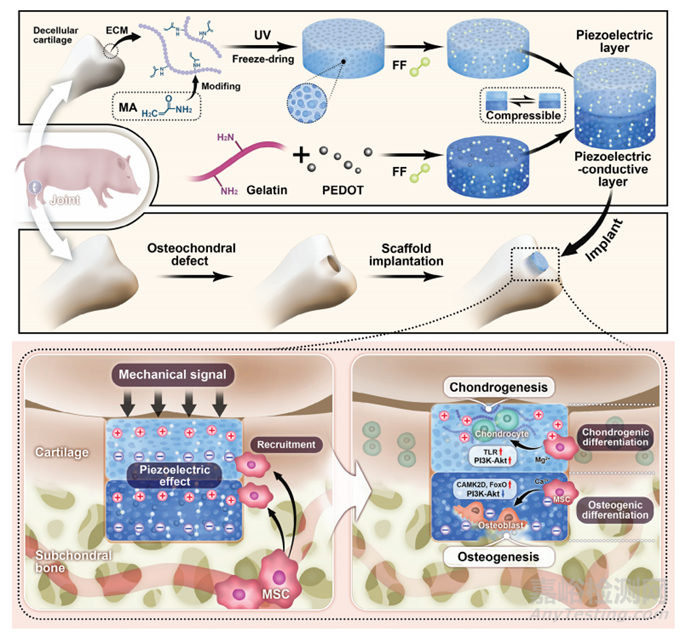
方案1 用于修复和重建骨软骨缺损的可生物降解压电导电支架示意图
1.水凝胶的制备与表征
为了最大限度地发挥上部压电材料的电刺激效果,通过集成压电和导电元件开发了一种可降解的双层水凝胶(图1a)。水凝胶的上部支架来自猪软骨组织的 dECM,用双键改性,并用FF肽功能化。水凝胶支架的下层是通过将导电聚合物PEDOT与Gel-C结合而创建的。上部和下部支架使用人纤维蛋白密封剂套件进行粘合。在循环压缩之前和之后,上层和下层之间没有明显的分离。此外,认识到骨和软骨再生需要支持细胞迁移的支架,采用梯度冷冻技术制造具有互连大孔结构的支架(图1b)。经过多次FF肽浸渍处理,实现了FF肽通过自组装与水凝胶内部的结合,从而制备出双层水凝胶。
为了验证双层支架的电气性能,利用电化学工作站获取支架材料的循环伏安法 (C-V) 曲线和电化学阻抗。将PEDOT添加到凝胶中形成导电明胶 (Gel-P) 和压电导电明胶(GelPC),与未改性凝胶相比,其阻抗更低、离子电导率更高、C-V曲线更大。这表明Gel-P和Gel-PC中的电子传导和存储容量有所改善(图 1c-e)。dECM水凝胶的输出电压和电流分别约为3 mV和0.25 μA,而dECM-P水凝胶的输出电压和电流分别约为20 mV和0.8 μA(图1f)。此外,FF肽修饰的双层水凝胶(DPC)的压电输出在1000次循环中和至少21天内保持稳定(图1g、h)。为了模拟双层支架在体内的实际应用,从上到下模拟了双层支架的压缩。有限元分析结果表明上部支架材料发生了较大的变形,应力主要集中在上下部支架界面处,与压缩试验结果一致(图1i、j)。
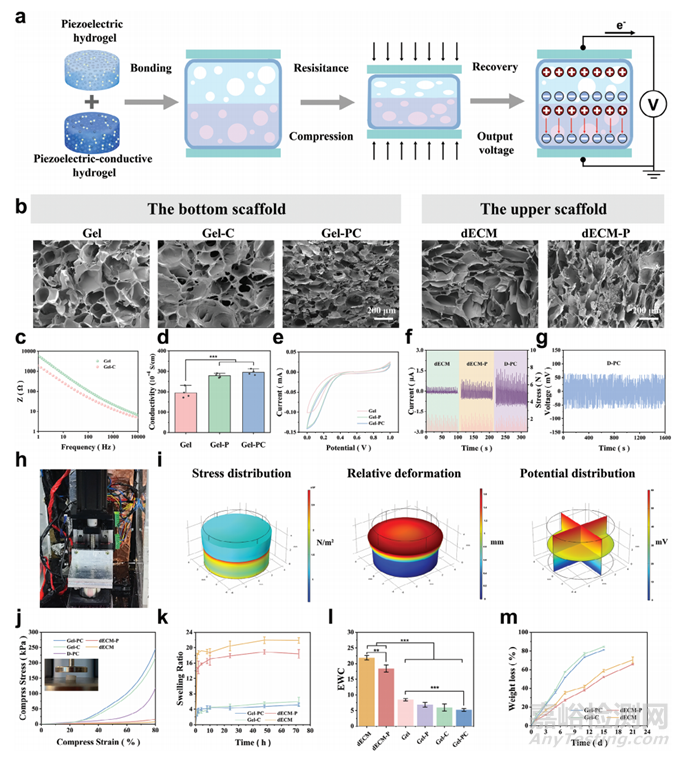
图1 压电导电水凝胶的物理和化学特性
2.压电导电水凝胶的体外生物相容性及促分化作用
图2a概述了体外细胞实验的过程,其中力电因子刺激细胞实现差异化成骨/软骨分化。将支架与细胞共培养7天和14天以评估dECM-P和Gel-PC水凝胶的生物相容性。细胞向支架内部迁移,形成三维(3D)培养环境(图2b)。细胞迁移实验表明压电效应显著促进了细胞迁移(图2c)。此外,在压电刺激下观察到最强烈的钙离子内流荧光(图2d),这种影响归因于压电刺激打开离子通道,从而促进细胞迁移。
为了比较dECM-P和Gel-PC对MSCs分化的影响,进行了单独的软骨形成和成骨实验。通过比较这些组,可以评估力和电在细胞分化中的单独和联合作用。阿尔新蓝染色在dECM、dECM(+)和dECM-P(+)组中逐渐增强,表明酸性粘多糖合成增加,MSCs的软骨形成分化增强(图2e)。对于底层的成骨,碱性磷酸酶(ALP)染色随着力和电刺激的施加而增加。ALP是骨形成的特定标志物,在力电因子刺激下表现出更大的成骨趋势,这与茜素红染色结果一致(图2f)。qPCR量化几个软骨代表基因,包括SRY-Box转录因子 9 (SOX9)、聚集蛋白聚糖(ACAN)和COL-II,以及成骨代表基因,包括骨钙素(OCN)、ALP和I型胶原蛋白。7天和14天,dECM-P(+)组软骨相关基因表达明显高于其他组,而Gel-PC(+)组骨相关基因表达最高(图2g、h)。结果表明,压电刺激显著促进MSCs分化。BMSCs的成骨和软骨形成也与力电因子激活的离子通道有关。
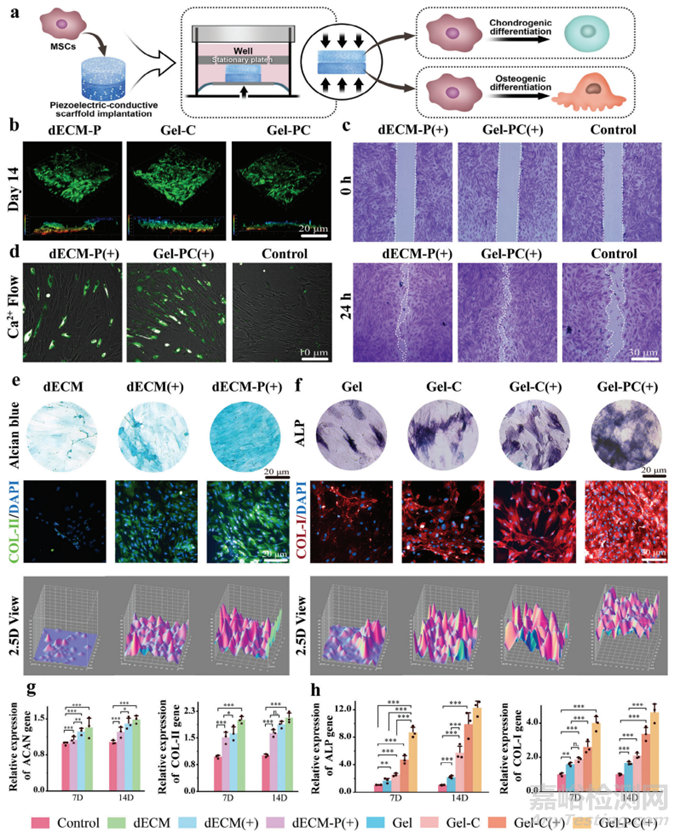
图2 评估支架的细胞相容性、细胞迁移和细胞分化
3.转录组测序揭示力电相互作用在细胞分化中的作用
为了研究力电刺激因子在细胞分化中的作用,作者对上层和下层支架进行了RNA测序。这项分析旨在确定力电通路中影响MSC成骨和软骨分化的关键靶点和分支点。为此,比较了对照组和压电刺激组中BMSC的整体基因表达谱。通路富集结果表明,Toll样受体信号通路通过Mg2+调节MSCs软骨形成,这与体外结果一致。FoxO信号通路是软骨分化的另一个关键组成部分。这些通路为可能的信号传输提供了多种选择(图3b)。SOX9、COL-II A1和ACAN的RNA测序结果为各组之间的分化提供了进一步的证据(图3c)。基因集富集分析(GSEA)结果如图3d所示,表明dECM-P(+)组与细胞因子-细胞因子受体相互作用和细胞粘附分子呈正相关。
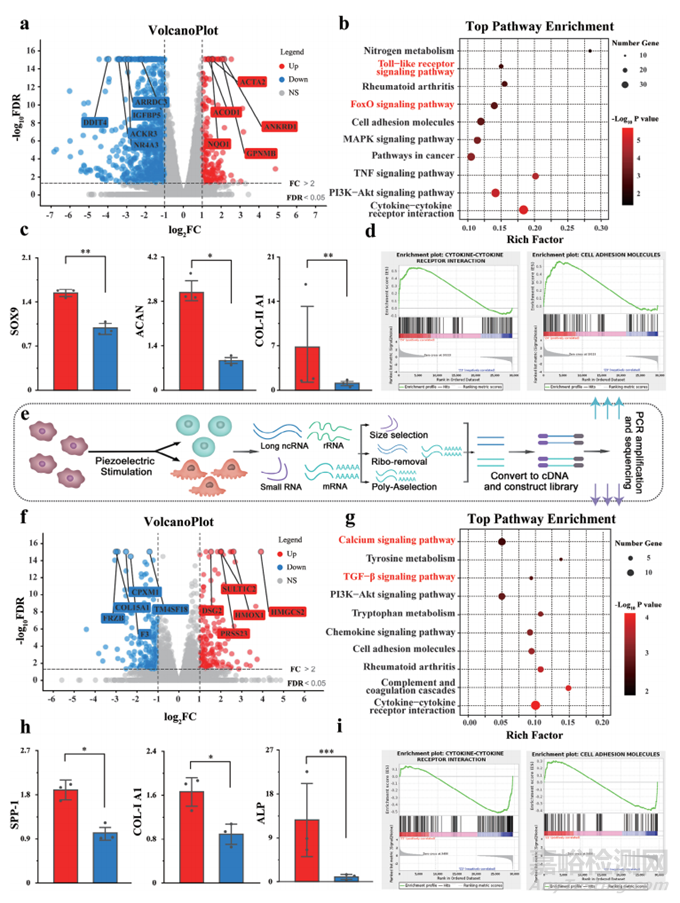
图3 上层(软骨形成分化)和下层(成骨分化)的RNA测序
4.全层骨软骨再生的体内效果评估
基于以上实验结果,作者进行了体内实验以验证压电导电水凝胶在全层骨软骨再生的效果(图4a)。为了确认该材料在体内保留了其压电特性,我们模拟了兔膝关节,并使用神经电极测量了膝关节运动期间的电输出。结果表明,关节运动引起的变形产生稳定的电压输出,异常波动最小,与实验设计一致(图4b)。为了验证设计的压电导电支架在生物体中修复的实际效果,模拟了骨软骨缺损。帕尔马猪的生理结构与人类相似,因此为临床应用提供了坚实的基础,被用作实验对象。术后6个月收集样本,并使用成像、病理学和纳米力学评估修复效果。膝关节目视观察显示,D-PC组软骨覆盖完整,缺损中心完全修复并与正常软骨融合良好。在D-P组中,缺损中心的软骨得到修复但未完全填充。D-C组和D-N组分别显示小凹陷和大凹陷,新软骨形成仍不足以恢复正常功能(图4c)。国际软骨修复协会(ICRS)评分显示两组之间存在统计学上的显著差异(图4d)。磁共振成像(MRI)证实了这些发现。D-N组显示代表软骨层的突出显示白线明显断裂,表明软骨修复不完全。D-C组和D-P组出现一些模糊,表明修复效果不佳。然而,D-PC组显示连贯的软骨层,表明修复效果优异(图4c)。采用微型计算机断层扫描(micro-CT)评估软骨下骨的重建修复情况。各组之间的骨小梁厚度存在显著差异,具有很强的统计学意义(图4e)。3D重建图像清楚地说明了这一点,D-PC组看起来更饱满,而D-N组显示出明显的空洞(图4c)。
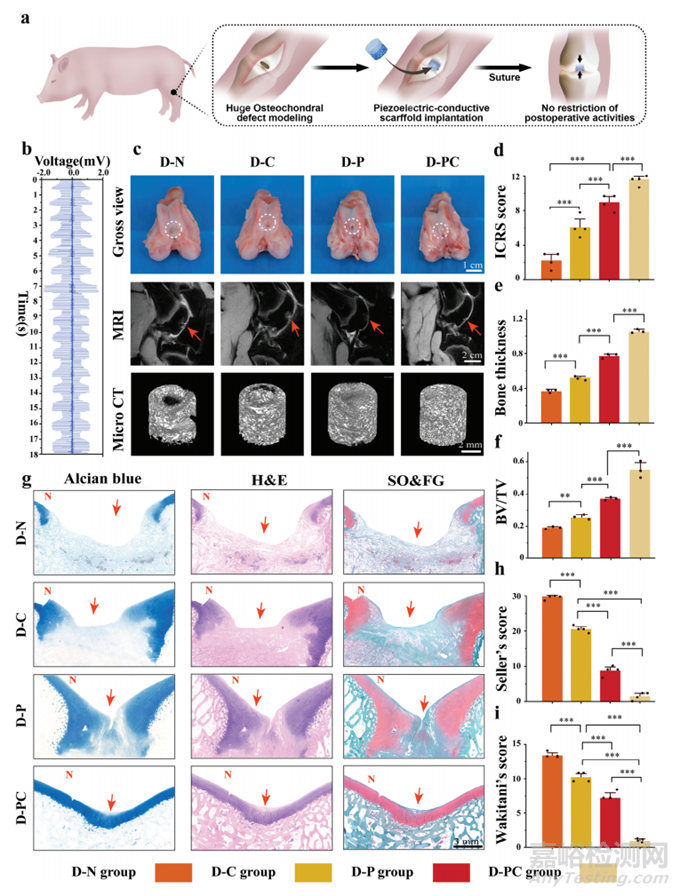
图4支架在帕尔马猪膝关节模型中的支架电输出及骨软骨缺损修复效果体内测试
通过病理切片及染色(H&E、阿新蓝、番红O/固绿)比较各组修复效果。图4g中软骨层从上至下排列为D-N、D-C、D-P、D-PC组,修复效果由纤维组织填充到新生软骨形成逐渐改善。同样,软骨下骨的修复也由空洞进展到小梁有序修复,证明了压电导电支架在大型动物中的有效修复作用。Seller评分和Wakitani评分进一步证实了修复效果的差异,D-PC组效果最好,其次是D-P组,再次是D-C组,D-N组修复效果最差(图4h、i)。这些在体实验凸显了压电导电支架优越的修复能力。
5.纳米压痕测试和重建骨软骨ECM的各向异性特征
6个月后取样,进行纳米压痕试验,分析修复软骨的表面平整度和力学性能。。D-PC组结果最佳,表面圆润光滑,峰间间隙很小,与正常软骨非常相似(图5a)。随后,将正常软骨的弹性模量(Er)和硬度值与四个实验组进行了比较。D-N 组和 D-C组的力学性能明显较差,仅为正常软骨的1-5%。D-P组的Er和硬度值显著高于D-N组和DC组。然而,这些值显著低于D-PC组(图5b、c)。
根据天然软骨结构,选择了两个单独的感兴趣区域(ROI)进行分析,图5d总结了有关胶原纤维取向的定量结果,在底部区域观察到了类似的趋势(图5e)。为了更好地说明这些趋势,作者将结果绘制在极坐标图中,证实D-PC组表现出最有利的胶原纤维排列和整体修复结果(图5f)。这与总体实验观察和细胞预期相一致,强调了压电导电支架在生物医学修复应用中的潜力。
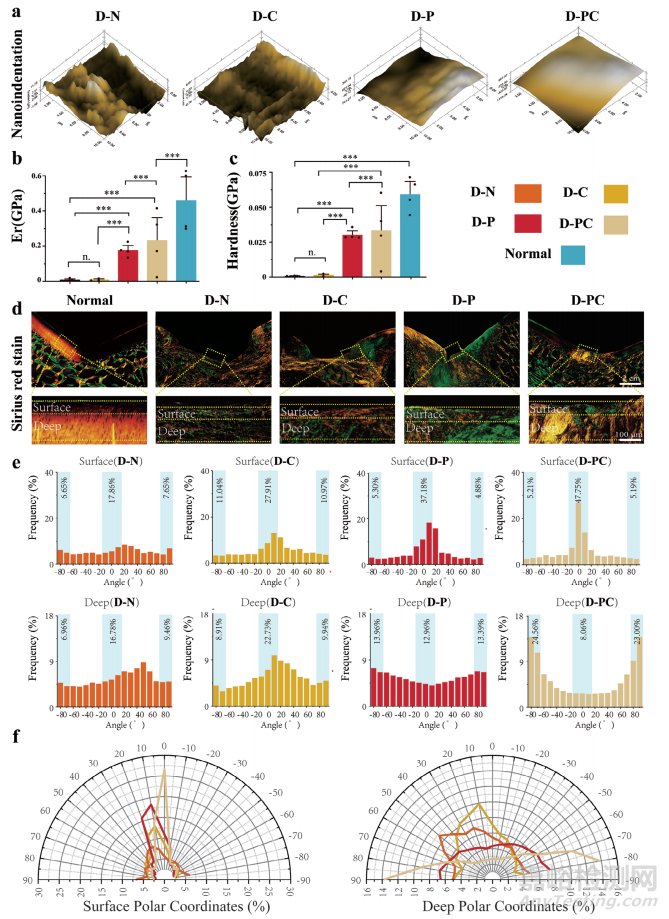
图5 术后6个月不同组修复组织胶原纤维排列的纳米压痕测试和定量分析
为了模拟人体正常运动过程中的电生理现象,本文设计了一种压电导电水凝胶支架。体外实验表明,该支架具有良好的生物相容性,能显著促进细胞迁移和成软骨/成骨分化。通过RNA测序技术识别了力电刺激对上下层关键靶分子的影响,为后续研究奠定了基础。大型动物体内植入实验表明,该支架通过下层导电层的设计满足了骨区高电输出的需求,在表面积累正电荷,吸引干细胞迁移,增强软骨修复效果。值得注意的是,在患有骨软骨缺损的帕尔马猪模型中,该支架获得了良好的修复效果,展示了其临床治疗潜力。
文章来源:https://doi.org/10.1002/adma.202409400

来源:Internet


