您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-05 21:06
在过去的三十年里,癌症患者的治疗格局发生了翻天覆地的变化。最初,化疗具有显著的临床益处,然而,化疗药物的使用涉及到非特异性药物的潜在益处和全身毒性之间的不断权衡。单抗和靶向治疗的出现,如利妥昔单抗和曲妥珠单抗,彻底改变了临床肿瘤学的治疗手段。最近,免疫检查点抑制剂(ICIS)和双特异性抗体被批准用于癌症患者的治疗。
最初由Ehrlich描述的抗体-药物结合物(ADC)是另一种很有前途的治疗方案,它将有毒药物直接输送到肿瘤细胞中,通过定向抗体选择性地与肿瘤细胞结合,提供高效而安全的效果,为靶抗原上的特定表位提供特殊的亲和力和特异性。ADC的概念最初是在20世纪70年代提出的,但直到20世纪90年代才开发出第一批ADC并在临床试验中进行了测试,ADC这种治疗方法可以更精确地靶向癌细胞,目前有几个ADC已获批准并用于临床实践。
1.ADC结构
ADC的成分是人源化单抗,与肿瘤特异性或相关抗原结合,并通过分子可切割或不可切割连接体结合具有抗肿瘤活性的细胞毒性药物。
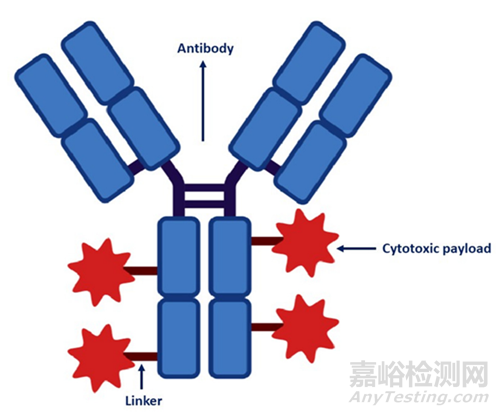
图1 ADC结构示意图
T靶抗原选择与抗体
ADC定位肿瘤细胞的导向信号是肿瘤细胞表面表达的靶抗原。靶抗原必须只在肿瘤细胞中表达或主要在肿瘤细胞中表达,在正常组织中表达极少或可忽略,以将非靶标损伤降至最低。仅在肿瘤细胞表面表达的抗原是ADC的极好靶点。随着许多特定的ADC已经获得批准,另一些正在开发中,血液系统恶性肿瘤表达的谱系特异性抗原已被彻底调查为理想的候选。然而,这一概念不适用于实体瘤,实体瘤中表达的抗原主要是“肿瘤相关的”而不是“肿瘤特异性的”,这意味着在肿瘤细胞和正常细胞上都有表达。
该抗体由两个抗原结合片段(Fabs)和一个恒定片段(Fc)组成,抗原识别由Fabs介导,抗体与效应性免疫细胞的相互作用由Fc介导。整合的抗体应该对肿瘤的靶抗原具有高度的特异性,一个理想的抗体分子应该与目标抗原具有高的结合亲和力,以及有效的内化和最小的免疫原性,并且应具有较长的血浆半衰期。免疫球蛋白是血清中免疫球蛋白的主要成分,因此目前用于ADC药物的抗体主要是免疫球蛋白抗体,包括四种亚型,即IgG1、IgG2、IgG3和IgG4,IgG1亚型是最常用的抗体疗法。抗体介导的免疫效应功能包括激活补体复合体、激活免疫细胞、诱导抗体依赖性细胞毒(ADCC)和补体依赖性细胞毒(CDC),以及激活抗体依赖性细胞介导性吞噬(ADCP)。
细胞毒性的有效载荷
细胞毒性有效载荷是ADC的主要效应成分。目前,ADC的主要细胞毒性有效载荷包括有效的微管蛋白抑制剂(auristatin类似物和maytansine类似物)、DNA损伤化合物(duocarmazine,calicheamicins,和pyrrolobenzodiazepines)、RNA聚合酶II抑制剂(amanitin)和拓扑异构酶I抑制剂(deruxtecan,govitecan)。研究表明除了其效力之外,有效载荷的分子和物理化学特性对ADC的有效性也是及其重要的。
连接体
连接子将抗体连接到细胞毒性有效载荷,并有助于ADC的稳定。这些连接体可以是不可切割的,需要更多的处理才能释放有效载荷;可以是可切割的,此时它们与肿瘤特异性因素有关,如溶酶体酶或pH变化。研究表明,可切割接头具有更有效地释放细胞毒有效载荷的优势。然而,不可切割的连接子可以更具特异性地释放其化疗有效载荷,但抗体需要在可能影响有效载荷的溶酶体中完全降解。不可切割接头与较高的血浆稳定性和相对较长的半衰期有关。ADC可以通过一个重要的指标,即药物抗体比率(DAR)进行分类。DAR代表附着在每个抗体上的细胞毒部分的数量,DAR高的ADC可能更有效,但其具有更快的药物清除速度,并有可能增加毒性,然而DAR较低的ADC可能活性较低,但治疗指数较高。
2. 特定ADCs在实体T肿瘤中的作用机制
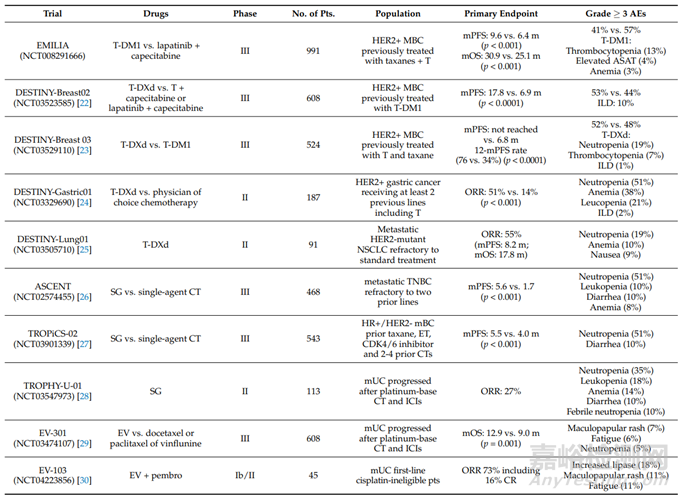
表1 T-DM1、T-DXd、SG和EV被FDA批准的关键试验
Trastuzumab Emtansine(曲妥珠单抗,T-DM1)
T-DM1是第一个根据EMILIA试验结果批准用于转移性乳腺癌(MBC)的ADC。T-DM1通过多种方法发挥作用,包括选择性地将DM1输送到HER2阳性的肿瘤细胞,曲妥珠单抗介导的HER2信号抑制,HER2胞外区脱落的预防和ADCC的诱导。
首先,T-DM1选择性地与HER-2受体阳性细胞的IV亚区结合。结合后,ADC-受体复合体通过内吞作用内化到内吞体内。内吞囊泡要么发育加入溶酶体,要么被回收以ADC-受体复合体返回到质膜。T-DM1的抗体成分经历溶酶体分解,释放赖氨酸-MCC-DM1。MCC-DM1从溶酶体释放后,有效地附着在微管蛋白上,阻止微管聚合,导致细胞周期停滞。
研究表明,T-DM1保留了曲妥珠单抗的作用机制,包括抑制HER2胞外结构域脱落,阻断HER2信号通路,刺激先天和获得性抗肿瘤免疫。其工作原理是减少下游磷脂酰肌醇3-激酶(PI3K)-AKT-哺乳动物雷帕霉素靶标(MTOR)和RAS-丝裂原活化蛋白激酶(MAPK)-信号通路的配体无关激活。曲妥珠单抗的Fc结构域被自然杀伤细胞上的同源Fc受体识别,导致ADCC和由曲妥珠单抗标记的HER2阳性肿瘤细胞的破坏或吞噬。曲妥珠单抗与其他一些不太确定的作用模式有关,包括DNA修复抑制、细胞周期蛋白依赖性激酶抑制因子p27Kip1的增加和血管生成的抑制。
Trastuzumab Deruxtecan(德曲妥珠单抗,T-DXd)
T-DXd是一种新一代的ADC,由人源化的抗HER2抗体通过四肽可切割连接子连接到强效拓扑异构酶I抑制剂(DXd)上,已被批准用于转移性乳腺癌(MBC)患者。T-DXd可有效地靶向HER2低的肿瘤,以及其强大的细胞毒性有效载荷能够靶向邻近细胞。T-Dxd不仅在二线环境中取代了标准化疗,并导致已经接受T-DM1治疗的患者的无进展生存期(PFS)和总生存期(OS)的改善,而且在低HER2肿瘤患者中也表现出了活性。此外,T-DXd还被批准用于治疗转移性HER2阳性胃或胃食道交界部腺癌患者,这些患者之前接受了基于曲妥珠单抗的治疗方案,以及根据DISTISTY-GUG01和DISTISTY-LUNG01第二阶段试验的结果治疗过HER2突变的转移性非小细胞肺癌(NSCLC)。
Sacituzumab Govitecan(戈沙妥珠单抗,SG)
作为伊立替康的活性代谢物,SN-38在化学上与人源化的单抗RS7 IgG1 Trop-2抗体相连,组成了SG。这是第一个根据IMMU-132-01和ASCENT试验结果批准用于三阴性乳腺癌(TNBC)的ADC,还被批准用于免疫检查点抑制剂(ICIs)进展后转移性尿路上皮癌(mUC)的治疗,以及最近在内分泌治疗和至少两个化疗路线的进展后用于HR+/HER2-MBC的治疗。SG与癌细胞上的Trop-2结合后被内化,使SN-38能够在细胞内传递。
Enfortumab Vedotin(恩诺单抗,EV)
EV是一种由人IgG1抗脊髓灰质炎病毒受体-4抗体与甲基澳瑞他汀E(MMAE)偶联而成的ADC,被批准为ICIs进展后mUC患者的单一疗法。脊髓灰质炎病毒受体-4是一种最佳的治疗靶点,因其在多种恶性肿瘤中过度表达,但在尿路上皮癌和乳腺癌中尤其常见。当EV附着到脊髓灰质炎病毒受体-4上并内化时,微管破坏物质MMAE在细胞内释放,导致肿瘤细胞发生凋亡。EV抗肿瘤的作用还可以通过其他机制来调节,例如抑制直接结合、ADCC和补体依赖性细胞毒性的信号转导。
3. 抗ADC机制的研究进展
由于ADC的结构复杂,其作用机制由多个步骤组成,从抗原表达和识别开始,通过内化和降解到细胞毒药物释放和细胞凋亡调节,可在任何水平发生耐药。
表2 抗药性的机制和抗药性的克服
图2 抗病机制与抗药性的克服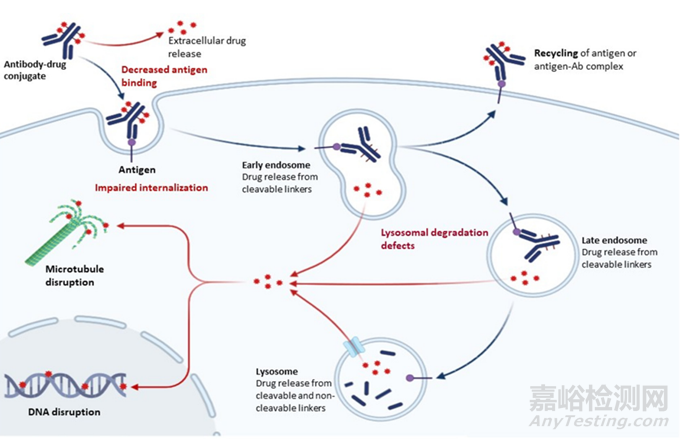
抗原相关耐药性
由于ADC通过靶向特定的抗原发挥作用,其耐药机制之一与单抗识别这些抗原有关,肿瘤抗原表达的异质性也可能影响ADC的疗效。
一种在ADC中尚未被临床证实的潜在耐药机制是抗原外结构域截短形式的积累。事实上,这一理论之前在曲妥珠单抗中得到了证实,表达全长受体的肿瘤对曲妥珠单抗表现出高反应,而截断的P95 HER2表现出耐药性。对ADC的敏感性也可以通过配体的存在来调节,如Heregulin,也称为神经调节蛋白或NRG,一种属于表皮生长因子(EGF)家族的蛋白质,通过促进HER2与HER3和HER4的异源二聚化来损害T-DM1的功效。
有效载荷抗性
除了抗原抗性外,肿瘤细胞还可能产生有效载荷抗性。有效载荷通过半胱氨酸(Cys)或赖氨酸(Lys)残基与抗体结合,关于有效载荷,DAR在ADC效能中起主要作用。然而,没有明确的数字说明最佳DAR。除有效载荷类型之外,共轭位置和平均DAR的位置也很重要。其他因素也可能影响这些值,如偶联位点和药物负载。
内化和流动路径
一旦ADC与靶抗原结合,就可以通过内吞作用内化到癌细胞中。胞吞作用有多种途径,包括ADC最常用的胞丝介导的胞吞作用(CME)、小泡介导的胞吞作用以及不依赖于胞丝-小泡蛋白的胞吞作用。每一种内吞途径都受一组不同的蛋白质调控,如接头蛋白(AP2)、动力蛋白、肌蛋白酶和磷脂酰肌醇二磷酸(PIP2),每一种蛋白在各种细胞过程中都起着特定的作用。
溶酶体功能
在与靶分子结合并通过受体介导的内吞作用内化后,ADC到达溶酶体,在那里化学或酶的裂解诱导细胞毒性物质的释放。ADC耐药的另一种机制与细胞毒性药物从溶酶体腔内转运到细胞质有关。这种机制在不可切割连接体中特别有趣,因为其可能需要一种特殊的转运体才能被运送到细胞质中。
药物泵
ATP-结合转运蛋白(ABC)的过表达在化疗耐药中起主要作用,许多癌症类型的转运蛋白表达与化疗反应降低之间存在相关性。这些外排泵增强了药物从细胞中挤出,并可能导致多药耐药(MDR)表型肿瘤的出现。
细胞周期
研究发现,活跃周期的白血病细胞比静息状态的白血病细胞对化疗更敏感。因此,细胞周期影响肿瘤反应。另一种被提出的抵抗T-DM1的机制与细胞周期蛋白B的水平有关,周期蛋白B是一种参与G2-M转换的细胞周期蛋白。Sabbaghi等人设计了一个T-DM1耐药的实验,比较了亲本细胞和耐药细胞的细胞和分子效应。两组有相似的HER2表达、结合和细胞内摄取。然而,研究人员检测到周期蛋白B1在敏感细胞中积累,而不是在耐药细胞中积累。此外,细胞周期蛋白B1水平的沉默导致耐药细胞的部分增敏。这证明细胞周期蛋白B1水平表明T-DM1在细胞凋亡中的有效性。
信号通路激活
信号通路的激活可能是肿瘤细胞对ADC产生耐药的机制之一。可被激活的信号通路之一是PI3K/AKT/mTOR通路,参与细胞的生存、生长和代谢。该通路激活可能导致对ADC的敏感性降低,细胞毒性有效载荷的有效性降低,并延长细胞存活时间。此外,Wnt/β-Catenin通路的激活也可以促进对ADC的抵抗。Wu等人描述了WNT3在曲妥珠单抗耐药中的作用,WNT3的过表达导致这些细胞中β-连环蛋白的表达增加,生长速度和侵袭力增加,以及曲妥珠单抗耐药性增加。这些仍是ADC的潜在耐药机制,但尚未得到证实。
细胞凋亡调控失调
最后,细胞凋亡调节的任何变化都可以改变对ADC的敏感性。大多数数据来自血液系统恶性肿瘤,BCL-2和BCL-XL的过度表达与吉珠单抗、奥佐格米星或布妥昔单抗维多丁相关。
总结
尽管ADC技术取得了重大进步,但仍然面临重大挑战。如前所述,对ADC的耐药性可通过多种机制产生,其中一些机制尚不完全清楚。因此,无论是通过新的ADC设计还是通过联合治疗,克服ADC耐药性的策略的开发都是一个复杂而持续的研究领域。
一个问题是肿瘤的异质性和ADC对低抗原表达的肿瘤细胞的低效。Golfier等人研究了雷星-阿奈妥单抗的疗效,雷星-阿奈妥单抗是一种靶向蛋白间皮素的ADC,在治疗具有不同靶向表达的肿瘤方面的效果。研究发现,雷星-阿奈妥单抗在体外和体内都显示出强大的抗肿瘤活性,通过旁观者效应选择性地靶向和杀死表达间硫蛋白的肿瘤细胞,旁观者效应涉及将药物转移到不表达目标蛋白的邻近细胞。
Li等人进行的另一项研究调查了有效载荷释放量对ADC效力的影响。随着有效载荷释放率的提高,人们注意到了更大的效力和更强的旁观者效应,这表明了一种可能有助于绕过耐药并提高ADC疗效的策略。这种所谓的旁观者效应不仅取决于细胞毒连接物中的电荷,还取决于细胞毒有效载荷的作用机制和邻近细胞的接近程度,使其成为一个相当复杂的现象。要充分优化这种方法,还需要进一步的研究。旁观者效应是已报道的利用T-DXd克服对T-DM1耐药性的机制之一。
另一个有希望的低抗原表达的解决方案是使用新的双特异性或双抗原单抗。这一点已经在HER2上得到了证明。一种新设计的双降压ADC显示出独特的特征,并显示出对T-DM1耐药和低HER2低肿瘤的益处,这种优势是通过瞄准HER2的两个不同表位,从而诱导HER2受体簇,加强内化,并将内部贩运从循环转向降解来确保的。
此外,最近公布了研究泽尼达妥单抗(ZW49)的I期试验的初步结果,ZW49是一种针对实体肿瘤中两个不重叠的HER2表位的双特异性抗体。这是首次进行人体试验,并发现ZW49的安全性可控,应答率约为31%,疾病控制率约为70%。这些数字令人鼓舞,最终可能推动进一步的临床发展。
最后,克服耐药性的另一种方法是联合治疗。将ICIs添加到ADC可能上调CD8+效应T细胞到肿瘤部位并改善应答,这一点在不同的试验中进行了调查。目前正在进行几个不同组合的Ib期试验。事实上,联合治疗不仅限于免疫治疗,因为TKI+TDM1或T-DXd的联合治疗也在几个I、II和III期试验中进行可能的协同效应评估。
另一种不同的组合策略依赖于靶向Hereglin或NRG1,这是一种激活HER3受体的配体,已知参与了抗HER2治疗的耐药性的形成。研究了曲妥珠单抗、T-DM1和派妥珠单抗联合治疗HER2阳性的疗效。研究人员发现,联合治疗抑制了NRG1/HER3信号通路,最终导致更多的肿瘤抑制和延长的肿瘤消退。Schwarz等人进一步讨论发现耐药细胞系HER3和NRG1表达增加。用PAN-HER治疗诱导ERBB受体下调,并最终导致T-DM1耐药细胞系的肿瘤退化。此外,在表达NRG1的细胞中使用HER3中和抗体,这些细胞对T-DM1具有抵抗力,使它们重新敏感。
目前,ADC是一类重要的癌症治疗药物,目前有几种FDA批准的ADC可用于各种癌症的治疗。尽管癌症治疗有了很大的进步,但先天和后天的耐药性仍然是成功治疗的主要障碍。
文献来源:Mechanisms of Resistance to Antibody-Drug Conjugates

来源:Internet


