您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-10-06 12:16
目前,常用的骨修复可降解生物材料大致有3类: 金属及其合金、生物陶瓷和聚合物。
其中,金属材料具有良好的生物相容性和可降解性,但其耐腐蚀性较差,降解速率过快。生物陶瓷具有良好的生物活性和骨诱导性,但其脆性和抗疲劳性差。聚合物包括天然高分子聚合物和合成高分子聚合物,具有良好的生物相容性和韧性,但其生物惰性不利于细胞的附着。
上述3类材料的不良属性极大地限制了其临床应用,具体体现在两方面: 1) 植入物随在体内时间的延长而逐步降解,导致其力学强度降低,使得不足以提供组织修复所需的力学支撑;2) 形成的新生骨强度不能弥补植入物因降解而引起的强度损失。
近年来,通过表面功能涂层修饰、微纳米结构或多孔结构优化、功能元素/小分子掺杂和共混复合等方式,以调控生物材料的降解速率、改善其生物活性和成骨能力的相关研究,引起了广泛关注。
表1 可降解生物材料的降解机制及其调控方式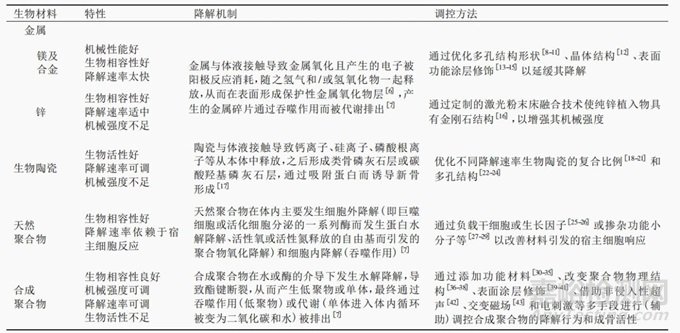
借此期待能设计开发出一种在骨重塑初期能够保持足够的力学强度,之后随新生骨力学强度的增加而逐渐降解的可降解骨科植入材料,如图1。

图1 骨-植入物界面的强度和降解百分比
可降解金属材料
金属材料具有优良的综合力学性能和较好的加工性能,在牙科、整形外科等领域得到了广泛的应用,通常作为受力器件植入体内,如人工关节、人工椎体、骨折内固定钢板、螺钉、骨钉、骨针、牙种植体等。
目前,可降解的医用金属材料主要有镁及其合金、锌、铁等,在生理环境中这些金属材料通过一系列阳极和阴极反应发生降解,如图2(a),即金属与体液接触导致金属氧化且产生的电子被阳极反应消耗,随之氢气和/或氢氧化物一起释放,从而在表面形成保护性金属氧化物层,产生的金属碎片通过吞噬作用而被代谢排出,如图2(b)。
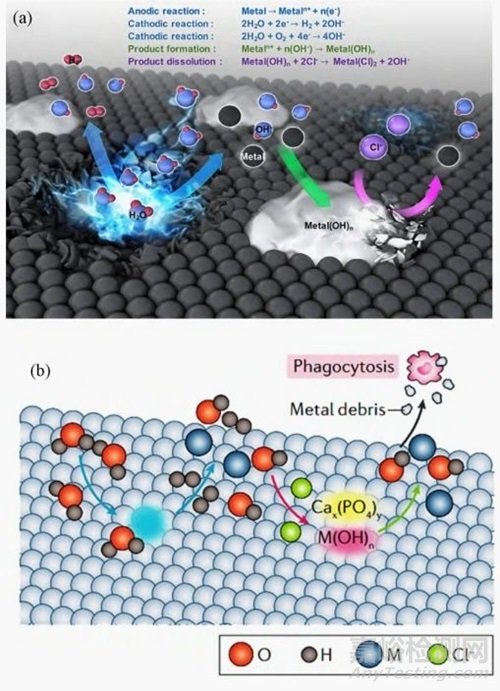
图2 金属在体内的降解机理。(a) 金属在体内的降解示意; (b) 金属碎片被吞噬示意
随后,体液中的钙离子和磷酸根离子形成磷酸钙或锌离子和磷酸氢根离子形成磷酸锌盐沉积在金属氧化物层上,从而使细胞粘附以促进骨形成。对于可降解金属镁、锌和铁,其在体内的化学反应式分别如式(1)-(5) 、式(6)-(10)和式(11)-(16)所示。
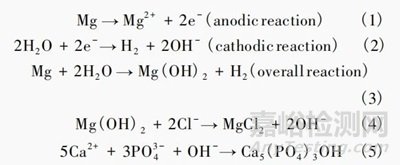


对于镁金属,互连多孔结构的形状影响其支架的降解行为。对于镁合金,体液中高浓度的氯离子会削弱氢氧化镁保护层并加速降解过程。研究者们通过对镁合金的晶粒尺寸进行优化或表面进行功能涂层修饰以延缓其降解。
对于纯锌而言,用于骨缺损修复时需采用新型制造技术赋予其特定结构,从而增强力学支撑强度。
与镁和锌支架相比,铁支架具有类似于不锈钢的优异机械强度,但其降解速度慢、降解产物不溶、过量会导致全身性骨丢失而引发一系列骨病等问题阻碍了其临床应用。
可降解生物陶瓷材料
生物陶瓷材料有许多优势,如良好的生物活性以及与人体骨组织在化学组成方面相近等,其不仅能有效引导骨组织再生,而且可提供多孔的表面形貌,以促进新生骨的长入,在骨缺损修复领域已获得广泛的关注和临床应用。目前常用的生物陶瓷材料大致分为磷酸钙和生物活性玻璃两类。
1、磷酸钙
羟基磷灰石(HA)和β-磷酸三钙(β-TCP)是临床上广泛使用的磷酸钙。
HA通过释放Ca2+和PO43-在植入物表面形成可吸附成骨蛋白的类骨磷灰石层,已被证明具有良好的骨诱导和骨结合能力,可有效地支持成骨细胞的黏附、增殖及分化。但作为可降解生物材料,HA存在降解速度缓慢,本身脆性较大,断裂韧性差等问题。
与HA相比,β-TCP具有更好的骨诱导性和可吸收性,降解时释放的钙离子和磷酸盐离子有利于新骨形成。但在修复大面积骨缺损时,β-TCP的降解速度过快使得缺失部位不能充分的被新骨填充。
学者们将HA和β-TCP相结合,形成双相磷酸钙(BCP) ,针对不同尺寸缺损的修复要求,通过调整HA和β-TCP的复合比例,以调控材料的降解速率和新生骨形成速率。
2、生物活性玻璃
生物活性玻璃通常由含钙的硅酸盐组成,其中硅酸钙(CaSiO3,CS) 最早被用于体内外生物活性的研究。与磷酸钙相比,硅酸钙不仅具有良好的生物相容性和生物降解性,而且逐渐释放的硅离子和钙离子通过激活与骨矿化、骨重塑和血管生成有关的信号通路加快了骨再生速度。
图3显示了生物活性玻璃与骨之间结合的界面反应,即生物活性玻璃在体液环境中依次形成SiOH、Si-O-Si、无定形Ca+PO4+CO3的吸附和碳酸羟基磷灰石(HCA)的结晶,随后生物分子被吸附在HCA层,从而启动了巨噬细胞作用、干细胞附着及分化,直至骨的分化和生长。
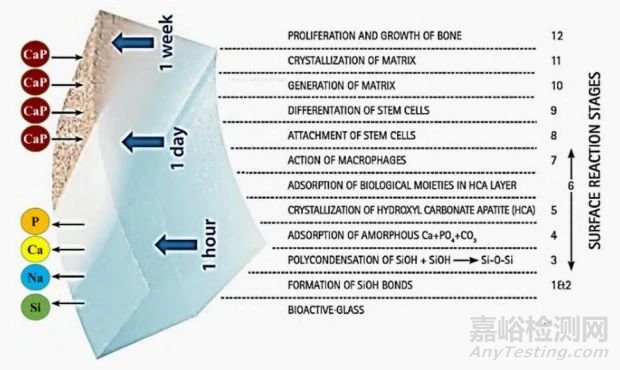
图3 生物活性玻璃与骨之间结合的界面反应
通常情况下,采用引入多孔结构、掺杂磷、硼或聚合物以赋予生物活性玻璃在骨缺损修复时所需的孔隙、降解特性和力学强度。此外,通过在多孔结构中负载生物分子或药物,使得生物活性玻璃可应用于病理条件下的骨缺损修复。
可降解天然聚合物材料
可降解天然聚合物主要有蛋白质(例如脱矿骨基质和丝素蛋白) 和多糖(包括壳聚糖、海藻酸盐和透明质酸等) ,在体内主要发生细胞外降解(即巨噬细胞或活化细胞分泌的一系列酶而发生蛋白水解降解、活性氧或活性氮释放的自由基而引发的聚合物氧化降解) 和细胞内降解(吞噬作用) 如图1所示。
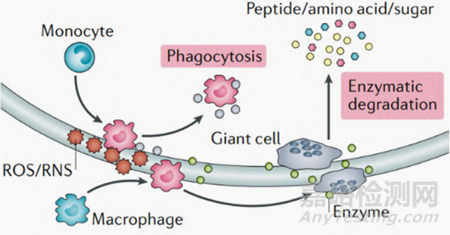
图1 天然聚合物体内降解示意
因此,材料植入后引发的细胞响应将是影响天然聚合物降解行为的主要因素之一。目前,通过表面功能涂层修饰或功能元素/小分子掺杂的天然聚合物的研究更多地关注了抗炎型巨噬细胞、成骨相关细胞的表达,很少关注聚合物降解酶、活性氧/活性氮与聚合物降解速率的关系,这需要后续系统地研究以建立天然聚合物引发的细胞响应与其降解速率关系,从而更好地指导天然聚合物降解行为的调控。
1、脱矿骨基质
脱矿骨基质(DBM)是同种异体移植骨,其中无机矿物质已被去除,留下有机“胶原”基质。1965年,Uristes首次发现,去除骨矿物质会暴露更多具有生物活性的骨形态发生蛋白。这些生长因子调节祖细胞分化为骨祖细胞,骨祖细胞负责骨和软骨的形成。由于脱矿过程,DBM比非脱矿骨移植物更具生物活性。相反,机械性能显著降低。
DBM在结构、功能和力学强度方面与天然骨相近,通过负载干细胞、生长因子等可诱导新骨形成,是理想的骨诱导生物材料。
2、丝素蛋白
丝素蛋白(SF) 是一种由家蚕和蜘蛛产生的纤维蛋白。作为天然衍生的生物材料具有易加工、良好生物相容性、降解产物无毒、丰富的化学位点易于进行各种功能化修饰等优点,可被加工成注射水凝胶、海绵状多孔支架、纳米级电纺丝纤维和3D打印支架等多种不同形式,已应用于细胞附着增殖膜、酶固定膜、抗血液凝固物质、药物缓释载体、人工皮肤、人工肌腱等领域。
近年来,通过种植各种细胞、负载各种生长因子和不同化学改性修饰等,丝素蛋白支架在骨组织工程中的应用日趋广泛和深入。目前,弱凝胶性能和缺乏触发细胞增殖和分化的生化路径限制了其在骨科临床的应用。通过与生物活性材料复合,将改善SF的成胶性能和增强其诱导新骨形成和矿化能力。
3、壳聚糖
壳聚糖(CS) 是甲壳素的脱乙酰多糖,是一种氨基多糖,具有抗菌性、抗肿瘤、免疫调节、可加速新血管形成并促进新骨形成等生物活性,通过与羟基磷灰石、海藻酸盐和明胶等材料复合可增强其力学强度和骨诱导性能,在组织工程领域受到学者们的关注。
可降解合成聚合物材料
合成高分子材料具有来源丰富、可大规模生产、易加工及价格便宜、良好的生物相容性、通过化学或物理修饰方法可调控材料力学强度、生物活性、降解速率和微观结构等优点,已被广泛应用于组织工程领域。其中,聚乳酸、聚己内酯和聚氨酯得益于其优异的生物可降解性能,在骨修复材料领域已成为研究热点。
图2显示了合成聚合物体内降解机制,即在生理环境中合成聚合物在水或酶的介导下发生水解降解,导致酯键断裂,从而产生低聚物或单体,最终通过吞噬作用(低聚物) 或代谢(单体进入体内循环变为二氧化碳和水) 被排出。基于聚合物降解发生的位置而存在本体降解和表面降解两种模式。本体降解会引起整个植入物的降解,植入物的分子量和机械强度随降解时间的延长而降低,甚至影响植入物结构的完整性。表面降解局限于植入物的表面,植入物的质量随着降解时间的延长而减少,但植入物的分子量和机械性能保持相对不变。
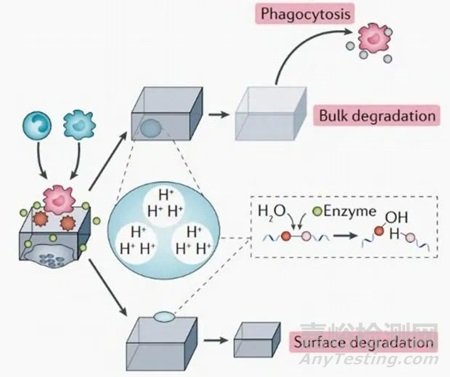
图 2 合成聚合物体内降解示意
1、聚乳酸
聚乳酸(PLA) 是以生物发酵生产的乳酸为主要原料聚合得到的聚合物。具有良好的力学性能和生物相容性、易加工性和生物降解性。1995年被美国食品与药品管理局(FDA) 批准为生物降解医用材料,已广泛应用于外科手术缝合线、血管移植、药物传输、骨科、眼科等医学领域。作为骨损伤修复材料(例如骨钉和髓内钉) ,PLA可替代传统的金属材料,以克服应力屏障、骨质疏松及二次手术等问题。然而,PLA存在生物惰性、降解速率低、降解产生的酸性降解产物在体内引发炎症等问题,限制了其在临床中的推广应用。
学者们发现PLA的降解性能受聚合物的分子量、分子构型、结晶度、温度、pH值和酶等因素的影响,通过调节各因素以及结合不同改性方法将PLA功能化以调控降解速率,通过与生物陶瓷和其他聚合物复合以增强其生物活性和力学性能。
2、聚己内酯
聚己内酯(PCL)是由己内酯单体经开环聚合而成。PCL是一种具有优良机械性能且被FDA批准的产品,已成为骨组织工程中广泛应用的聚合物。目前,PCL推向临床应用时存在两个限制因素: 一是PCL的生物惰性不利于细胞的黏附; 二是PCL分子中有较长的亚甲基链段,使得其体内降解速度较慢。学者们通过掺杂生物活性物质、表面涂层和接枝共聚等方式对PCL支架的生物活性进行改性,以期提高成骨细胞的黏附、增殖、分化和矿化能力。
3、聚氨酯
聚氨酯(PU) 自1960s首次用于生物医学设备以来,由于其良好的生物相容性和可注射性等优点,受到再生医学和组织工程的关注。学者们通过热致相分离、盐浸、湿法纺丝、静电纺丝、二氧化碳发泡、3D打印和物理化学表面改性等技术致力于研发一种具有体内可逐步降解并促进新组织向内生长的可降解PU支架。
展望
鉴于可降解金属、生物陶瓷、可降解天然聚合物和合成聚合物在生理环境中降解机制不同,故在调控各自的降解行为策略也是各异。
对于可降解金属而言,其降解主要是由体液引起的腐蚀,其降解调控方式是优化金属晶体结构或对其表面进行涂层修饰,以改善体液与金属材料的接触,从而影响其降解行为。
对于可降解生物陶瓷,其降解主要是体液引起的水解,其调控方式主要是优化不同降解速率生物陶瓷的复合比例和引入多孔结构。
对于可降解聚合物,其降解涉及由细胞作用产生的酶降解、体液介导的水解、活性氧/活性氮引发的氧化降解和吞噬作用等,因此一方面可通过孔隙结构的优化以改善降解发生位点,另一方面在其表面引入功能小分子以调节细胞行为。此外,可注射的颗粒复合材料作为骨缺损修复重建中的构建块,其降解性能可借助非侵入性超声、交变磁场和电刺激等多手段进行辅助调控,以期获得降解速率与新生骨形成速率相匹配的新型可降解材料,助力于临床骨缺损修复再生的产品开发。

来源:Internet


