您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-08 08:20
本文是2024FDA亚硝胺指南更新非常重要和底层的一篇参考文献,作者来自全球7个监管机构,包括FDA、EMA、加拿大药监局、新加坡药监局、巴西药监局、荷兰药监局和德国药监机构。
参考本文,进行亚硝胺全面评估并形成报告,将会非常有用。
摘要:
N-亚硝胺(也称亚硝胺)是一类物质,其中许多是强效致突变剂,被归类为可能的人类致癌物。 自2018年6月以来,亚硝胺杂质一直是制药行业和全球监管机构关注的问题,当时监管机构被告知血管紧张素II受体阻滞剂(ARB)药物缬沙坦中存在N-亚硝基二甲胺(NDMA)。 从此全球监管机构合作分享有关亚硝胺问题的信息和知识,目的是促进技术问题的趋同,减少和减轻患者在人体药物产品中接触有害亚硝胺杂质。
本文分享了从质量角度对亚硝胺杂质的风险因素和潜在根源的最新科学研究与信息,以及风险缓解和控制策略的建议。
介绍:
2018年6月,全球监管机构开始收到来自一家制造商的一批缬沙坦原料药中含N-亚硝基二甲基胺(NDMA)的报告,这是一种推定的已知动物和人类致癌物。 随着进一步信息的获取,对亚硝胺杂质潜在存在的调查扩散到同一血管紧张素II受体阻滞剂(ARB)药物类别中的其他生产商和其他原料药。
基于动物研究,许多亚硝胺杂质在人身上表现出致突变和致癌活性。这意味着长期暴露在被认为安全水平以上的硝胺杂质中可能会增加致癌的风险。 此外,根据ICH指南"评估和控制药物中的DNA反应(诱变)杂质以限制潜在的致癌风险"(ICH M7),N-亚硝基化合物和亚硝胺被列入关注的队列。
鉴于这一事件的全球性和保护公共许可证健康的必要性,一个监管机构联盟开始通过多方电话会议分享信息。 这包括关于即将采取市场行动的信息,如批量召回、外部通信(例如公共和医疗保健专业通信和媒体发布)与公共卫生风险相关的信息、关于污染源的科学信息以及用于测试潜在影响药物的分析方法。 随后在雷尼替丁、二甲双胍和利福平等其他药物报告了亚硝胺杂质的存在,监管机构联盟继续与2018年成立的"亚硝胺国际战略集团"(NISG)进行讨论。该小组开始定期举行会议,重点讨论关于市场和其他管制行动的知识共享问题。
由于NISG参与监管机构对技术问题和科学发展进行更深入讨论的共同利益,2020年底成立了同一监管机构的第二个子组"亚硝胺国际技术工作组"(NITWG)。 其他监管机构于2021年初开始加入了这一合作计划,由具有安全、毒理学、质量(化学和制造)、药学和分析科学背景的专家组成。 NITWG的成立是为了分享有关亚硝胺的技术安全和质量问题的科学知识和当前想法,并在可能的情况下促进各成员管辖区之间的技术趋同。
NITWG中内部监管合作伙伴的质量技术专家合作促成了本文的撰写,旨在从质量角度分享当前信息和影响,包括根本原因、风险因素和风险因素。 以及人用药物中亚硝胺杂质的风险缓解措施。
背景:
N-亚硝胺是自19世纪以来已知的一种物质。 亚硝胺在有机化学中作为溶剂或合成中间体的应用有限,除了N-亚硝基二甲基胺(NDMA)之外,N-亚硝基二甲基胺(NDMA)是大规模用于生产1,1-二甲基肼,作为可储存液体火箭燃料。 在此期间,发现了NDMA对人体的毒性作用。
随后,NDMA被报告可致大鼠肝癌,开始了激烈的科学研究,在20世纪60年代鉴定出几十种亚硝胺为体内致癌物。截至2022年,228种低分子量亚硝胺衍生物的动物数据显示,82%是体内致癌物,与给药途径无关。 通常亚硝胺需要代谢激活才能启动致癌作用,根据普遍接受的机制,亚硝胺在阿尔法位中被细胞色素P450酶羟基化,并转化为反应性药物,如重氮或羰基化。 在这些代谢途径中产生的亲电部位很容易与人体中DNA中的亲核中心发生反应,从而导致致癌过程。
20世纪60年代,经亚硝酸盐处理的食品中NDMA形成与动物致癌作用之间存在联系,从而成为对亚硝胺作为人类致癌物的评估。 因此国际癌症研究机构(IARC)发起了一项关于亚硝胺的整体研究计划,该计划后来确定了人类接触亚硝胺的多种来源。 人类通过吸收和形成前体接触亚硝胺可以是内源性,也可以是化学、金属和食品工业以及其他生活方式相关来源(如烟草、药物、水、食品、化妆品和家用产品)的外源性。
例如,国际癌症研究机构目前将NDMA归类为可能对人体有致癌作用(2A类),而两种烟草特异性亚硝胺(即4-(N-亚硝基甲胺)-1-(3-吡啶基)-1-丁酮(NNK)和N-nitrosonitrosonornicotine (NNN)被归类为致癌1类。1970年有报告显示亚硝胺与活性药物成分(API)在体内形成有关,某些情况下可在体外形成。例如,NDMA被报告为氨基苯那酮(也称为氨基吡啶)中的杂质,氨基苯那酮是一种广泛用作退热和镇痛剂的产物。
重要的是, 在1970年代和1980年代的分析测试(甚至最近的测试)在某些情况下容易产生分析性假阳性结果,在某些药物进行测试时,测试条件可能形成NDMA,因此应谨慎评估这些药物产品本身中含有亚硝胺的初步报告。自2018年以来,随着现代分析技术和分析程序验证在原料药和药物产品中定量测量亚硝胺的应用,更准确和可靠的数据来准确评估药物中是否存在亚硝胺。
即使某些药物分析在1970年代可能不完全可靠,Lijinsky等人也报告服用各种药物(如氨基苯甲酮)的大鼠肝肿瘤发病率有所增加。 当时德国药监局于1975年发布了一项建议,通过添加抗坏血酸作为抗氧化剂来重新配制氨基苯甲酮制剂,以防止体内NDMA形成。 德国药监局于1978年建议从市场上召回氨基苯甲酮产品。 在其他研究中,没有观察到抗坏血酸和无抗坏血酸的氨基苯甲酮样品片NDMA含量的显着差异。值得注意的是,最近在二级胺模型处方对亚硝胺的配比研究表明,抗坏血酸和其他抗氧化剂具有明显的抑制作用。
正如最近在氨基苯甲酮病例之后总结的那样,科学家们开始研究其他原料药和制剂中的亚硝胺杂质,结果差异很大。 例如,Krull等人测试了可能含有3种N-亚硝基化合物的73种产品,没有发现NDMA或N-亚硝基二乙胺(NDEA)。 然而在其他研究中,二硫氰胺成品中检测到亚硝胺水平,NDEA的亚硝胺含量为94-980ppb,而哌嗪制剂中的亚硝胺含量高达20ppm。值得注意,在活性物质的各论中列出了数量有限的亚硝胺杂质(例如吲哚酰胺、格列齐德和莫西多明),N-亚硝基二乙醇胺(NDELA)是辅料trolamine中唯一列出的降解产物。
最近一项报告,水消毒程序可导致与某些原料药结合产生N-亚硝胺。 采用二氯甲烷提取步骤的分析程序,以制备样品和采用高温GC-MS测量方法,研究了20种药物暴露于氯胺消毒的水中后对N-亚硝胺形成的敏感性,结果显示8种原料药的摩尔收率高于1%。 雷尼替丁具有最强的形成NDMA的潜力。尽管摩尔转化率较低,但报告雷尼替丁在用臭氧处理水处理时也有类似的结果。 根据最近的报告,所使用的测试条件可能导致分析性结果假阳性,结果应谨慎解释。
1978年,世界卫生组织(世卫组织)专家组提出,在标准条件下采用亚硝化分析程序(NAP测试)作为一般的体外测试方法,研究药物亚硝化能力。 此后,药物-亚硝酸盐相互作用对人类造成的遗传毒性和致癌风险在评论文章中得到了全面证实。 利用超临界流体色谱法SFCMS/MS分析,67种药物物质中有33种在NAP测试条件下,形成相关数量亚硝胺药物相关杂质(NDSRIs),这表明NAP测试在评估亚硝酸盐性方面的潜在应用。 由于亚硝酸盐浓度高于生理条件下通常存在的浓度,NAP试验是否适用于充分处理药物的内源性亚硝酸盐似乎存在疑问。 最近对雷尼替丁进行的测试直接证明,该药物产品在体外或健康人体受试者与人体生理相关的条件下不是亚硝胺的来源。
在临床发展中对亚硝基可溶性及内源性亚硝化的研究缺乏指导。相比之下,在2007年的一篇论文中,人们普遍质疑医药产品中基因毒性的相关性。 然而,ICH指南"评估和控制药物中的DNA反应(诱变)杂质以限制潜在致癌风险"(ICH M7)随后于2017年制定并最终发布,为评估和控制药物中的诱变杂质提供指导。如ICH M7所述,N-亚硝基化合物和亚硝胺被列入关注队列,因此,存在这种亚硝胺杂质应酌情触发后续行动。此外,最近的区域指南(表1)包括要求制造商进行风险评估和确认性测试,以提供有关药物中胺类亚硝化的信息。
总体而言,关于亚硝胺对人类造成疾病的风险还有很多待了解,整个领域是需要相当大的持续工作,旨在提供必要的科学数据以填补知识空白。
亚硝胺化学性质
对亚硝胺的化学性质进行了综述。低分子量的亚硝胺可以分离为可蒸馏液体或结晶固体。由于N-NO基团的偶极矩大,并且取决于所附着取代基的亲脂性,它们部分可溶于水,并且易溶于有机溶剂。 当考虑通过标准的水处理程序从反应混合物中清除这些物质的效率以及制备分析样品时,这种溶解特性具有重要的意义。 如大分子量的亚硝胺杂质,原料药中仲胺的亚硝化(称为亚硝胺药物相关杂质或NDSRIs),这些分子中的其他部分结构和嵌入官能团可以显著改变物理化学性质,阻止该类亚硝胺的形成。
亚硝胺的性质和反应性受到氮-氮键zwitterionic共振结构的影响,具有明显的双键特性,导致平面性阻碍旋转。N-NO键可以热破裂,但通常需要暴露在高温(400-500°C)下。 亚硝胺在光照下也容易发生光降解,紫外线光解可作为一种从水中去除亚硝胺的技术得以应用。
亚硝胺经历各种合成转化。 它们可以在酸性溶液中质子化,主要在氧原子上充当刘易斯碱和氢键受体。 脱硝基(与亚硝化过程相反)可以在不存在或存在催化亲核物质(例如溴)的情况下发生,以提供次胺和亚硝酸。 它们容易在各种条件下还原,例如通过催化氢化,或通过溶解金属和氢化物还原转化为相应的肼衍生物。过氧化物试剂氧化亚硝胺常用于制备N-硝胺。亚硝胺也可以通过光解重排转化为相应的amidoximes。在a位金属化后,它们可以被烷基化并酰化以形成相应的加成物。a-羟基-N-亚硝胺具有极强的反应性, 在生理pH值的水溶液中显示体外不稳定,半衰期几秒,但也是体内形成的中间体,是亚硝胺与DNA反应并显示其致癌作用机制的一部分。
N-亚硝胺可以在某些反应条件下由胺和亚硝化剂(通常含有氧化氮化合物,NOx,表4)形成。 亚硝酸与碱性胺形成盐,当加热时,可以进一步反应以提供N-亚硝胺。 这些NOx种类具有不同的反应性,并且可以根据反应介质的pH值和溶剂的性质而与胺发生不同的反应。 在低pH值下,存在更强大的亚硝化试剂,但胺是质子的,因此反应较少。 因此,水溶液中有效的亚硝化条件取决于亚硝化种类、pH值和胺在低pH值下具有最佳生成率的碱度(路线1)。 即使在中性和基本溶液(路线2)中,在催化醛的存在下,也可以实现肿胺的N-硝化。
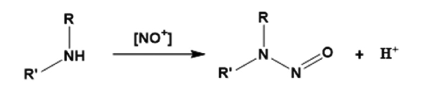
路线1:肿胺在酸性条件下的亚硝化
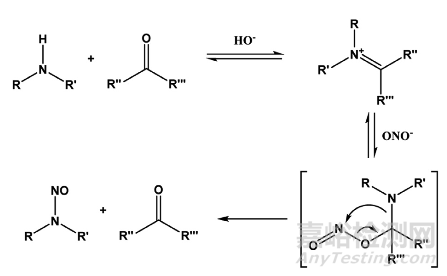
路线2:仲胺在碱性条件下的被羰基化合物催化的亚硝化
这种经典反应机理被认为是在酸性条件下优先形成的不同亚硝化物。 一氧化氮通常不会导致亚硝胺的形成,尽管一些金属和有机金属络合物能够使用一氧化氮催化亚硝化,例如已知其他氮氧化物种类包括亚硝酸盐和亚烷基亚硝酸盐,以及亚硝酸酐(N2O3)、四氧化二氮(N2O4)、亚硝酰氯(NOCl)、亚硝基硫氰酸盐和亚硝基苯酚。 其中一些可以作为试剂使用,但它们也可以在其他处理过程中形成(例如,在肉腌制过程中,在麦芽酿造过程或化学反应期间)。 已知一些抗氧化剂可以抑制亚硝胺的形成,例如抗坏血酸,因此添加到腌制肉类中。 伯胺很容易与硝化剂反应,但相邻氢原的存在允许亚硝胺物快速转化为重氮盐。 因此,亚硝胺杂质的形成并不被认为是主要的风险,当只有伯胺存在时,尽管在某些情况下观察到低产量的亚硝胺形成。 对于次胺,由于缺乏足够的a-质子,通往重氮物种的途径受到抑制。 二级胺及其铵盐容易与NOx反应形成相关的亚硝胺,这一过程可以通过亚胺离子形成甲醛等醛类催化,通过亚硝基卤化物催化卤化物。 已知叔胺及其铵盐也可通过交换-反应机制直接与亚硝酸盐反应形成亚硝胺(路线3)。 据报告,季铵离子形成亚硝胺,并假定通过重排的亚硝化脱烷基化,然后通过胺硝化反应形成亚硝胺。 已记录了一系列替代合成工艺,包括硝基甲烷与外部氧化剂结合使用。
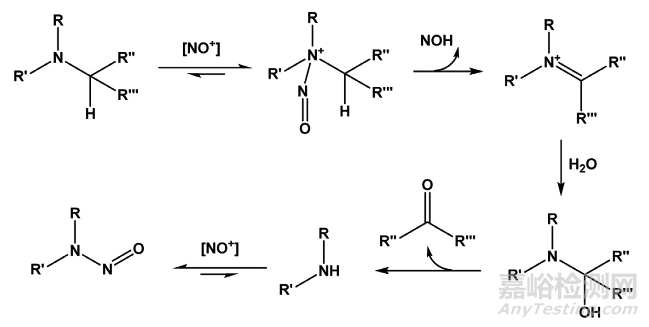
路线3:叔胺在有a-氢的条件下被亚硝基脱烷后的亚硝化
亚硝胺也可以通过非经典反应形成,例如与金属在酸性条件下反应还原硝胺和在金属催化剂存在下加氢。此外,肼化合物与氧/催化剂和过氧化氢氧化会产生亚硝胺。 肼化合物可通过臭氧分解转化为亚硝胺。
许多亚硝胺的化学只在溶液中研究过。 这些条件主要在API的制造过程中观察到。 然而,近年来发现亚硝胺的形成发生在成品制造或原料药和成品的储存过程中。 这种反应假定发生在固态或溶液与固体之间的界面(即表面)。 亚硝酸盐、过氧化物和甲醛是多种赋形剂中的已知杂质,在制成品的配制和储存过程中,它们可能单独或组合导致亚硝胺的形成。
在包装操作过程中,可以形成气体状的亚硝化剂,当存在胺时也可以导致亚硝胺的形成。在过去几年中,已经确定了形成亚硝胺的许多其他途径,本文第3节对这些途径进行了深入介绍。
监管机构就亚硝胺提交的主要指引文件
NISG监管机构已经发布了几个关键的指南文件,以分享有关亚硝胺的相关信息。 表1列出了由不同监管机构应用和公布的一些关键公共信息、指导和指南。 此外,自2018年以来,监管机构已经采取了召回等市场行动,因为不同药品的亚硝胺杂质被识别和定量超过可接受的摄入量(AI)限制。 此外,在机构网站和科学期刊的同行评审出版物中发现了令人关注的药物产品。
血管紧张素-II受体拮抗剂(也称为"沙坦")中确认存在亚硝胺,引发了监管机构对此事的首次行动。 在"沙坦"案例得到证实后,许多监管机构广泛将召回等行动应用于二甲双胍和雷尼替丁药物产品。 主要基于"沙坦"的经验,许多监管机构描述了从2019年开始在某些管辖区评估质量风险和控制API和药物产品中亚硝胺的风险的标准考虑因素。
大多数监管机构已采用一种常见的三步法,指导业界评估和控制市售药品中的亚硝胺。 总而言之,这种做法包括:
步骤1:风险评估;
步骤2:确认测试;
步骤3:根据需要,变更与授权。
监管机构已采用多种工具,向工业界和公众介绍和指导与亚硝胺风险减轻有关的活动。 例如,监管机构提供了指导,促进了科学讨论,并与医疗保健专业人员和媒体进行了沟通。 此外,监管当局一直在广泛合作,以配合科学指导。 Anvisa为新的决议举行了公众咨询,并与业界互动以制定指导方针。 EMA实施了亚硝胺实施监督小组(NIOG),包括与行业协会定期举行会议,以及与质量和安全工作组进行更注重科学的互动。 网络研讨会也是FDA和加拿大卫生部等几个机构采用的一种常见方法,以提供更新并促进监管机构和行业之间的讨论。
为了补充当局采取的行动,一些机构如FDA,加拿大卫生部,HSA, 瑞士医药公司和欧盟官方药物控制实验室(OMCL)网络已经开发并发布了API和药物产品中亚硝胺含量的分析方法,以支持生产商进行第二步确证测试计划。总体而言,监管机构在可能的情况下寻求促进成员之间的技术趋同。
活性药物成分(API)的根本原因和风险因素
评估潜在的亚硝胺形成或引入的过程是一个复杂的挑战。 为明确评估亚硝胺风险基础,全面分析亚硝胺和亚硝胺前体的所有潜在来源,包括非明显来源。 监管机构已就评估亚硝胺风险的必要性(见表1)向生产商发出指南,并已就亚硝胺风险的性质及其缓解发表了广泛的报告。在评估药物物质和成品药物对亚硝胺的风险时考虑的根本原因将在本文中讨论。
表1:不同监管机构发布的公共交流、指南、问答文件和法规

表2概述了原料药中亚硝胺形成和污染的根本原因和危险因素。表3和表4分别列出了胺和硝酸盐源用亚硝胺前体。
一个因素是亚硝胺官能团仍然是几种合成转化中一种有价值的中间体。因此,药物中亚硝胺杂质含量的明显来源是其有意引入制造工艺作为起始材料或合成中间体(表2)。 利福平药物和利福平药物中1-甲基-4-硝基哌嗪(MNP/MeNP)和1-环戊基-4-硝基哌嗪(CPNP)的出现,部分可以追溯到它们作为中间体在制造过程中引入,并转化为具有肼官能团的中间体。有意使用亚硝胺的工艺需要一致、稳健的净化步骤,生产商应谨慎使用回收试剂和溶剂,以限制最终药物中亚硝胺杂质的存在(表2)目的。
总体而言,亚硝胺中间体和起始原料在API合成中相对较少。 更可能的情况是,亚硝胺无意中作为原料或其他原料中的污染物引入制造过程(表2)。 在生产含有亚硝胺杂质的原料药和由于使用回收溶剂和原材料而似乎没有风险的原料药(表2)的设施内,也观察到材料与亚硝胺交叉污染。 在某些情况下,溶剂或催化剂回收过程会产生亚硝胺,然后将其引入后续工艺步骤,从而产生受污染的API。
表2:亚硝胺形成和活性药物成分(API)污染的根本原因和风险因素示例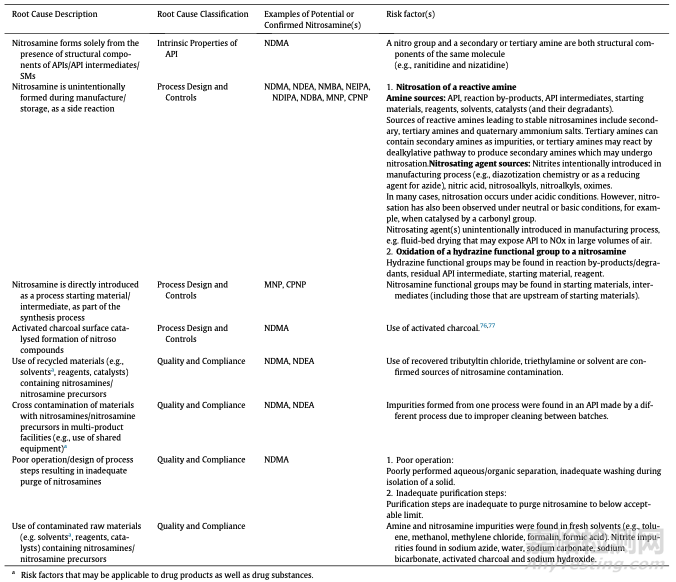
药物中亚硝胺杂质发生最广泛的根本原因是它们在生产过程的步骤中无意形成。 虽然已经描述了多种形成途径,但在API制造中观察到的亚硝胺形成可以从两种一般反应中解释:肼官能团的氧化或通过易反应性胺与亚硝酸盐试剂(如亚硝酸)的反应。
1,1-二取代肼氧化成亚硝胺是一种容易发生的反应,可能由于空气中存在氧气或臭氧而发生(路线4)。单取代肼也容易氧化。 然而随后的亚硝胺迅速产生高反应性的重氮盐,并且几乎不会造成任何影响。
亚硝胺成为最终药物中杂质的风险。 仅由于原料、合成中间体、作为反应副产物或降解剂而引入的1,1-二取代肼的存在,或在原料药本身中存在1,1-二取代肼基团,就应考虑到工艺存在风险。
有或没有氧化条件,值得注意的是,1,1-二取代肼也可能通过水解作为降解剂被释放,随后被氧化成亚硝胺,而亚硝胺通过纯化步骤将更难控制,因为在适当条件下,这种降解剂在储存期间会随着时间的推移而增加。 还需要研究起始物料的合成途径,以确定与起始物料同时引入二次肼杂质的潜在可能性。
可亚硝化的胺来源
表3列出了可作为亚硝胺前体胺的一些潜在来源。 任何常规的亚硝化剂都容易发生一次和二次亚胺和芳香胺的亚硝化。 当亚硝酸盐存在时,伯胺形成短寿命的亚硝胺,迅速脱水到相应的重氮盐;次级胺在药物中提供亚硝胺污染的最大风险,因为可以从次级胺中形成稳定的、可分离的次级亚硝胺。 尽管从历史上看,叔胺和季铵盐对亚硝酸盐几乎不反应,但事实上能够通过脱烷基途径进行亚硝化,尽管速率要低得多,并且是二次亚硝胺杂质的另一个潜在来源,因此它是亚硝酸盐的潜在来源。
表3: 亚硝胺前体:胺类
除了在生产过程中使用上述可亚硝化胺作为原料所带来的风险外,含有二级或三级胺或季铵盐的杂质、降解剂和API相关中间体也对亚硝胺的形成构成风险。 仲胺可以作为残留杂质或降解产物存在于溶剂中,如N,N-二甲基甲酰胺(DMF),或作为来自胺基(如三乙胺)的微量杂质或脱烷基化产物。根据合成途径,某些原料药可能含有残余合成试剂,例如二甲双胍因合成这些原料药可能含有残余合成试剂。
某些原料药由于其结构和反应性本身可以作为亚硝胺前体。 一般原理,任何仲胺都可以与硝化剂发生反应以形成NDSRIs。 在实践中,由于立体电子效应,某些仲胺的反应性可能低于其他仲胺。 一项研究使用标准的NAP测试评估了57种药物的亚硝化。 在评估的57种药物中,有7种在使用的条件下显示体外转化率至少为50%。 不出所料,在NAP条件下亚硝化率超过50%的七种药物中,仲胺类药物占六种(pH 3至4,40 mM亚硝酸盐,10 mM药物在37℃下长达4小时)。 值得注意的是,研究中使用的NAP条件被优化为亚硝胺在水溶液中的反应,因此可能无法预测亚硝胺杂质在其他情况下的形成趋势。
此外,API的肿胺片段是常见的工艺杂质,也在于某些药物各论中杂质谱中。 API结构内的叔胺官能团可以进行亚硝化脱烷基化(图3)以形成肿胺。 以2-(二甲基氨基甲基)-吡咯和生物碱胺为原料,经裂解形成NDMA。 抗咳和粘液溶解剂溴己烷可反应生成N-硝基环己基甲胺(NCMA)。 在最近的一次综述中总结了这些案例,指出适当位置富含电子苄基的潜在存在可能促进快速亚硝基脱烷。
亚硝化剂来源
反应性亚硝化剂有多种潜在来源,可作为亚硝胺前体(表4)。 肿胺的亚硝化通常被描述为胺与亚硝酸阳离子(NO+)或三氧化二氮(N2O3)的反应,两者都可以与亚硝酸平衡存在。 胺的亚硝化依赖于pH,在酸性条件下(pH 3-4)通常更快。 酸性溶液中最常见的反应途径是通过亚硝酸和仲胺。然而,也描述了自由基途径与NO/O2和原位生成硝基盐的反应。 此外还报告了醛催化亚硝化的情况。在机理上提出醛类催化剂与二羟基胺发生反应,形成亚胺类。 亚硝酸盐添加到亚胺中间体形成亚硝酰供体,亚硝酰供体可与另一当量仲次胺反应形成亚硝胺并生成醛催化剂。 这种途径即使在中性或碱性介质中也可以允许亚硝化。
表4: 亚硝胺前体:亚硝胺化剂
水中可能含有残留的亚硝酸盐。 例如,提示水中的氯拉明与雷尼替丁等含胺药物和氧反应形成NDMA。此外,其它叔胺产生的NDMA是氯胺用于饮用水消毒过程的副产品。亚硝酸盐也可能存在于制药过程中使用水中的微量水平。 制药工业的科学家在原料药制造过程中研究了水中微量亚硝酸盐造成的亚硝胺风险。 研究认为用于原料药制造的水中通常发现的亚硝酸盐水平非常低(<0.01mg/L,大多数情况下,不会通过与仲胺(pKa>9.5)反应而引起显著水平的N-亚硝胺。 然而这些报告说,使用较少的碱性胺,在工艺温度升高, 或低pH值条件,加上亚硝酸盐含量升高,有可能产生N-亚硝胺的水平,如果下游处理不能提供足够的净化,则可能导致原料药中存在一定数量水平的亚硝胺。 提出了一种预测硝化速度和硝化程度的模型。 然而,该模型在水不是主要溶剂的系统中的预测能力尚未得到证明。
活性炭是API制造过程中常用的原料。 这种材料已被证明可以在有氧条件下促进肿胺向N-亚硝胺的低水平转化。 该机理与空气中氮气固定后吸附在活性炭表面的活性氮的存在有关,研究表明亚硝胺是在pH > 6下可形成。
某些生产操作可以产生亚硝化条件。 例如,在麦芽酿造工业中,烧制(空气中高温干燥过程)可以从与亚硝胺反应的空气中的氮氧化物中产生亚硝胺。 API生产中使用的干燥过程涉及在高温下强迫空气过湿品药物,例如流化床干燥,这可能造成与在麦芽加工过程中产生有利的硝化条件(氮氧化物和热量)类似的风险。
有一些罕见的药物例子,其中亚硝酸盐和胺前体都存在于API结构中(见表2,API的内在特性)。 雷尼替丁和尼扎替丁片中NDMA的存在似乎有别于先前描述的根本原因。
雷尼替丁和尼扎替丁分别含有嵌入共轭与富电子呋喃或噻唑基邻接的共轭二甲基氨基实体(图1)。 值得注意的是,雷尼替丁的可亚硝酸化在1980年代被研究,通过亚硝胺基反应鉴定出两种亚硝酸盐产物和一种亚硝酸盐可逆来源的亚硝酸盐化合物。对于盐酸雷尼替丁,最近的研究表明,NDMA在固态下形成缓慢。 同位素标记实验表明,这是通过分子间脱烷反应发生的。 结晶形态、温度和湿度会影响反应速率,从而导致在室温下储存的药物产品中NDMA随时间增加而增加。 此外,外源性亚硝酸盐导致NDMA的产生速度要快得多。 Le Roux及其同事于2012年提出了这种脱烷反应,他们研究雷尼替丁通过氯胺酮的处理,形成了NDMA。 本文提出了一种雷尼替丁与氯胺酮和分子氧反应后产生NDMA的反应,另外的文献中进行的一项计算研究也引用了类似的机制。 然而雷尼替丁产品中NDMA的生成也与处方的储存条件和药典各论中列出的药物固有杂质有关。值得注意的是,最近对雷尼替丁的研究直接表明,NDMA不是在生理条件下由雷尼替丁在体内形成的,而是除非采取预防措施,否则NDMA可以在样品分析期间作为假阳性物形成。

图1:雷尼替丁和尼扎替丁分子结构
总体而言,雷尼替丁等药物可能存在一种以上的NDMA形成途径。 尼扎替丁产物中NDMA含量低于雷尼替丁,可能是因为尼扎替丁中噻唑类含量低于雷尼替丁中相应的呋喃类含量。 这与计算研究相关,这些研究预测尼扎替丁对氯胺的反应低于雷尼替丁。 此外,雷尼替丁作为盐酸盐存在,这可能进一步增加其对硝化反应相对于尼扎替丁游离碱的敏感性。
原料包括溶剂、试剂和起始材料、活性物质及其中间体均含有能够形成亚硝胺的官能团。 因此,需要采用整体方法评估是否存在任何二级亚硝胺、二级肼或亚硝胺前体。 许多情况下,许多亚硝胺杂质的可接受摄入量极低(即低于1.5毫克/天,ICH M7中定义的致突变杂质的毒理学阈值),并且低于ICH Q3A中建议的杂质阈值。 风险评估必须考虑是否可能存在亚硝胺。 亚硝胺杂质在少量亚硝胺前体经多次合成步骤和纯化处理后形成。 此外,一些亚硝胺杂质一旦形成,对重复的水提取步骤表现出惊人的抵抗力。 依靠预测清除计算来降低过程风险的策略对于某些过程已经失败。 当亚硝胺是已知的杂质时,生产过程可能需要更彻底的清除步骤来去除它们。 因此,批次测试仍然是证明亚硝胺杂质不超过可接受水平的重要组成部分。
来自于药物的根本原因和风险因素
API生产过程中与亚硝胺形成相关的风险因素通常有很好的记录,可以归因于使用的原材料和条件。 此外还研究了溶液相动力学,并预测了亚硝胺的形成。 第3节中介绍的亚硝胺和亚硝化剂的来源在评估与药物相关的风险时也是相关的,但由于制剂步骤往往不均匀,评估制剂中亚硝胺形成的风险不那么直接。 表5列出了药品中亚硝胺形成的拟定根本原及相关的风险因素。 近年来,生产商在发现亚硝化API时自愿召回产品。
表5:亚硝胺形成和药物产品污染的根本原因和危险因素示例
如上所述,肿胺对形成稳定的可分离亚硝胺风险最大。 含有胺基的药物通常作为它们的酸盐被分离出来,这也可以促进亚硝胺的形成。
辅料似乎提供了足够的亚硝酸盐来源,尽管它们的存在通常处于百万分之一的低水平。根据辅料生产过程中使用的不同原料来源和加工步骤(例如滴定、氧化和漂白)可以预期,不同辅料含有不同水平的亚硝酸盐。 因此,辅料中亚硝酸盐污染风险的确定受到不同分析水平的影响,并且生产商和批量对批量变异性会进一步复杂化这种水平。辅料中的过氧化物杂质可能会氧化API中间体或降解剂中存在的肼以产生亚硝胺,尽管对这一风险因素的确认仍有待确定。 甲醛是另一种已知的杂质,存在于多种辅料中,这些辅料在中性或基本条件下可能催化药物产品中亚硝胺的形成(路线2)。
亚硝胺形成的另一个潜在来源可能是生产单元操作,例如湿法制粒,这可能通过有效地溶解和混合反应物来促进API和亚硝化剂之间的接触,特别是如果工艺步骤发生在最佳pH范围内。流化床干燥等制造工艺利用大量空气,从而有可能将药物混合物暴露在可转化为亚硝酸的NOx化合物中。虽然一般认为与水质有关的风险较低,但在生产过程中使用的水可能含有亚硝酸盐、氯胺,甚至亚硝胺。 因此,水的质量应得到充分控制。
叔胺的反应通常比肿胺慢约1000倍,以形成亚硝胺,这是由于亚硝胺在亚硝化之前具有限速脱烷基化步骤。 然而某些叔胺含有大大促进脱烷基化的结构特征,例如,由于富含电子的杂芳基团或其他可以稳定羰基化的官能团。 在某些情况下,叔胺在加热的低pH环境中(如湿法制粒、喷雾干燥和随后的加热干燥)可充分活化以进行脱烷基。 在这些条件下,叔胺通过硝化脱烷基可产生可测量的肿胺产物。 在药物中生成肿胺并不限于叔胺脱烷,例如通过酰胺水解生成。 API以外的胺源可以提供反应胺的来源,例如杂质,反离子和辅料。 当硝化反应与原料药杂质形成NDMA时,生产商曾多次自愿召回产品。由于杂质通常与原料药相比被控制在较低水平, 亚硝胺风险通常对于高剂量产品和含有大量反应性肿胺杂质的产品可能更为显著。
药品包装可能会提供亚硝胺污染的另一个来源。 在铝箔中使用硝化纤维素与硝胺产品(如NDMA和NDEA)的形成有关。 印刷油墨的胺成分与硝化纤维素发生反应,产生挥发性亚硝胺。 在高温密封过程中,这些可以蒸发并沉积在其他水泡中的药物产品上。 此外高温热封过程可能导致挥发性氮氧化物,可能与药物中存在的胺反应以产生亚硝胺杂质。
预期更好地了解药物产品中亚硝胺形成的根本原因,以促进制定缓解战略,如下所述。
其他来源的根本原因和风险因素(与药物,药物合成或药物处方或制造过程没有直接关系)
观察到的一些根本原因和风险因素分别不属于表3和表5中提到的原料药和药物(表6)。 其中一些根本原因包括在稳定性测试(例如,使用亚硝酸盐控制湿度)或在分析过程中(例如高温)由于使用的条件而形成的亚硝胺。 在这些例子中,形成的亚硝胺不是由于药物合成或药物处方和包装步骤中存在的亚硝胺。 相反,亚硝胺的形成是分析测试时的假阳性,而不是与该药物相关的真正风险。总的来说,在制定分析方法时,应极为谨慎,以避免人为形成亚硝胺。
其他情况下,在某些生产步骤中使用的橡胶或阴离子交换树脂的浸出物分别导致存在NDMA或DMA。 在存在DMA的情况下,用于消毒水的残留氯胺酮可以与DMA反应形成NDMA。橡胶塞等弹性材料是药物产品中亚硝胺污染物的另一个潜在来源。 值得注意的是,一些原料药结构(例如,链球菌素)或作为药物作用机制一部分的形式(例如,molsidomin)。 像上面提到的过程水或渗滤液的风险与特定过程独特相关,可能导致亚硝胺的意外存在,其中最初不会发现任何风险。 总体而言,为了全面了解潜在风险,必须评估药物和药物所有成分及其各自的生产过程,以充分了解易反应性胺和亚硝化剂的潜力以及将它们组合在一起的点。 只要有足够的知识,就可以进行适当的风险评估,并制定适当的缓解策略。
控制策略及风险缓解措施
了解人用药物中亚硝胺杂质存在的风险因素和根本原因(表2-表6)为实施有效的风险缓解和控制策略奠定了基础。 亚硝胺杂质给患者带来的风险可以通过风险评估、改进处方和生产工艺设计策略以及药物质量体系(PQS)的部署降低到可接受的水平。质量风险管理,是有效的PQS的重要组成部分,被推荐用于指导评估,控制和减缓与人体药物中亚硝胺杂质相关的风险。 有效的PQS治理包括与符合合规性和良好制造规范的亚硝胺杂质控制相关的方面;包括但不限于:药品及其部件的质量属性可接受性;供应链合作伙伴在产品生命周期内的可接受性和持续可接受性;监督流程材料的回收和再利用等外包活动;并确保适当的培训和适用性适合其职责的人员。
表6:亚硝胺形成和其他来源污染的根本原因和风险因素示例
原料药和药品的生产工艺一开始就应尽可能避免亚硝胺杂质的形成或引入。 鉴于胺官能团在药物和天然存在的分子中无处不在,以及胺作为原料、试剂和有机碱的结构成分在API制造中的重要性,完全避免胺是不现实的。 此外,亚硝胺和亚硝酸盐存在于水等环境来源中,其被引入至生产工艺是不可避免。 最后亚硝化是一种有用的合成方法,可能不是在所有情况下都有实际的替代品。
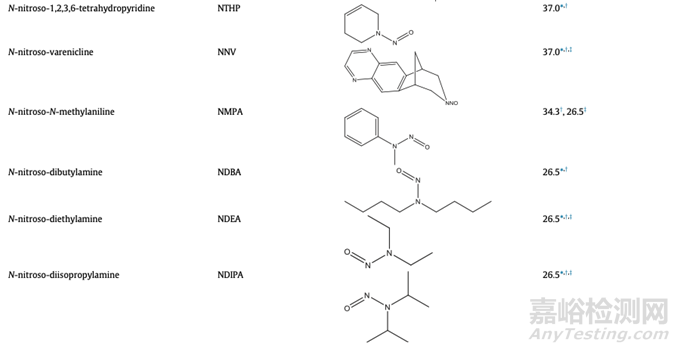
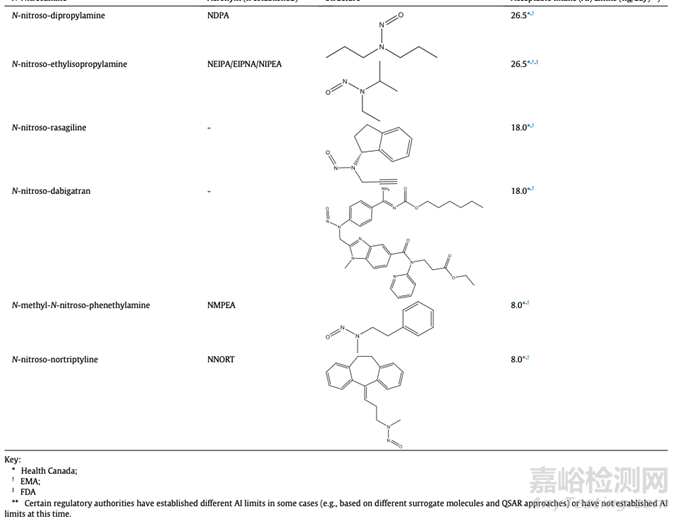
监管机构已经公布了几种亚硝胺杂质的可接受限度值值(适用的指南见表1,以及某些监管机构在出版物发布时提供的的可接受限度值的示例见表7)。 利益相关方应咨询各监管机构建议的AI限值指南,因为某些监管辖区可能尚未对某些亚硝胺杂质设定AI限值,并且表7中预先给到的限度值可能会根据未来的额外数据进行调整。
表7:个别监管机构公布的药物产品中亚硝胺杂质的可接受摄入量限制的例子(不一定适用于所有国家和地区)
为了降低亚硝胺杂质的风险,可以在原料药,辅料和药物的开发和生产过程中利用几种策略。
了解用于辅料、原料药和药物生产的水净化过程,并通过分析确保亚硝胺和前体水平可用于预期目的,可以促进基于知识的关于水源是否适合缓解亚硝胺风险的决策。 用于辅料、原料药和药品生产的水的质量范围从饮用水到注射用高纯度水。由于原料药制造中使用的饮用水可能含有低水平的亚硝酸盐和亚硝胺,因此应了解亚硝胺和亚硝酸盐的含量,并酌情加以控制。 常见的净水技术包括紫外线照射、臭氧分解、氯化/氯胺酮、反渗透和蒸馏。 紫外辐照是光化学降解亚硝胺的有效技术。 相反,使用氯或单氯胺的水消毒技术可导致产生亚硝胺,而臭氧溶解可产生氮氧化物,即已知的亚硝化剂,而臭氧溶解则可生成氮氧化物。
定位API生产步骤,其中硝化剂被使用在上游有二级或三级胺的步骤,并确保它们被充分清除是降低亚硝胺形成风险的有效策略。 然而,在硝化条件和胺不可避免地重合的情况下,在生产过程的早期定位这些步骤并包括有效的纯化操作可以降低风险。 在这种情况下,有机会进行后续操作,以清除下游步骤中形成的任何亚硝胺。 形成或引入的亚硝胺的化学转化,包括氧化和还原转化,可以用于去除它们。或者特定的单元操作,如萃取,蒸馏,结晶过滤,洗涤和干燥步骤,旨在清除特定的亚硝胺,以促进亚硝胺清除到可接受的水平。 在某些情况下,当亚硝酸盐用于原料药的反应条件时,如叠氮清除,工艺应设计成在与含有易硝化胺的有机相分离的单独水相中进行这些操作。
执行单元操作,例如在液-液萃取过程中仔细的相分离和相间处理,可以控制亚硝胺杂质或其前体的工艺分离。 然而鉴于在药物中意外发现亚硝胺的案例数量,尽管采用了标准的纯化技术,但充分的纯化假设应通过适当的分析或实验数据加以确认,即亚硝胺前体或亚硝胺本身的传递数据。
无机碱,如碳酸钾,伯胺如正丁胺,或弱亲核碱,可作为二次或三次胺的替代品。 一种相关策略是避免使用酰胺溶剂,如DMF,N,N-二甲基乙酰胺和NMP,这些溶剂可能含有其生产的残留次胺,或者在特定工艺条件下水解以产生次胺。 同样避免使用硝基烷烃作为溶剂或试剂可以减少硝化剂在生产过程中持久存在的机会。 优化和控制工艺参数,如pH值,温度,浓度,添加率和处理时间,对于缓解亚硝胺形成也很重要。
第三方生产商可以使用回收方式,不管来源质量如何,可以从不同来源聚集材料,或使用产品之间共享的设备。 当生产商在内部回收物料时,应考虑相同的风险因素。 通过在回收物料中引入亚硝胺或其前体的风险可以通过根据对回收过程、设备清洁程序、验证程序和主动共享相关信息的特定知识,对工艺物料进行回收的承包商进行资格认证来降低。 回收物料(包括溶胶通风口、试剂或催化剂)的再利用也可限于制造工艺中的原始使用点,以进一步降低亚硝胺或其前体对工艺流程进行的污染风险。
药物生产和储存过程中影响亚硝胺形成的因素的认识不断发展。 虽然在溶液中广泛研究了胺类的亚硝化,但这些条件并不一定代表全部用于生产药品的条件以及涉及药品产品的条件。 例如,对于固体口服剂型,如制粒,压片,混合等常见单位操作对药物处方中亚硝胺形成的影响尚未得到深入研究。 这些操作影响可以带来巨大的压力和能量,有待系统调查。 在流化床干燥作业中,通过使用洗涤剂控制氮氧化物的引入可能是有效的。
透过测试研究辅料的亚硝酸盐含量,有助于选择和设计处方,降低亚硝胺形成风险。 多篇文献发表了关于多种辅料中亚硝酸盐含量的信息,可用于指导辅料的选择。许多辅料中,亚硝酸盐含量取决于供应商,即使来自同一供应商,也观察到批次之间的差异。 最近的调查证实了辅料中亚硝酸盐水平是导致二甲双胍类药物产品中NDMA存在的根本原因。
辅料质量可以通过在其质量标准中列入亚硝酸盐限度值来保证。 降低辅料中亚硝酸盐水平可能是药物生产风险降低的一种选择,但需要药品生产商和辅料供应商的合作努力。 含有在中性至基本范围内控制pH范围的辅料,药物制剂可以排除醛类潜在催化作用的药物制剂中有效缓解硝化作用。 精心设计的原辅料相容性研究和加速稳定性研究可以帮助确定亚硝胺和亚硝胺前体形成的风险,并指导选择合适的存储条件和容器封闭。
药品生产商也可酌情排除使用含有硝化纤维素容器封闭部件,或通过控制可能与其接触的材料中的胺含量来降低亚硝胺形成的风险。 通过将亚硝化抑制剂加入药物制剂中,抑制亚硝胺从具有肿胺结构的原料药和辅料中的亚硝酸盐中生成,是一种很有潜力的策略。
在口服固体制剂模型研究中,最近通过将抗坏血酸等抗氧化剂加入制剂中,证明了盐酸4-苯基哌啶的亚硝化抑制。 在同一文献中,甘氨酸、赖氨酸和组氨酸等氨基酸在溶液中抑制亚硝化。 研究人员假设,抑制亚硝化可以通过氧化还原,硝化或重氮化途径起作用。 随着关于药物中亚硝胺发生的科学知识进步,预计其他风险缓解方法也将不断发展。 最终当在药物中检测到亚硝胺时,基于可靠科学数据的彻底根本原因调查将告知最适当的风险缓解措施和控制策略。
结论
自2018年6月以来,关于药物中亚硝胺的认识和控制的复杂环境已经得到发展。 监管当局和制药行业继续采取措施解决与亚硝胺相关的担忧,以确保患者不会面临不必要的风险。
监管机构采取的一些措施包括采取行动(例如,产品召回,与生产商就亚硝胺进行沟通),其中亚硝胺的含量超过可接受的水平,并及时向医疗保健专业人员和公众提供信息,以促进知情决策。 此外监管机构已经参与并向生产商提供信息,以减少API和药物产品制造和储存过程中可能存在的风险因素。 正如本文所总结的那样,监管机构继续相互合作(例如通过与NISG和NITWG的讨论),并向利益相关者发布了指导文件,以提高对当前期望的认识并与利益相关者分享信息。 制药行业一直积极应对这些问题,以确保上市药品的持续安全、有效性和质量。
这些集体努力以及对本文详述的亚硝胺相关的一些潜在风险因素和风险缓解措施,应有助于制定有效的控制策略,以消除或减少患者在供人使用的药物中接触亚硝胺的情况。

来源:Internet


