您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-08 09:10
创新药价格居高不下的一个重要原因是高昂的药物研发成本和漫长的研发周期。随着新方法、新技术的涌现,是否有新的创新路径可以加快药物开发的速度。尤其是研发占比最高的临床阶段的降本、增速。2024年,BMS结合其内部经验就如何使用创新临床试验设计以更快获得关键数据,如何增加药物研发和开发效率等问题进行了分享。
BMS主要围绕4个领域(如下图所示)做出努力:采用创新型临床试验设计、优化试验设计、充分利用外部对照数据、人工智能及机器学习的运用。
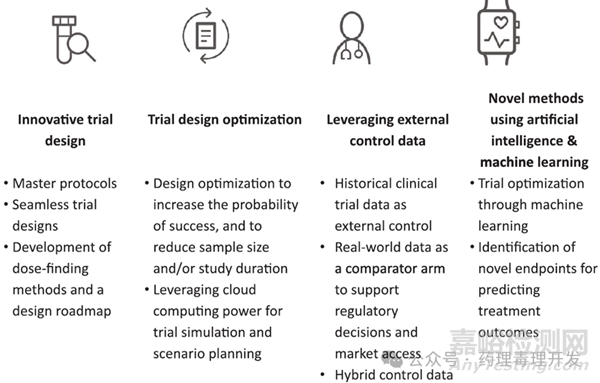
创新型试验设计
Master protocols
为了节约时间和成本,临床方案可以使用更专业的方案设计,比如篮式设计、伞式设计和平台式设计。比较典型的案例是BMS为其PD-1抗体联合用药临床试验发明的新型平台式设计FRACTION。经典的临床研究顺序是先开展Ⅰ期安全性研究,然后开展1个或多个独立的Ⅱ期临床探索初步有效性。比如PD-1抗体正在尝试与各种治疗方式或靶点的联用,如LAG-3、OX40、TIGIT、TIM-3、CD47等。这样每个单独的Ⅱ期临床联用试验均需要拜访机构、洽谈合同、准备伦理、起草方案等流程。正是看到传统设计的这一弊端,FRACTION将不同Ⅱ期临床进行了关联。如下图所示,PD-1/L1抗体未经治患者,先给予联用方案1,患者疾病进展后,则直接滚动进入另外一个联用方案。FRACTION会在试验之初就将主方案、分方案制定好,一次性通过伦理、合同等前期流程,大大节约了研究周期。FRACTION平台式设计已经帮助BMS PD-1抗体在肺癌、胃癌和肾癌中发现了潜在的联用组合。
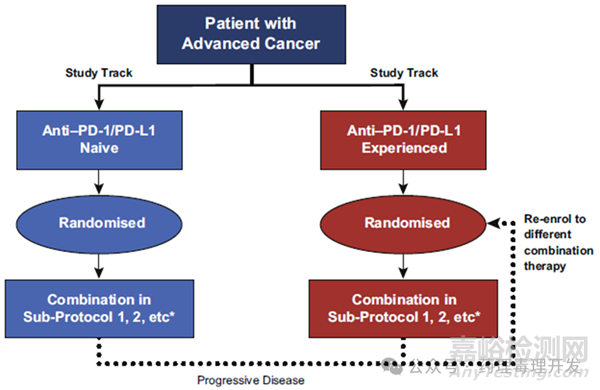
无缝试验设计
无缝式试验设计已经加快了BMS多个产品的推进速度。所谓的无缝设计具体指什么呢?BMS列举了内部几个成功的案例。
Breyanzi是BMS的一款CD19 CAR-T细胞产品,用于三线及以上B细胞淋巴瘤患者的治疗。与传统的Ⅰ、Ⅱ期临床序贯开展不同,Breyanzi的Ⅰ期临床通过贝叶斯分层模型将剂量探索、剂量扩展等安全性、有效性目的进行了整合。在Ⅰ期临床考察了两个剂量、不同给药次数(单次和两次)、不同瘤种(弥漫性大细胞淋巴瘤和套细胞淋巴瘤),既考察有效性,又考察了安全性。试验方法如下图所示,方案r1,1是起始剂量,单次给药,方案r1,2是降低一个剂量水平,另外两个方案则给药两次。当然,这种设计有CAR-T细胞这类产品的特殊性,给药剂量和次数比较固定,探索的空间相对小。
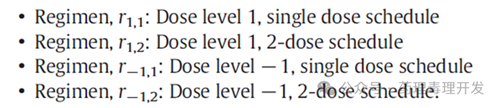
另外,看似简单的方案其实包含了很多统计学参数或模型在里面,包括毒理模型、药效模型、先验选择、效用函数、入组标准、终止标准等等。但通过这一无缝式整合设计,确实节约了研究周期和成本。
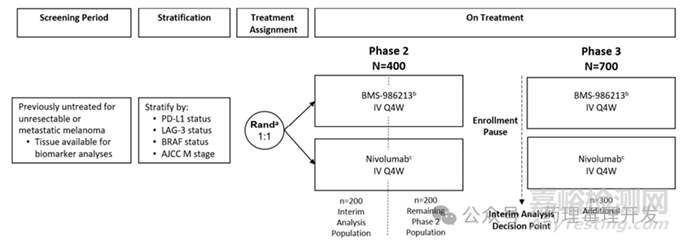
第二个案例来自BMS的第三代免疫治疗产品Opdualag,一款PD-1抗体nivolumab和LAG-3抗体relatlimab的复方生物制剂。与传统Ⅱ、Ⅲ期临床序贯开展不同,BMS为Opdualag量身打造了Ⅱ/Ⅲ期无缝设计方案(如下图所示)。大致设计思路是Ⅱ期临床预计入组400人,在完成200人时进行PFS中期分析,如果达到预设的HR(hazard ratio)标准,则视数据委员会建议启动Ⅲ期临床,再额外入组700人。如果达不到提前进入Ⅲ期临床的标准,则继续按原计划完成完整的Ⅱ期研究。当然,Opdualag成功达到预设标准,顺利通过无缝设计上市,较传统Ⅱ、Ⅲ期临床的设计思路,上市时间缩短了2-3年,成为全球首个PD-1/LAG-3双靶点治疗黑色素瘤的药物。
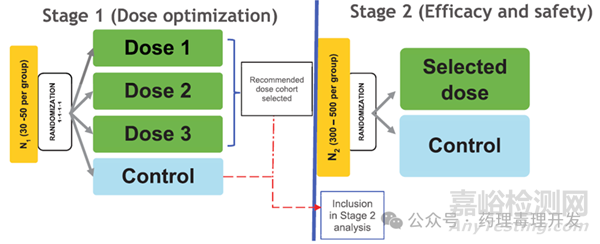
第三个案例是一个Ⅲ期两阶段设计的故事,iberdomide+daratumumab+地塞米松对比bortezomibe+daratumumab+地塞米松,治疗复发/难治性多发性骨髓瘤。方案设计如下图所示,试验分为两个阶段,第一阶段有点类似Ⅱ期临床设计,患者随机分入iberdomide三个不同剂量组或对照组,30-50人/组。之后会根据第一阶段获得的数据进行中期分析,评估最佳iberdomide用药剂量。然后进入第二阶段,患者随机接受iberdomide或对照,每组300-500人。两个阶段的数据均会纳入最终的分析。本设计的优势是增加了统计效力,缩短了研发周期。
肿瘤药剂量探索的方法开发和设计路线图
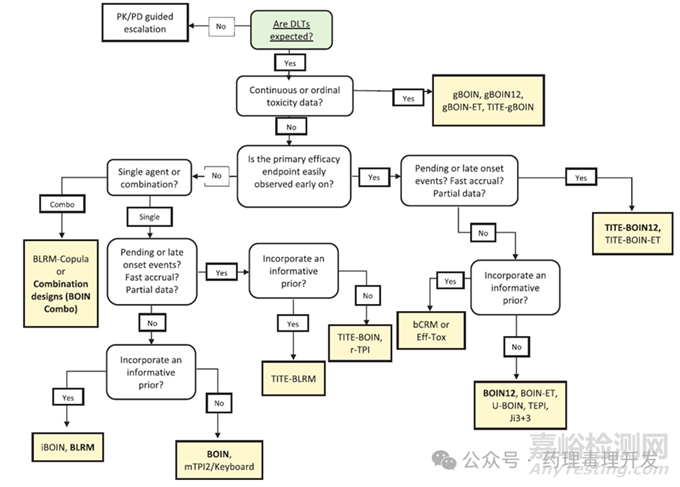
结合安全性和有效性数据,确定最理想的用药剂量是剂量探索的重要目的之一。FDA在2023年也出台了《Optimizing the Dosage of Human Prescription Drugs and Biological Products for the Treatment of Oncologic Diseases》指南草案,鼓励优化用药剂量。目前已经有很多剂量探索的方法,比较简单的是3+3设计,但很多新的方法值得探索和借鉴。BMS有一套内部的剂量探索方法选择路线图,根据DLT是否可预期、毒理数据的连续性、主要有效性终点是否容易观测、单用还是联用等确定剂量探索方法,常用的包括BLRM及其延伸版、BOIN设计及其延伸版、mTPI设计及其延伸版,具体如下图所示。
试验设计优化
临床试验设计需要考量的因素很多,包括目标人群选择、用药方案、对照选择、入排标准、试验持续时间、可能的中期分析策略及成功概率等。在传统模式中,最优试验设计的评估需要多次更新,每次对应一种设计,由于缺乏计算能力,团队通常需要很长时间来评估不同试验设计的运行特性。比如BMS PD-1抗体nivolumab+贝伐珠单抗+LAG-3抗体relatlimab与nivolumab+贝伐珠单抗+安慰剂对比的临床Ⅱ试验中,最初的试验目的是在总人群中评估三药组合能否做出PFS HR至少达到0.55的优势。但随着试验的开展,研究人员想进一步看下在biomarker阳性(BM+)亚组的治疗效果。这就涉及到是否会影响入组率、试验周期延长等可能。对运算的要求包括“A total of 1890 designs and 28 scenarios were evaluated in approximately 53 million simulation events”,需要很强大的算力支撑。随着云计算能力的发展,BMS设计了一个试验设计优化的框架,基于该框架,开发团队可以实现快速对某些设计参数的确定,如中期分析策略、入组模式、脱落率、样本量估算、持续时间、成本和效力等。借助云计算,以上步骤仅需要数分钟时间,而不是过往的数天或数周。
借助外部对照数据
众所周知,随机对照试验(RCT)被认为是评价药物是否有治疗效果的金标准。然而,某些疾病由于罕见、伦理考量或缺少标准治疗,采用RCT设计会非常高昂、耗时,并极具挑战。当传统的RCT不具备可操作性或有伦理挑战时,临床设计中整合历史对照数据和/或真实世界数据(RWD)也是可能的策略之一。BMS已经采用真实世界证据或数据完成了多个药物的上市。
使用历史对照数据作为外部对照
儿童多发性硬化症(MS)是一种罕见病,患者用药选择很少。这个疾病的特点决定了入组会比较困难。欧洲药品监管机构EMA认为如果原人群获得的证据与目标人群(如儿科患者)足够相关,则可以用于支持该目标人群临床疗效的评估。而儿童MS与成人MS之间就满足这一要求。因此,BMS采用Bayesian borrowing approach,借用该公司之前批准的治疗成人MS的试验数据进行了儿童MS临床方案设计,使整个试验样本量较传统设计减少20%,大大节约了研究周期和成本。
使用真实世界数据支持监管决策和产品上市
在BMS,来自真实世界的数据或者证据已经被广泛用于支持产品临床开发。BMS治疗复发或难治性骨髓瘤患者的BCMA CAR-T产品Abecma的关键Ⅱ期临床—KarMMa试验(NCT03361748)就是采用的真实世界证据作为外部对照,并将结果递交EMA,获得批准。BMS的另外一款靶向CD19的CAR-T产品Breyanzi,在其NDS-NHL-001单臂临床研究(NCT02631044)中同样采用了真实世界数据作为外部对照。2021年,FDA批准BMS的Orencia上市,用于治疗急性移植物抗宿主反应,在其递交的BLA申请中,也是采用了真实世界证据证明产品的有效性。
当然,除了单独的临床试验数据或真实世界数据作为对照,也有采用混合对照数据的(Use of hybrid control data),主要目的还是增强对照组数据的可信度。
人工智能和机器学习的使用
很多人往往觉得人工智能和机器学习离我们这个行业的应用还比较远,但BMS已经将这类技术应用在临床设计的优化,加速了药物推进速度。通过富集分子、转化、成像、临床、真实世界等数据,加深了对疾病生物学的理解。BMS开发并专利了state-of-the-art机器学习数字化平台,可以富集、标准化、可视化各种临床试验设计和结果,方便研究人员检索、浏览,以及对比不同的临床试验设计。而且,该平台具有过滤功能,研究人员可以对治疗线数、生物标记物、临床试验阶段、进展、入排标准等进行选择。
应用场景有很多,比如给定某一类药物,研究人员可以很快就能找到针对该类药物不同临床试验设计和有效性研究结果。研究人员无需逐一翻阅不同肿瘤药物公开的治疗指南,该数字平台可以实现快速查阅患者的标准治疗方案。另外,这一平台还能帮助选择合适的临床研究终点,包括OS、PFS和一些新型的终点。据BMS披露,机器学习平台还能帮助预测药物治疗效果,帮助医生选择治疗剂量以及及时做出给药继续或终止的决定。比如肿瘤药物通常以长径作为肿瘤大小判定的依据,BMS采用的3D成像,更真实观测肿瘤体积,而且基于3D结果的肿瘤生长速率与OS的相关性更好。所以,可以根据给药后3D肿瘤体积的变化趋势,药物治疗效果进行预测,用于相关决策。
最后
药物开发过程中,相较于药学研究和非临床药理毒理研究,临床研究所需的预算及研究周期占比是最高的。相信不只BMS,其它MNC应该也在对创新型临床试验设计、试验方案优化、外部对照数据运用以及人工智能/机器学习新技术应用进行了不同程度的探索。有些离我们可能还比较远,比如人工智能/机器学习,除了算力,还需要大量历史数据用于模型训练。外部公开数据倒还好,还有很多是内部数据,MNC产品管线多,不同临床方案设计和研究结果充足,更容易推进。但有些离我们很近,还是可以参考的,比如无缝式临床设计,比如外部对照数据的合理运用,都将有利于我们节约研究成本和周期。最后一点,BMS所公布的各种加速研发的策略里面,都有统计学家的影子存在,很多决策的制定如中期PFS分析、外部对照数据选择等,都需要参考统计学分析结果。一个候选药物,本身的基因再好,也需要一个最优的临床策略和方案支持,好马配好鞍,才能最快到达患者手中。

来源:药理毒理开发


