您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-10 08:35
摘要
目的 对药典分析方法确认的指标进行评估。方法 结合国内外相关技术文件的指导意见,总结并分析药典分析方法确认的指标选择,并对其合理性进行评估。结果 分别从药典“通用检测方法”“鉴别检查法”“低浓度定量 / 限度检查法”和“高浓度定量 / 限度检查法”四个方面对不同类型检查法的确认指标进行了归纳、总结与论述,确定了药典分析方法确认的指标。结论 明确了药典分析方法确认指标的选择依据,为制药行业的分析方法确认工作提供参考及借鉴。
【关键词】药品;分析方法;确认指标;药典
近年来,国内制药行业发展迅速,伴随着药品上市许可持有人(MAH)制度的推出,持有人变更的情况大量出现,随之而来的是药品技术转移工作大量增加。在药品技术转移的过程中,分析方法转移是其中的一项重要内容,而在分析方法转移的过程中,“药典分析方法的转移”是其中最为常见的情况,根据目前国内外对于分析方法转移的相关指导原则,药典分析方法的转移采用分析方法确认的方式,因此,科学、合规地对分析方法确认指标进行评估、确认是药品生产企业最为关心的问题。
1、药典分析方法确认概述
分析方法确认概念的提出最早起源于国际人用药品注册技术协调会(International Council forHarmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)2000 年发布的ICH Q7A[1],该指导原则对分析方法验证的描述为“分析方法必须验证,除非是使用药典或是其他已知的标准文献的方法”。很显然,这句话将“非药典分析方法”与“药典分析方法”的验证区别对待,传统的“非药典分析方法”的验证对于已经成熟并且纳入药典的分析方法似乎过于严格和刻板,并且某些确认指标似乎必要性不大,因此,有必要将其区别对待。
基于此概念的提出,美国药典委员会发布了USP < 1226 >分析方法确认[2] 和 USP < 1224 >分析方法转移[3] 两份指导文件,而《中国药典》也在 2020 年版中新增了《9099 分析方法确认指导原则》[4] 与《9100 分析方法转移指导原则》[4] 两个相关章节,同时,修订《9101 药品质量标准分析方法验证指导原则》名称为《9101 分析方法验证指导原则》[4]。对比美国药典相关章节的内容,其指导思想基本一致。对于药品生产企业来说,以上指导原则的提出,为企业的药典分析方法确认提供了依据,企业不必再按照复杂、常规的分析方法对验证指标进行一一确认,只要确认操作人员有能力成功操作药典分析方法,即达到了分析方法确认的目的[5] 。但是,在实际执行过程中,根据指导原则的要求,企业明确药典分析方法的 确认指标可以少于分析方法验证的指标,而对于少到什么程度,指导原则中并未明确[6-7],而是需要根据实际情况进行评估,这也为药典分析方法的确认提出了挑战——如何能够正确地评估药典分析方法的确认指标。
2、现行的指导原则
对于药典分析方法确认指标评估的指导性文件相对较少,此类指导性文件一般都要求企业根据实际情况自行评估。典型的具有可操作性的指导性文件有欧洲药品质量控制实验室联盟(European Official Medicines Control Laboratories,OMCLs)发布的质量管理文件《分析方法验证与确认》[8] ,该文件于1999 年首次发布,最新版的更新日期为2020 年,该文件指出:药典各论中描述的分析方法应认为是已经经过验证的方法,因此只需要对分析方法的适用性进行确认,技术文件中详细地列出了不同检验类型以及方法确认需要执行的内容[9]。另一份具有实际指导意义的文件为美国农业部下属的美国分析化学家协会(AssociationofOfficialAnalyticalChemists,AOAC)2007 年发布的《如何达到ISO17025 对方法确认的要求》[10] ,该份指导原则中,一方面明确了分析方法确认指标的选择,另一方面给出了指标选择的理由,具有很好的指导意义。
美国药典委员会在 2022 年1 月份发布的USP<1220 >分析方法生命周期[11]引起了业界的广泛关注,但是该文件重点对分析方法开发作了比较详尽的阐述,对于分析方法确认并未提出新的建设性意见,文件中提到对于分析方法转移或者确认,其确认的程度应当基于分析目标(analyticaltargetprofile,ATP)和分析方法性能的风险评估,其本质还是基于风险评估来确定确认指标,并未明确、具体地对确认指标予以表述。
基于以上原则,药典方法都是经过验证的分析方法,无需进行全部指标的验证 [12],仅需实验人员在规定条件下能够重复操作,即可达到分析方法确认的目的 [13-14]。本文以上述指导性文件为基础,对分析方法确认指标的选择依据进行梳理与归纳,以期对药品生产企业在进行药典分析方法确认时,对于确认指标的选择,提供具有指导性的建议。
3、分析方法确认指标选择的适用范围
根据《中国药典》中《9101分析方法验证指导原则》[4]、《9099 分析方法确认指导原则》[4] 、 《 9100 分析方法转移指导原则》[4] 的指导思想, 分析方法确认适用于全部《中国药典》收载的分析方法,但不适用于“微生物分析方法的确认” 与“生物学测定方法的确认”。其原因在于对于 “微生物分析方法”与“生物学测定方法”存在更多的生物学方面的影响因素,因此,这类分析方法的验证、确认、转移不在指导原则的范围内,本文不对这类分析方法的确认指标进行论述。
4、药典中的通用检测方法
无论是美国药典还是《中国药典》,对于通用检测方法的规定比较明确,如果没有特别说明,这些通用检测方法无需确认。通用检测方法通常包括但不限于干燥失重、炽灼残渣、多种化 学湿法和简单的仪器测试(如 pH 值测定法)等。
由此可以看出,对于药典中的通用检测方法,指导思想还是非常明确的,即无需进行分析 方法确认。那么对于非通用检测方法,如“鉴别 检查”“低浓度定量 / 限度检查法”和“高浓度定 量 / 限度检查法”则需要进一步评估其确认指标,以开展分析方法的确认工作。
5、药典中的鉴别检查
鉴别检查是药典收载分析方法中最为常见的 一个检验项目,鉴别检查是根据药物组成、分子结构、理化性质,采用化学、物理或生物方法判断药物是否为“目标药物”[15] 。关于 AOAC 与 OMCLs 对药典方法鉴别检查确认指标的具体要求,AOAC 鉴别检查确认指标参见表 1 ,OMCLs 鉴别检查确认指标参见表2。


由此可以看出,鉴别试验的方法确认只需要确认其专属性。那么以2022 年发布的USP<1220 >分析方法生命周期的评估观点来看,仅确认其专属性是否违背其分析目标(ATP)呢?首先,对于分析方法验证来说,鉴别检查是需要对“专属性”和“耐用性”指标进行确认的,对于药典方法而言,其耐用性已经进行了充分的考虑。以利福平为例,在其紫外鉴别中,药典中明确规定了样品用量、溶剂用量、缓冲液pH值、最大吸收波长、最小吸收波长等参数,对于此类可能影响耐用性的测定条件,药典方法已经给予了充分考虑,规定了相关范围,因此,鉴别试验的方法确认不必对“耐用性”指标再次进行确认,仅确认其“专属性”,是符合USP<1220 >分析方法生命周期的评估观点的。
6、药典中的低浓度定量 / 限度检查法
对于药典方法中收载的限度、含量检查来说,大致可以分为两种情况:第一种情况为被测物浓度在定量限或检测限附近的检测,样品浓度较低;第二种情况为被测物浓度远高于定量限或检测限。低浓度定量 / 限度检查法这类检测中最为常见的一类就是残留溶剂检测法,各国药典附录中都收载有残留溶剂检测法。AOAC与 OMCLs 对低浓度定量 / 限度检查法确认指标作出了具体要求,AOAC低浓度定量 / 限度检查确认指标参见表 3 ,OMCLs 有关物质检查确认指标参见表4。
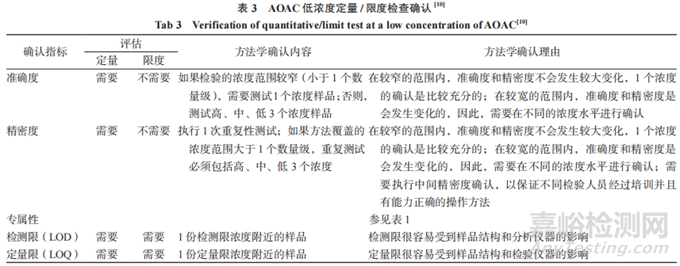

通过以上 AOAC与OMCLs对于定量/ 限度检查确认指标的对比可以看出,确认指标的要求是存在一定差异的。AOAC对于定量检测,确认指标包括“准确度”“精密度”“专属性”“检测限”“定量限”;对于限度检测,确认指标包括“专属性”“检测限”“定量限”。而OMCLs中对于有关物质检查仅要求“专属性”和“限度值”。其主要区别在于定量检测中是否需要对“准确度”“精密度”进行确认。而造成这种差异的本质原因是两份指导原则的分析方法分类差异造成的,AOAC是按照“低浓度检测”和“高浓度检测”进行的分类,而OMCLs是按照“有关物质检测”和“含量检测”进行的分类,并且药典中“有关物质检测”通常是采用“限度检测”方式,因此,OMCLs 在此处的规定相当于 AOAC 的“限度 检测”部分,而“定量检测”部分,归类在了“含量 检测”的确认部分。因此,本质上 AOAC 与 OMCLs 对于定量 / 限度检查确认指标的要求是一致的。
而对于“检测限”和“定量限”AOAC 的要求是 全部确认,这样规定可能会产生一些误解,因为对于“定量检测”其限度值定义为“定量限”;对于“限 度检测”其限度值定义为“检测限”,这里 OMCLs 定义为“限度值”是比较合理的。因此,此部分建议 按照《中国药典》的指导原则,对于“定量检测”只 确认“定量限”;对于“限度检测”只确认“检测限”。
7、药典中的高浓度定量 / 限度检查法
对于高浓度定量 / 限度检查法,其浓度相对 较高,而含量检查,大多数情况下与此种情况类似,因此,将OMCLs 对于含量检查方法的确认在本部分一并论述。AOAC 高浓度定量 / 限度检查确认指标参见表5 ,OMCLs 含量测定确认指标参见表 6。


AOAC 规定,此种情况需要对“专属性”“准确 度”和“精密度”三个指标进行确认,而 OMCLs 规 定除以上三个指标外,还需要进行“线性”指标的 确认。首先,对于浓度远高于“检测限”或“定量 限”的情况,其“检测限”或“定量限”的确定,基本是没有意义的。其次,“线性”指标是定量检测的一个确认指标(限度检测不涉及),由于分析方法 针对的是较高浓度的检测或含量检测,样品浓度相对较高,样品的浓度范围变化也相对较大,因此,对于此种情况“线性”指标的确认还是有必要的。
综上,高浓度定量/限度检查法(包括含量检 测)确认指标选择时,对于定量检测,包括“准确 度”“精密度”“专属性”“线性”;对于限度检测,包括“准确度”“精密度”“专属性”。
8、结论
分析方法确认是企业在使用药典分析方法时, 在实际使用条件下,为了确定方法的适用性所开展的确认工作。本文分别从“通用检测方法”“鉴别检查法”“低浓度定量/ 限度检查法”和“高浓度定量/ 限度检查法”四个方面对不同类型分析方法的确认指标进行了归纳、总结与论述,即“通用检测方法”无需确认;“鉴别检查法”需要确认专属性;“低浓度定量/ 限度检查法”的定量检测需要确认“准确性”“精密度”“专属性”“定量限”;“低浓度定量/ 限度检查法”的限度检测需要确认“专属性”“检测限”;“高浓度定量/限度检查法”的定量检测需要确认“准确度”“精密度”“专属性”“线性”;“高浓度定量 / 限度检查法”的限度检测需要 确认“准确度”“精密度”“专属性”。本文以行业内技术指导性文件的指导原则为基础进行评估与论述,以期为相关行业在分析方法确认工作中提供参考及借鉴。
参考文献
[1] ICH. Q7A Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients [S]. 2000.
[2] USP40-NF35 < 1226 > VERIFICATION OF ANALYTI- CAL PROCEDURES [M]. 2017 :1786-1787.
[3] USP40-NF35 < 1224 > TRANSFER OF ANALYTICAL PROCEDURES [M]. 2017 :1778-1780.
[4] 中国药典 2020 年版 . 四部 [S]. 2020 :478-480.
[5] 许明哲,黄宝斌,杨青云,等 . 分析方法验证、转移和确 认概念解析 [J]. 药物分析杂志,2015 ,35(1):168-175.
[6] 张艳丽,林玉梅,晁现民,等 . 分析方法验证、确认与转 移在药企中的应用探讨 [J]. 机电信息,2018(8):11-13.
[7] 吴耿锋,金泉泉,龚珊 . 化学原料药的分析方法验证、转 移与确认 [J]. 化工设计通讯,2020 ,46(3):245.
[8] PA/PH/OMCL(13)82 R5. Validation/Verification of Analyt- ical Procedures ,OMCL Network of the Council of Europe Quality Assurance Document [S]. 2020.
[9] 钟丽君,陈思,田军 . 分析方法确认的介绍和建议 [J]. 药 物分析杂志,2019 ,39(5):191-196.
[10] AOAC Guidance :How to Meet ISO 17025 Requirements for Method Verification ,Association of Official Analytical Chemists [S]. 2007.
[11] USP-NF New Chapter < 1220 > Analytical Life Cy- cle [M]. 2021. https ://www. uspnf. com/notice-gc-1220- prepost-20210924.
[12] 中国食品药品检定研究院 . 中国药品检验标准操作规 范 [M]. 北京:中国医药科技出版社, 2019 :728-744.
[13] 李娜,耿颖,谭德讲,等 . 分析方法确认和转移的评估标 准探讨 [J]. 药物分析杂志,2021 ,41(4):675-680.
[14] 孙红,梁毅 . 化学原料药的分析方法验证、转移及确认 [J]. 机电信息,2016(5):15-19.
[15] 许明哲,黄宝斌,杨青云,等 . 分析方法确认内容介 绍 [J]. 药物分析杂志,2015 ,35(1):191-197.

来源:Internet


