您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-12 17:36
医疗器械产品的设计开发控制程序,每个医械从业人员都不陌生,但讨论/扯皮从未断过,归根结底,我认为是团队/成员未对设计开发过程形成统一共识,包括但不限于职责、分工与权限,但毋庸置疑,设计开发控制程序是质量管理体系中一份至关重要的程序文件。
产品的设计与开发是保证其安全性、有效性和符合法规要求的关键环节。为了确保设计开发过程的规范化和高质量输出,必须依照严格的设计开发控制程序进行管理。
本文将结合项目管理的理念,再次谈一谈医疗器械产品设计开发控制程序的关键步骤与注意事项,期望能对部分医械从业人有些些理解上的帮助。
一、设计开发控制程序的必要性
医疗器械的设计开发控制程序是依据国际/国内的法规/标准(如ISO 13485、FDA的21 CFR 820、NMPA的GMP)要求而设立的(ps:虽然本质是一样的,但多少存在些差异,可以根据预期市场来编写,后面如果扩大市场再做叠加更新),它确保产品从概念到上市的每一个阶段都受到严密的监控和管理。
这一过程不仅可以提升产品质量、降低风险,还能够通过规范化的流程管理减少设计失误,从而提高市场准入的速度。(这是好处,似乎是套话,但不得不重提,事实是这样的)
(ps:未按/半按开发控制程序执行产品开发的产品,真的是又好、又快、又经济的吗?)
二、设计开发控制程序的主要步骤
结合项目的定义,医疗器械产品设计开发,是一个项目,而且是个大项目,但无论项目的大小,都可以按五大过程组的模型进行活动划分,在医疗器械的产品开发中,通常分为以下几个核心步骤(820,13485/42061,GMP中也有提到),但注意,以下步骤部分并非是递进关系:
1.设计和开发规划(立项前的活动不在此文讨论)-可以作为一个大阶段P-策划
在项目初期,必须制定一个详尽的设计开发计划。这包括明确项目的目标、时间表、资源分配和责任划分。规划需要考虑以下要素:
项目目标:产品的功能、性能及其预期用途。
关键里程碑:划分设计阶段,设置检查和审评节点。
资源管理:明确项目所需的人力、物力资源以及外部合作需求。
风险管理:识别潜在的设计和开发风险,制定风险缓解策略。
2.设计输入-可以作为一个大阶段P-开发
设计输入是产品设计的基础,它定义了产品必须满足的所有要求。这些要求来源于以下几个方面:
法规要求:产品必须符合目标市场的法规要求。
用户需求:产品需要满足最终用户的功能需求。
性能标准:包括物理特性、生物相容性、电磁兼容性等方面的技术指标。
设计输入的准确性和完整性至关重要,它直接决定了后续设计工作的方向。
上述可统称为用户需求,内部的,外部的。
3.设计输出-可以作为一个大阶段P-开发
设计输出是指与设计输入相对应的产品图纸、技术文件、规格说明等。这些文档必须经过充分验证,以确保它们可以准确地转化为最终的产品。通常,设计输出包括:
设计图纸和技术文件:确保生产和质量控制团队能够依据这些文件制造产品。
测试规范:设计输出文件中应包含产品的测试要求和验证方案。
生产工艺流程:确保设计成果能够在生产过程中实现。
4.设计评审-不作为大阶段,评审活动也就1天2天会议就能完成
设计评审是贯穿设计开发各个阶段的重要活动,它由跨部门的专家团队进行审核,目的是确保设计符合预期要求。设计评审的主要目标包括:
确认设计输入是否合理、完整;
检查设计输出是否符合设计输入要求;
识别潜在的设计缺陷和风险,提出改进建议。
定期设计评审可以有效降低设计错误,避免后期的返工和修改。
5.设计验证-可以作为一个大阶段P-验证
设计验证是确保设计输出符合设计输入要求的关键步骤。通过测试和实验,验证产品是否符合规定的功能、性能和法规要求。常见的验证手段包括:
实验室测试:验证产品是否达到设计规定的技术参数。
用户模拟测试:让目标用户在模拟环境中测试产品,确认其符合用户需求。
法规符合性评估:确保产品符合市场准入的法规要求。
6.设计确认-可以作为一个大阶段P-确认
设计确认旨在确保最终产品能够满足预期用途和用户需求。与设计验证不同,设计确认更侧重于从最终用户角度评估产品的适用性和安全性。设计确认通常包括:
临床试验:在目标用户群体中测试产品的有效性和安全性。
市场反馈收集:通过早期用户测试收集实际使用反馈,验证产品的设计是否满足市场需求。
7.设计变更控制-不作为大阶段
在产品开发过程中,设计变更是不可避免的,设计变更控制程序确保所有的变更都经过合理评估和批准。设计变更可能源自于法规变化、用户反馈或设计优化等原因。关键步骤包括:
变更申请:记录变更的原因和影响范围。
变更评估:跨部门团队对变更的可行性、风险和成本进行评估。
变更验证与确认:确保变更不会引入新的风险,并且符合设计输入要求。
8.产品上市-可以作为一个大阶段P-注册
完成上述大阶段的活动,就可以准备产品的注册了,注册活动,根据目标市场的法规要求进行注册文件的整理,并递交就可以了。
但为什么会存在发补行为,我觉得根本原因可以归类到“范进成”黄金三角的平衡中去,具体不展开了。
获证后,可能需要变更或申请生产许可,变更一些已备案的文件如标签,之后就是正常的生产销售以及上市后的产品风险管理了。
上述活动,也可用一张瀑布流模型图(出至于FDA的DC指南)来概括
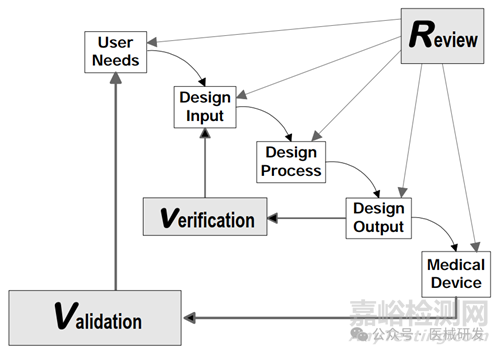
三、如何通过项目管理优化设计开发过程
项目管理的核心理念——时间、成本、质量的平衡,对于确保项目按时、按预算、高质量地完成至关重要。
以下是几种项目管理工具在设计开发控制中的具体应用:
甘特图:帮助项目经理直观地管理项目进度,确保每个阶段按时完成。-各种活动的计划表,但往往是延期的,笑CRY。
风险矩阵:识别并管理设计开发过程中的潜在风险。-跨职能团队的活动
跨职能团队:确保设计、质量、法规、生产等部门的协作和信息共享,从而提高项目成功率。-可以理解成项目研发的全景图,以项目为对象,需要经历哪些活动,在什么时间什么人员介入。
四、结束语
医疗器械产品设计开发控制程序是一个复杂而又系统化的过程,需要在产品的全生命周期中通过严密的规划、评估、验证与确认来确保产品的安全性和合规性。通过科学的项目管理方法,可以有效提升设计开发的效率,减少潜在风险,并确保产品能够顺利进入市场。
在当前行业背景下,我们更应重视设计开发控制程序的执行,严格按照标准进行设计开发活动,为患者和市场提供安全、有效的产品。

来源:医械研发


