您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-23 08:51
前言
随着生物医药行业的快速发展,越来越多的多肽药物被开发用于治疗各种疾病。但是由于多肽口服生物利用度差需要注射给药,会降低患者的依从性,尤其对于需要长期治疗的疾病。口服给药是较为理想的给药方式,但多肽药物在胃肠道稳定性差、分子量大、难以透过肠道上皮等特点均限制了其开发口服制剂。随着对多肽口服吸收机理的深入了解,科学家开发的技术手段打破了多肽胃肠道吸收的壁垒,一些口服多肽药物已经成功上市。
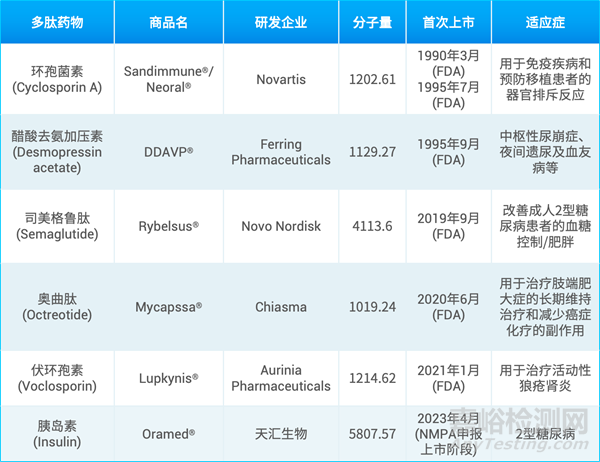
下表1总结了已上市吸收入血的口服多肽药物,数量仍然比较有限。环孢菌素为分子量1202.61的环肽,是第一个上市的口服多肽药物。但是环孢菌素本身的分子量较小,环肽的结构也增加了稳定性。环孢菌素上市之后多年,口服多肽药物一直没有取得显著性进展。直到2019年口服司美格鲁肽上市,采用促渗透剂SNAC增加多肽的胃肠道吸收,为口服多肽的研发开辟了新的路径。口服胰岛素的开发可谓历史悠久,这一构想始于1922年[1]。但直到2023年,全球首款口服胰岛素肠溶胶囊Oramed才在中国申报上市。
表1. 已上市吸收入血的口服多肽药物
1、提高多肽口服吸收的策略
多肽药物想要达到理想的口服吸收,往往需要多维度的助力。
结构优化:针对多肽链的结构修饰,防止多肽在胃肠道水解,提高多肽的胃肠道稳定性;提高多肽的体内代谢稳定性,延长生物半衰期。
促渗透剂:通过促渗透剂改变胃肠道上皮的紧密连接,提高渗透性,也是目前口服多肽的常用策略。常见的促渗透剂包括表面活性剂癸酸钠、辛酸钠,螯合剂EDTA、柠檬酸等。
制剂手段:比如自乳化制剂,通过提高难溶性药物在胃肠道的溶解度,促进吸收;肠溶胶囊可避免多肽药物在胃部释放,减少胃内降解等。
pH调节剂:胃肠道的酶活性与pH值息息相关,pH调节剂可通过改变胃肠道局部的pH值,影响酶的活性,减少多肽在胃肠道的降解。
2、研究口服多肽胃肠道吸收的评估体系
对于口服多肽的早期筛选评价,需要确认多肽能否通过口服吸收,以及影响多肽口服吸收的主要因素,并进行有针对性地优化,以提高多肽的口服生物利用度。本文主要关注胃肠道对多肽吸收的影响,因此主要介绍胃肠道吸收相关的体外和体内研究体系。
1、体外胃肠液稳定性
胃肠道中含有大量的蛋白水解酶,可使多肽在胃肠道产生降解。所以多肽在胃肠液中的稳定性是影响口服吸收的第一道屏障。Wang等人[2]研究了17种肽类药物在胃肠道的稳定性,结果表明在人胃液中,分子量较小的肽表现出良好的稳定性;在人小肠液中,环状的肽具有相对较好的稳定性。根据模拟胃肠液稳定性的结果,可有针对性地设计多肽在特定部位吸收,或优化多肽的结构来提高胃肠道中的稳定性。
2、体外细胞模型
Caco-2被认为是体外评估肠道渗透性的金标准。Caroline等人[3]采用Caco-2细胞,评估SNAC和癸酸钠(C10)的促渗透作用以及促渗透的机理。结果显示(见图1),C10可降低Caco-2细胞单层膜的跨膜电阻(TEER),并在8.5 mM和10 mM浓度下显著增加了荧光探针FITC-4000(荧光素异硫氰酸酯-葡聚糖)的渗透性。而SNAC除了在40 mM浓度下对TEER 和FITC-4000的渗透性产生显著影响,其他浓度下对这两个参数都没有影响。相关机理研究显示,C10可引起Caco-2细胞中三种紧密连接蛋白(claudin-5, ZO-1和occludin)的重组,而SNAC只影响了claudin-5的定位。因此,根据研究目的可选择Caco-2评价促渗透剂对多肽渗透性的影响。也有文献报道人工生物膜PAMPA也可用于多肽的体外渗透评价[4]。但如果评价促渗透剂的作用,根据其作用机理,建议选择Caco-2细胞模型而非人工生物膜用于评价。
针对多肽类等低渗透性化合物,药明康德DMPK部门开发并验证了过夜预孵育方法,通过将测试化合物与细胞预孵育20小时以上,再加入测试化合物进行双向渗透试验,来评估化合物的渗透性。此方法在细胞预饱和的基础上,能够有效测得化合物的渗透性,也可用来筛选不同促渗透剂的促渗作用。
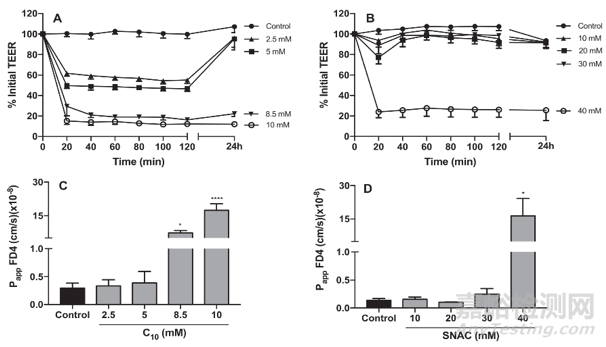
图1. C10(左图A和C)和SNAC(右图B和D)对Caco-2细胞单层膜的影响[3]
NCI-N87是从一名男性胃癌患者的胃中分离出的具有上皮形态的细胞系[5],很少用于肠道渗透性评价。但是由于口服司美格鲁肽的相关机理研究发现,其吸收部位主要是胃。因此研究者采用NCI-N87细胞单层进行体外渗透研究。结果显示在20 mM至80 mM的SNAC浓度范围内,司美格鲁肽的Papp值随着SNAC的浓度增加而增加,见图2。NCI-N87细胞摄取试验结果也显示,SNAC可提高司美格鲁肽的细胞内摄取。
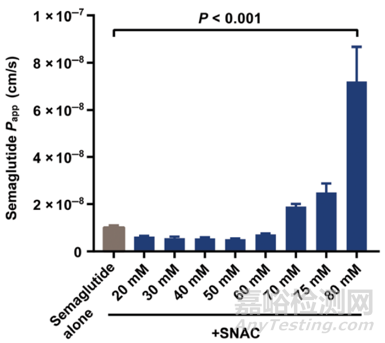
图2. NCI-N87单层细胞中不同SNAC浓度对司美格鲁肽体外渗透系数Papp值的影响[5]
3、尤斯灌流(Ussing chamber)模型
Ussing chamber模型可以在体外研究特定肠段的渗透,且为了排除浆膜层和肌肉层对药物渗透的影响,可对肠段进行剥膜处理仅保留粘膜层。药物的吸收过程发生在粘膜表面,而浆膜层和肌肉层对于渗透性本身较差的化合物可能产生不利影响。在多肽的渗透性研究中,经常会用到多种促渗透剂,高浓度的促渗透剂可能影响肠道活性。Ussing chamber模型可通过检测电生理参数,对肠道活性进行监测。此外,与肠灌流或肠外翻实验相比,Ussing chamber模型操作简单,具有更高的通量。Ussing chamber模型比较适合评价口服多肽的体外渗透性。
Stephen等人[6]采用Ussing chamber模型,研究SNAC对司美格鲁肽在大鼠胃黏膜的渗透性影响。大鼠胃黏膜在SNAC中持续暴露10分钟,接着移走SNAC,分别在10分钟,30分钟和60分钟加入司美格鲁肽。结果显示,司美格鲁肽的渗透性在10分钟加入时最高,30分钟和60分钟加入时已经恢复到基线水平,见图3。说明SNAC的促渗透作用是短暂的。
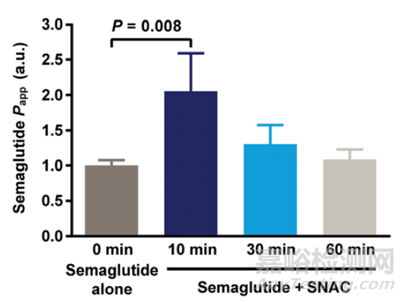
图3. 大鼠胃黏膜中SNAC对司美格鲁肽的渗透性影响[6]
Sarinj等人[7]采用Ussing chamber模型,研究SNAC增强奥曲肽在大鼠和人肠上皮粘膜的渗透性,见图4。研究结果显示,添加20 mM SNAC可增加奥曲肽在大鼠不同肠段上皮粘膜的通透性,Papp分别为:结肠(增加3.2倍)>回肠(3.4倍)>空肠(2.3倍)>十二指肠(1.4倍)>胃(1.4倍)。添加20 mM或40 mM SNAC也能增加奥曲肽在人结肠粘膜的通透性,Papp分别增加了1.5倍和2.1倍。添加SNAC后,特别是在结肠区域,跨膜电阻(TEER)值降低。该结果显示出SNAC可作为奥曲肽的肠渗透促进剂。
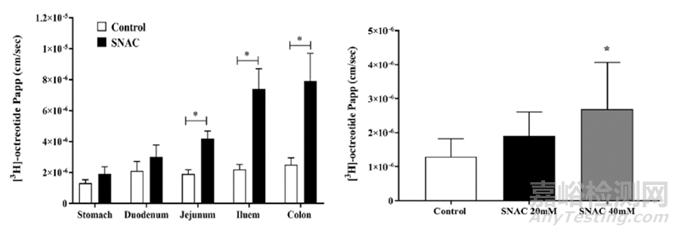
图4. 奥曲肽在大鼠各肠段(左图)和人结肠(右图)上皮粘膜的渗透性[7]
Foger等人[8]采用Caco-2单层细胞模型和Ussing chamber的肠粘膜模型,评价可溶性多肽的体外渗透性,并与体内进行比较。结果显示,Ussing chamber的肠粘膜模型测得的Papp值与体内生物利用度具有非常好的相关性(R2=0.81),Caco-2模型测得的Papp值与体内生物利用度的相关性较差(R2=0.48)。
4、体内PK研究
口服多肽的体内PK研究方面,需要选择相关动物种属进行药代研究,且考虑到体内吸收较差,血药浓度较低,对于分析检测灵敏度也具有更高的要求,有能力的情况建议做到pg/mL级别。另外还需要关注是否需要禁食,多肽在肠道的吸收部位,以及促渗透剂的剂量设计等问题。
食物影响:口服司美格鲁肽的体内药代研究发现,食物的存在会影响口服多肽的吸收,空腹状态下生物利用度更高。因此口服多肽的PK研究,推荐在空腹条件下进行[6]。
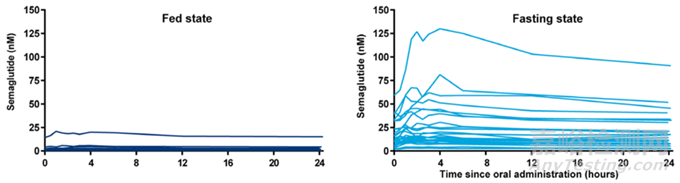
图5. 健康受试者在餐后和空腹条件下口服司美格鲁肽的血药浓度时间曲线[9]
吸收部位:在胃肠道中,小肠具有最大的表面积,且小肠膜也比胃的更易穿透,因此大多数药物主要在小肠吸收。但是研究发现胃也可能是口服多肽的主要吸收部位。口服司美格鲁肽在幽门结扎和非结扎的犬中吸收是相当的,且在犬脾静脉中的血药浓度大大高于肝门静脉,说明口服司美格鲁肽的主要吸收部位是胃而不是小肠[6]。另外,在肠道中通过淋巴系统吸收来提高治疗性多肽的口服生物利用度的效果是非常有限的。
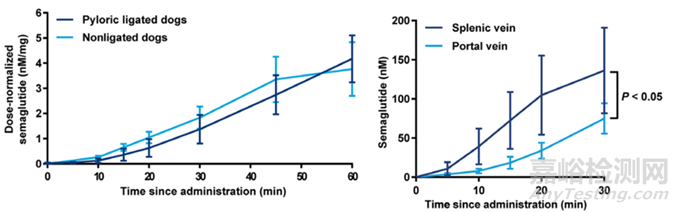
图6. 口服司美格鲁肽在幽门结扎和不结扎的Beagle犬中吸收曲线(左图)和口服司美格鲁肽在犬脾静脉和肝门静脉中的吸收曲线(右图)[6]
促渗透剂:人体内给予5 mg的司美格鲁肽,分别合用150 mg,300 mg或600 mg的促渗透剂SNAC,结果显示合用300 mg SNAC的司美格鲁肽血浆暴露量最高。过高剂量的SNAC可能产生盐析作用,反而不利于多肽的口服吸收[6]。此外,同样的促渗透剂对不同的多肽可能具有不同的作用。比如在大鼠体内,SNAC可以促进司美格鲁肽的口服吸收,但是却不能促进利拉鲁肽的口服吸收。而促渗剂也可促进淋巴吸收,在前期公众号文章“大鼠肠系膜淋巴管插管模型验证渗透促进剂SNAC对淋巴吸收的影响”中已有详细介绍。
结语
本文从口服多肽的研究目的着手,介绍了用于评价多肽药物胃肠道吸收的研究方法和数据解读。口服多肽的吸收较差,血药浓度较低,一般需要非常高的检测灵敏度。药明康德DMPK在口服多肽的药代动力学研究方面积累了丰富的经验,可开发具备高选择性、高灵敏度和宽线性范围的多肽生物分析方法。在体外Caco-2细胞模型上,已经完成数百个多肽化合物的体外渗透性评价。Ussing chamber模型是比较推荐的针对口服多肽的体外研究模型,药明康德DMPK部门已经建立了Ussing chamber模型用于体外渗透性评价,尤其在肠道剥膜技术和肠粘膜的质量把控方面积累了丰富的经验。借助多种不同类型的针对口服多肽胃肠道吸收的评价体系,我们希望可以助力口服多肽的早期研发。
参考文献:
[1] Zhu Q, Chen Z, Paul PK, Lu Y, Wu W, Qi J. Oral delivery of proteins and peptides: Challenges, status quo and future perspectives. Acta Pharm Sin B. 2021 Aug;11(8):2416-2448. doi: 10.1016/j.apsb.2021.04.001. Epub 2021 Apr 29. PMID: 34522593; PMCID: PMC8424290.
[2] Wang J, Yadav V, Smart AL, Tajiri S, Basit AW. Toward oral delivery of biopharmaceuticals: an assessment of the gastrointestinal stability of 17 peptide drugs. Mol Pharm. 2015 Mar 2;12(3):966-73. doi: 10.1021/mp500809f. Epub 2015 Feb 10. PMID: 25612507.
[3] Caroline Twarog, Kai Liu, Peter J. O'Brien, Kenneth A. Dawson, Elias Fattal, Brigitte Illel, David J. Brayden, A head-to-head Caco-2 assay comparison of the mechanisms of action of the intestinal permeation enhancers: SNAC and sodium caprate (C10), European Journal of Pharmaceutics and Biopharmaceutics, Volume 152, 2020, Pages 95-107, ISSN 0939-6411, https://doi.org/10.1016/j.ejpb.2020.04.023.
[4] Merz, M.L., Habeshian, S., Li, B. et al. De novo development of small cyclic peptides that are orally bioavailable. Nat Chem Biol 20, 624–633 (2024). https://doi.org/10.1038/s41589-023-01496-y.
[5] Kalra S, Sahay R. A Review on Semaglutide: An Oral Glucagon-Like Peptide 1 Receptor Agonist in Management of Type 2 Diabetes Mellitus. Diabetes Ther. 2020 Sep;11(9):1965-1982. doi: 10.1007/s13300-020-00894-y. Epub 2020 Jul 28. PMID: 32725484; PMCID: PMC7434819.
[6] Buckley ST, Bækdal TA, Vegge A, Maarbjerg SJ, Pyke C, Ahnfelt-Rønne J, Madsen KG, Schéele SG, Alanentalo T, Kirk RK, Pedersen BL, Skyggebjerg RB, Benie AJ, Strauss HM, Wahlund PO, Bjerregaard S, Farkas E, Fekete C, Søndergaard FL, Borregaard J, Hartoft-Nielsen ML, Knudsen LB. Transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist. Sci Transl Med. 2018 Nov 14;10(467):eaar7047. doi: 10.1126/scitranslmed.aar7047. PMID: 30429357.
[7] Sarinj Fattah, Mohamed Ismaiel, Brenda Murphy, Aleksandra Rulikowska, Jesus M. Frias, Desmond C. Winter, David J. Brayden, Salcaprozate sodium (SNAC) enhances permeability of octreotide across isolated rat and human intestinal epithelial mucosae in Ussing chambers, European Journal of Pharmaceutical Sciences, Volume 154, 2020, 105509, ISSN 0928-0987, https://doi.org/10.1016/j.ejps.2020.105509.
[8] Föger F, Kopf A, Loretz B, Albrecht K, Bernkop-Schnürch A. Correlation of in vitro and in vivo models for the oral absorption of peptide drugs. Amino Acids. 2008 Jun;35(1):233-41. doi: 10.1007/s00726-007-0581-5. Epub 2007 Aug 30. PMID: 17726639.

来源:药明康德DMPK


