您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-25 09:18
1.容器密封完整性container closure integrity
包装系统密封性(package integrity),又称容器密封完整性(container–closure integrity,CCI),是指包装系统防止内容物损失、微生物侵入以及气体(氧气、空气、水蒸气等)或其他物质进入,保证药品持续符合安全与质量要求的能力。包装系统密封性检查(package integrity test),或称为容器密封完整性检查(container–closure integrity test, CCIT),是指检测任何破裂或缝隙的包装泄漏检测(包括理化或微生物检测方法),一些检测可以确定泄漏的尺寸和/或位置。

图:西林瓶包装系统
2.法规及指导原则
常见法规及指导原则如下:
EU GMP Annex 1
USP <1207> Package integrity evaluation-sterile products
USP <1207.1> Package Integrity Testing in the Product Life Cycle—Test Method Selection and Validation
USP <1207.2> Package Integrity Leak Test Technologies
USP <1207.3> Package Seal Quality Test Technologies
GMP实施指南2023
化学药品注射剂包装系统密封性研究技术指南
无菌药品包装系统密封性指导原则公示稿(第二次)
3.容器密封完整性开发
3.1 CCS开发
在开发过程中,应选用选择适合药品的 CCS。开发团队确定 CCS 组件如何共同实现 CCI,以及组件的哪些方面有助于药品制造、运输和储存的密封性。这分三个连续阶段实现(见图 1),并得到开发数据的支持。

图 :开发阶段
3.2 质量目标产品属性 (Quality Target Product Profile,QTPP) 和 CCS 选择
定义 QTPP 通常是药物产品开发的第一步。考虑选择合适的 CCS 和定义在哪些条件下需要确保 CCI 的关键输入。以下方面直接影响 CCI:
保质期,
高压high-stress制造工艺(例如终端灭菌),
存储、装运和配送环境,
药品与组合产品相结合(额外监管框架)。
其他方面间接影响整体 CCI 方法的开发。例如,如果需要阻隔涂层来减少可浸出物,开发团队需要评估橡胶密封件和容器之间减少接触的影响。
3.3 最大允许泄漏限值 (Maximum Allowable Leakage Limit,MALL)
MALL 是给定产品包装可容忍的最大泄漏率,不会对产品安全造成风险,也不会对产品质量造成影响(或影响不大)。具体而言,CCI 损失可能会产生以下影响:
微生物进入CCS,导致产品无菌失效,
产品剂量溢出或外部液体或固体物质进入,导致产品理化质量属性失效,
气体顶部空间含量的变化,导致产品理化质量属性的失败,
顶部空间真空的变化,导致最终用户无法获取产品
需要考虑产品的 QTPP,正式评估CCI 损失的严重程度。
3.4 初始 CCS 特性
初始 CCS 特性分析的重点是确定可能影响系统在不同条件下稳定性的技术方面。通常,这是通过纸面分析、计算机模型和探索性测试来实现的。探索性测试的样本量由工程师自行决定,并应在此阶段根据需要进行调整。此阶段的目标是了解组件如何密封容器,特别是通过识别密封表面。
3.5 供应商知识和控制
一旦通过初始 CCS 特性确定了缺陷和尺寸要求,就应与潜在供应商一起审查缺陷和尺寸要求,以确保他们能够满足规定的要求。这些组件要求和其他期望应记录在组件规范或供应商质量协议中。
3.6 风险评估
风险评估是 CCS 开发的一部分。此操作不仅限于 CCI,还将 CCI 相关风险与QTPP 得出的其他基本要求相结合。关于 CCI,风险评估结合了从初始特性描述中学习到的知识和 QTPP 中提到的条件。风险评估可以考虑以下方面:
材料,
供应商生产流程,
最终密封流程,
ICH Q9:质量风险管理原则。
3.7 扩展特性
为确保开发方案的全面性,所有已识别的风险都应通过特性研究来支持,以更好地了解流程并制定适当的控制策略。扩展的特性数据直接支持风险评估评级。需要合理的实验设计和适当的样本量。
3.8 平台方法
只要药品不影响容器的完整性和/或功能性,就可以考虑采用空或充满水的 CCS 平台方法进行所有开发测试。众所周知,高 pH 值、保存的配方或冷冻产品可能会产生额外的风险。此种产品可能会在项目生命周期的后期考虑,这可能会影响方法的选择。
3.9 组合产品Combination Products设计验证
对于用于组合产品的 CCS,扩展特性分析工作将作为设计验证活动的一部分进行。只要有可能,根据质量源于设计而开展的开发活动就应考虑利用整体控制策略。如果所谓质量源于设计的活动没有考虑到设计控制过程的需求时,就会变得很有挑战性了。
3.10 组件制造与控制
考虑组件制造和加工对整体 CCI 的影响。图 2 是一棵决策树,有助于定义关键材料属性 (critical material attributes,CMA) 和供应商控制策略。
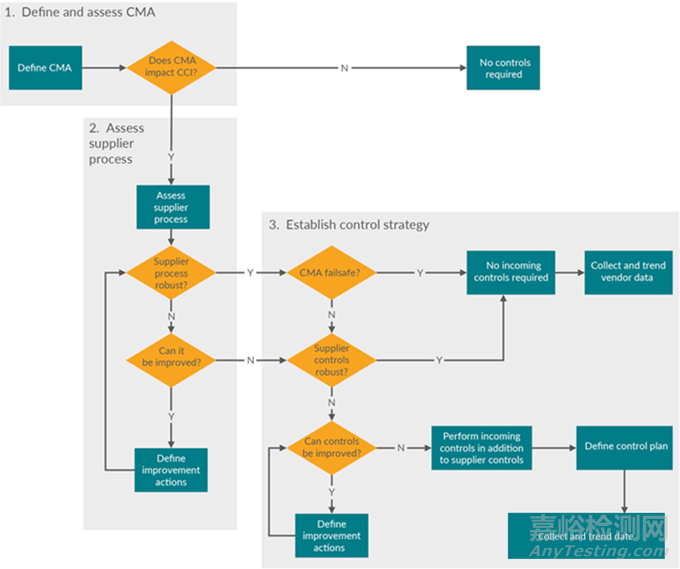
图 :选择组件制造监督级别的决策树
3.11 定义 CMA 以评估 CCS 关键属性
风险评估的输出确定了需要维护和控制的 CMA。这些可用于评估供应商流程如何影响 CMA。与所有制造流程一样,初级包装组件的生产也存在变化,可能会导致组件不适合使用。因此,了解初级包装组件供应商流程及其操作范围至关重要,以确保在组件制造和供应商放行期间实施适当的预防和控制。
3.12 评估供应商工艺——组件制造过程中供应商的预防和控制
CMA 允许在评估供应商制造工艺是否存在潜在危害时制定控制策略。这是为了在供应商放行和生物制药制造商随后验收时保持适当的组件质量。如果 CMA 在设计上不符合规范的可能性较低,则可将其视为一种安全措施。
3.13 制定控制策略
基于对主要包装组件供应商制造过程的全面分析,可以制定和实施全面组件控制策略。这可以基于确认供应商质量体系充分,并采取预防和控制措施和/或生物制药制造商组件发布规范中要求的额外测试。对供应商过程故障模式和影响分析(pFMEA) 文件的审查应深入了解现有控制计划的基础以及计划持续改进的程度,以提高过程稳健性。
3.14 验证
根据相关法规指导,工艺验证 (PV) 在产品生命周期内分为三个阶段:工艺设计 (第 1 阶段)、工艺效果确认 (第 2 阶段) 和持续工艺验证 (第 3 阶段)。PV/工艺性能效果确认 (PPQ) 意味着收集和评估数据,以建立科学证据,证明工艺能够持续提供预定质量的产品。
CCI 的综合性方法与上述做法一致。如果将其应用于 CCI,初始工艺设计(第 1 阶段)将涉及初始 CCS 开发和组件装配工艺的认证,包括可加工性或工程运行以定义制造工艺。
3.15 组件评估
了解 CCI 中的组件变异性和 CMA知识是 CCS 开发的关键输出,可用于定义规范并实施围绕主要容器输入的控制。这些是全面 CCI 验证策略的重要元素,应在进行 PV/PPQ 之前定义。组件确效的目的是评估组件制造过程中的常规验证对 CCI 的影响有多大。
3.16 用于确保 CCI 和控制的CPPs
在 PV/PPQ 之前,应确定将单个包装组件转换为完全组装的 CCS 所涉及的关键工艺步骤。这些工艺步骤可以作为组件准备的一部分或在灌装/密封期间执行。确定工艺步骤后,建议在 PV/PPQ 之前对整个 CCS 组装工艺进行确效,以证明每个工艺步骤中涉及的工艺目标、设备设定点和操作范围可以可靠地生产出满足其关键质量属性的完整 CCS。我们建议这些确效研究涉及挑战参数操作范围的上限和下限,以评估对 CCI 的影响。
3.17 在 PV/PPQ 期间确认CCI 的建议
总体而言,PV/PPQ 的目标是确认控制策略的有效性,并且预期的 CCI 验证所输出的信息是科学证据,证明 CCS 在商业制造过程中组装时将满足关键质量属性。
与包装组件输入、设备和工艺参数相关的控制源自成功完成的效果确认活动,并且在进行PV/PPQ 之前就已经到位。
最终,PV/PPQ 应该通过所选的包装组件输入和商业制造过程证明 CCI,充分模拟工艺负载压力以确认控制策略的有效性/稳健性。
成功的无菌工艺模拟APS的结果可以作为CCI 性能的额外证明,而无需进行微生物侵入测试。
PPQ 批次通常用于确认先前研究中所开展的保质期评估。
3.18 常规制造
制造过程对于创建和维护 CCI 至关重要。经过深思熟虑并实施的综合控制策略将消除制造过程可能对 CCI 产生不利影响的风险。从整体上看,良好的制造控制策略最常见的步骤是精心设计的预防措施。如果预防措施本身不能消除 CCI 的所有风险源,则应辅以良好的过程控制。任何制造后测试都只能作为制造过程受控的高阶确认,但制造后测试不能证明产品质量良好。
3.19 运输和稳定性
在药品整体 CCI 方法下,影响CCI 的大多数因素都已纳入 CCS 的开发以及稳健的产品制造工艺中。这种方法的另一个要素是在整个产品保质期内直至使用时证明 CCI,以证明无菌产品没有微生物污染。一旦确定了最终的包装配置,运输/装运研究通常会在产品开发过程中作为提交的一部分一次性执行。
3.20 持续监控整体 CCI 战略
以上内容概述了如何制定全面的整体战略以确保 CCS 的 CCI。这项工作不应被视为一次性活动;建立健全的监测和持续改进流程同样重要。建议的做法是确保将技术考虑因素纳入药品质量管理体系。
4.容器密封性测试方法
容器密封性测试应考虑包装的类型、预期控制要求,根据药品自身特点、生产工艺和药品生命周期的不同阶段,结合检查方法的灵敏度和适用性等,基于风险评估,选择适宜的密封性检查方法。
密封性检查方法分为确定性方法和概率性方法两大类。下面列举了常用的密封性检查方法供参考:
4.1 概率性方法
微生物挑战法(浸入或气溶胶法)
适用范围:包装必须能够承受浸没条件,可能需要工具限制软包膨胀或移动,且可用于培养基灌装;常用于包装密封性验证。
文献报道检测限级别:4级(气体泄漏率:>3.6 × 10-3 ~ 1.4 × 10-2std·cm3/s,泄漏孔径尺寸:> 5.0 ~ 10.0μm)
方法类型:定量
色水法
适用范围:必须能承受浸没,可能需要工具限制软包膨胀或移动。主要适用于液体制剂。
文献报道检测限级别:4级(气体泄漏率:>3.6 × 10-3 ~ 1.4 × 10-2std·cm3/s,泄漏孔径尺寸:> 5.0 ~ 10.0μm)
方法类型:定性或定量
气泡释放法
适用范围:具有顶空气,必须能够承受浸没,体积较小,小于几升的包装。
文献报道检测限级别:4级(气体泄漏率:>3.6 × 10-3 ~ 1.4 × 10-2std·cm3/s,泄漏孔径尺寸:> 5.0 ~ 10.0μm)
方法类型:定性
4.2 确定性方法
高压放电法
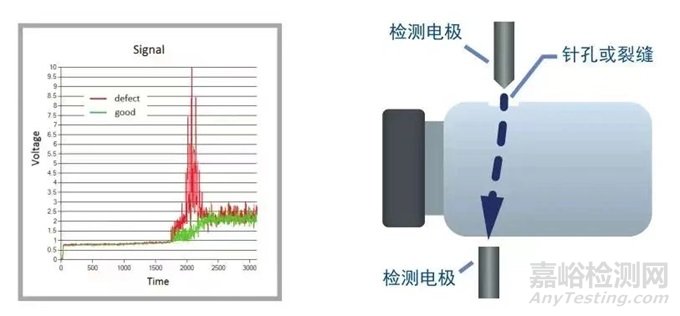
图:高压放电测试原理
适用范围:产品具有一定导电性,而包装组件相对不导电,且产品不易燃。
文献报道检测限级别:3级(气体泄漏率:>1.4 × 10-4 ~ 3.6 × 10-3td·cm3/s,泄漏孔径尺寸:> 1.0 ~ 5.0μm)
方法类型:定量
激光顶空分析法
适用范围:透明包装:需要低氧或低二氧化碳顶空含量的产品;需要低水汽含量的产品;内部包装压力低的产品。
文献报道检测限级别:1级(气体泄漏率:<1.4 × 10-6std·cm3/s,泄漏孔径尺寸:< 0.1μm)
方法类型:定量
质量提取法
适用范围:具有顶空气或充有液体的包装。
文献报道检测限级别:3级(气体泄漏率:>1.4 × 10-4 ~ 3.6 × 10-3td·cm3/s,泄漏孔径尺寸:> 1.0 ~ 5.0μm)
方法类型:定量
压力衰减法
适用范围:具有顶空气包装。
文献报道检测限级别:3级(气体泄漏率:>1.4 × 10-4 ~ 3.6 × 10-3td·cm3/s,泄漏孔径尺寸:> 1.0 ~ 5.0μm)
方法类型:定量
真空衰减法
适用范围:具有顶空气或充有液体的包装。
文献报道检测限级别:3级(气体泄漏率:>1.4 × 10-4 ~ 3.6 × 10-3td·cm3/s,泄漏孔径尺寸:> 1.0 ~ 5.0μm)
方法类型:定量
密封性检查方法优选能检测出产品最大允许泄漏限度的确定性方法,并对方法的灵敏度等进行验证。如方法灵敏度无法达到产品最大允许泄漏限度水平或产品最大允许泄漏限度不明确,建议至少采用两种方法(其中一种推荐微生物挑战法)进行密封性研究,对两种方法的灵敏度进行比较研究。微生物挑战法建立时需关注微生物的种类、菌液浓度、培养基种类和暴露时间等。
容器密封性测试确定性和概率性两种检测方法,各有优缺点也各有适用性范围,法规对此没有做出“必须”性的要求(note:法规中的“建议”一般就是指代强制性,若挑战“建议”需进行充分的研究,告知合理性)。同时,从国内及国外指导原则中不难看出,监管均强烈推荐确定性测试方法,主要考量如下:
确定性方法在定量连续体上提供受控输入和测量输出,从而为测量提供高水平的保证。定量测量允许校准、控制、显著性和回归计算以及更高级的推论。评估不在定量连续体上的数据会降低该数据的任何分析工具的有效性和能力。
确定性方法大多数都是非破坏性的。若测试方法具有破坏性,则无法在特定样品上重复或验证。如果测试从根本上改变了样品,则无法进一步考察该样品以及与其相关的质量性能问题。且任何质量控制测试都应用于提高产品质量,而不只是用于批次放行。虽然不禁止使用概率方法,但使用非破坏性的确定性方法的好处是显而易见的。确定性方法提供应用任何整体 CCI 方法所需的控制和保证水平。
参考文献:
【1】《化学药品注射剂包装系统密封性研究技术指南(试行)》
【2】https://mp.weixin.qq.com/s/FWsyKCIquJlot_oj_rd6SA
【3】A Holistic Approach To Container Closure Integrity

来源:Internet


