您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-10-27 17:59
摘 要
Abstract
近年来,我国医疗器械产业高速发展,数字化转型成为推动产业高质量发展的重要手段,产业数字化水平不断提升。产业数字化的快速发展推动了监管数字化的发展,为提升监管效能提供了新思路。目前,我国已有多个地区开展了智慧监管试点工作,并取得初步成效。与此同时,产业数字化面临企业数字化转型成本高,不同规模企业的数字化转型进程差距大,产业数字化推进难等问题;监管数字化面临缺乏有效规划和统一设计,系统、平台重复建设,协同监管效能低等问题。本文围绕医疗器械生产环节数字化转型和监管数字化,探索了生产企业和监管部门的数字化转型技术方案并提出建议,以期为推动医疗器械生产环节数字化、监管数字化转型提供思路。
In recent years, China’s medical device industry has been developing rapidly, with digital transformation emerging as an important means to promote high-quality development. The level of digitalization in the industry has steadily improved, and the swift progress of industrial digitalization has accelerated the development of digital supervision, offering new approaches to enhance supervisory efficiency. Several regions in China have initiated pilot programs for intelligent supervision, yielding initial positive results. However, challenges remain for industrial digitalization: enterprises face high costs for digital transformation, significant disparities exist in the digital transformation processes of enterprises of different scales, and there are difficulties in promoting industrial digitalization. Similarly, in terms of digital supervision, there is a lack of effective planning and unified design, widespread redundancy in platform construction, and low efficiency in collaborative supervision. This article focuses on the digital transformation of the medical device manufacturing stage and digital supervision, explores technical solutions for the digital transformation of both enterprises and regulatory authorities. It also puts forward suggestions for promoting the continuous improvement of digital intelligence in medical device manufacturing stage and the level of digital supervision.
关键词
Key words
医疗器械;生产环节;新型信息技术;数字化转型;数字化监管
medical devices; manufacturing stage; novel information technology; digital transformation; digital supervision
1、 研究背景
近年来,我国医疗器械产业高速发展,截至2023 年,我国医疗器械生产企业达到3.67 万家,营业收入自2019 年的7200 亿元上升至13 100 亿元;医疗器械经营企业达到136.47 万家,经营企业数量较2019 年实现翻倍。随着产业规模的快速增长,医疗器械生产、经营企业数量的快速上升与监管资源紧张的矛盾日渐显现。据统计,医疗器械GMP 检查员年人均任务量从2018 年的4.27 次/ 人上升至2023 年的6.38 次/ 人;与此同时,生产企业年均所受日常监管检查数从2018 年的1.77 次下降至2023年的0.73 次,如图1 所示。

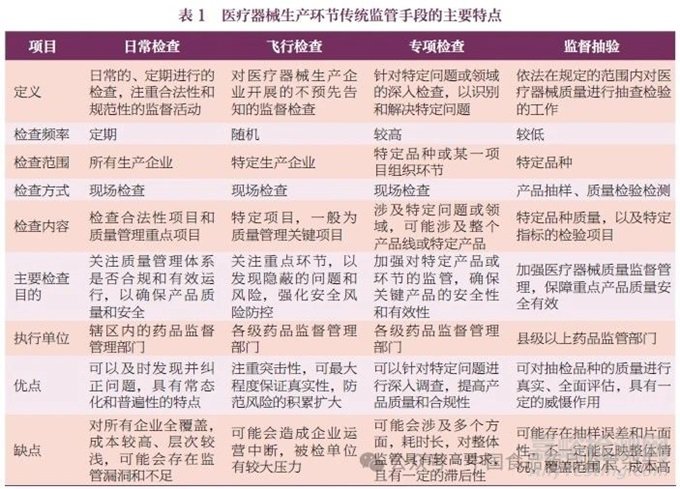
传统监管手段以现场监督检查(日常检查、飞行检查、专项检查等)为主,监督抽验为辅,属于事后监管,其防范、发现和处理风险的能力略显不足[1]。本文对日常检查、飞行检查、专项检查和监督抽验4 类监管方式的主要特点进行了总结,见表1。
信息技术的快速发展,推动了医疗器械产业的数字化转型,显著提升了产业的数字化水平,加快了数据要素积累与价值释放的进程[2]。同时, 监管数字化与产业数字化相互依存、相互促进, 为提升监管效能提供了新思路。
数字化监管是指运用信息技术和数字化手段,对传统监管方式的部分或全部流程数字化处理,实现监管信息的快速收集、精准分析和高效处理,以提高监管的准确性、及时性和有效性[3]。
数字化监管与传统监管相互补充、相互促进[4]。传统监管依赖于人工检查、纸质文件记录和现场审核等方式, 注重对关键环节和重点问题的把控, 具有直观、深入的特点, 通过现场检查和与相关人员的直接交流获取详细信息, 能够对复杂情况做出较为准确的判断。数字化监管则借助新型信息技术,通过实时监测、远程监控和大数据分析等手段,对关键质量参数进行采集与监控,并利用算法等技术识别监管对象违规行为、有效管控和处置违规行为,实现风险闭环管理,具有实时、高效的特点,可以实现对医疗器械全生命周期的动态监管。
可以看出,数字化监管是对传统监管的有力补充和支撑,可以在传统监管的基础上,进一步拓展监管的广度和深度,提高监管的精准性和时效性[5]。例如,数字化监管可以为现场检查提供前期的数据分析支持,使检查更具针对性。同时,传统监管的实践经验和专业判断也为数字化监管的模型构建和算法优化提供了重要参考。在监管工作中,应将两者充分结合并发挥各自优势,以传统监管的严谨性和专业性为基础,融入数字化监管的高效性和智能化,形成一个更科学、完善的监管体系,更好地保障公众的健康和安全。
目前,医疗器械领域的数字化监管主要有以下5 个应用场景[6]:①远程监管。利用信息技术,根据关键环节数据识别风险因子,研究建立生产检验数据靶向分析模型和远程监管风险预警模型,为监管部门提供数据支持,对各类风险趋势进行预判。②辅助现场监管。信息技术可以辅助现场检查的准备工作,即将既往检查报告及企业信息等数据输入人工智能模型,进行深度分析和推理,以提供检查重点、潜在风险点、抽检方式等建议,提高检查效率与质量。还可以辅助检查人员撰写检查报告,提高报告撰写效率,减少人工编撰所耗时间和精力,保证报告的一致性和规范性,提高报告的质量和可靠性。③辅助抽检工作。通过自动提取关键信息,并与系统信息进行比对,大幅减轻工作人员手工输入抽样信息的压力,有效提升抽检数据的一致性和准确性。同时,还能够批量解读监督抽检报告,精准提取关键数据与结论,实现对报告的结构化处理,并在此基础上汇总监督抽检数据及总结结果,是数据分析的重要抓手。④辅助药物警戒。辅助监管人员开展不良反应和不良事件报告的评估工作,借助先验知识图谱和信息技术,从“个例安全性报告”中自动提取关键信息实现结构化数据处理,排除重复报告后,基于提取信息的内容质量进行自动分级,筛选包含足够信息量、具备评估价值的安全性报告,以便进行后续的数据分析。⑤网络交易监管。基于网络交易敏感词库、交易风险检测提示词大语言模型、风险预警机制算法及异常识别机器学习模型等,实现前置风险评估和预警,构建医疗器械网络交易违法违规风险分析系统,以提供关于重点监管产品、重点监测平台、网络巡检目标等方面的建议,协助监管部门制定更加精准、高效的网络监管计划及方案,提升医疗器械网络交易监管的针对性和准确性。
本文对数字化监管的主要优势进行了总结,包括以下3 个方面:①优化资源,提高效率。通过信息技术收集、处理和分析数据,合理分配监管资源,提高资源利用率,同时减少人为错误,提供更精确的监管结果。②实时监测,智能预警。突破时间和地域限制,对大规模的监管对象进行全面实时跟踪和监控,主动预测潜在风险和问题,及时采取防范措施,实现预防性监管。③驱动决策,高效协作。借助丰富的数据资源和深度分析能力,为监管政策的制定和调整提供科学依据,提高决策质量和速度,同时,数据的整合与共享能进一步促进不同监管部门之间的高效协作,形成监管合力。
总之,数字化监管不仅可以提高监管效率和质量,还能够更好地保障公众的身体健康和用械安全。在“数字中国”持续推进的背景下,数字化、智能化的智慧监管体系成为推动监管治理流程再造和模式优化、不断提高决策科学性和服务效率的核心手段与发展趋势。国务院及相关监管部门先后出台了一系列有关加强生物医药领域数字化监管的政策,为医疗器械数字化监管提供了有力保障,见表2。

2、 国内外药品数字化监管的探索与实践
2.1 我国各地区药品数字化监管的探索
立足于保障药品质量安全,促进产业发展的目标,我国部分地区药品监管部门积极探索了信息技术与监管业务的结合。
2.1.1 河南省“千里眼工程”
河南省“千里眼工程”试点应用了生产现场远程监管,通过现场固定和移动在线视频检查、关键质量参数采集和数据分析技术实时识别违规行为并处置,实现“千里眼工程”与药品监管业务一体化联动。创新监管模式,由传统现场监管逐步向全天候、全时段、全过程转变,有效应对监管压力骤增、监管效能不足等挑战,显著提升了监管的预见性、靶向性和及时性[7]。
2.1.2 辽宁省“疫苗追溯监管系统”
辽宁省“疫苗追溯监管系统”通过采集生产企业、运输配送单位、疫苗使用单位的各项关键环节数据,整合疫苗生产、流通等全过程追溯信息,形成疫苗追溯链条,实现产品的“来源可查、去向可追”[8]。疫苗追溯监管系统的建设有助于及时发现和控制风险,为疫苗监管和追溯提供抓手、为相关部门追溯疫苗提供信息。还能够充分发挥追溯信息在日常监管、风险防控、产品召回、应急处置等监管工作中的作用,提升监管效能。
2.1.3 上海市“药品安全信用档案系统”
上海市“药品安全信用档案系统”涵盖了药品、医疗器械和化妆品,汇集了企业营业执照、技术审评、监督检查、信用评价、守信激励等信息[9]。该系统可根据企业、产品、人员3 个维度构建企业信用档案,并根据信用档案对企业进行分级管理,对不同等级的企业实施不同级别的现场监督检查。通过对监管对象进行标签化、动态化、差异化处理,能够缓解监管任务重与监管力量不足的矛盾,实现监管资源的高效分配。
2.1.4 浙江省“医疗器械跨区域协同治理应用”
浙江省“医疗器械跨区域协同治理应用”通过建立实时可信的远程监管工具,明确属地责任、固化协同机制,利用信息化技术再造跨区域审批、检查流程,实现线上线下协同监管。通过“企业在线、检查在线、监管在线”3个应用场景,解决了跨区域监管中监管信息互通、监管结果互认、监管人员互派等具体执行任务存在的高成本、低效率等难题[10]。
2.2 美国和欧盟在生物医药行业数字化监管的实践
纵观全球,部分国家和地区数字化监管已广泛应用于生物医药行业,包括医疗器械的全生命周期管理等[11-12],覆盖产品研发、注册审批、生产质量控制和不良事件监测等环节,替代或改进了部分传统的监管方式。
2.2.1 美国
美国作为生物医药行业发展最前沿的国家之一,其产业基础扎实,技术创新活跃,且具备较为完善的法律法规体系,为数字化监管奠定了良好基础。美国生物医药行业的数字化监管探索起步相对较早,其做法大体分为以下3 个方面:①在法规层面对电子数据、信息以及相关系统进行了广泛的、适用的、最低限度的强制要求。②及时发布法案、指南对相关法规做出修订与解释,以更好地实施数字化监管。③在监管科学层面与社会组织合作探索,构建完整的数据应用体系,以推动数字化监管。美国在数字化监管方面的探索实践包括:①电子审批。美国食品药品监督管理局的医疗器械注册和上市前审批系统(eSubmit)允许企业以电子方式提交注册申请和相关文件,加快了审批流程。②电子记录。数字化监管要求企业建立和维护电子记录,包括生产记录、质量控制记录和不良事件报告等,替代了传统的纸质记录。③远程检查和审核。数字化监管允许监管机构通过远程方式对企业进行检查和审核,包括视频会议、远程访问企业数据库等,远程检查和审核可以减少监管机构和企业的时间及成本,提高监管效率。④数据分析和风险评估。数字化监管系统可以收集和分析大量数据,包括不良事件报告、召回信息和其他监管数据等,使监管机构更好地了解医疗器械产品的风险状况,制定更科学的监管政策和措施。
2.2.2 欧盟
相较于美国, 欧盟由于监管体制的差异和前期相对保守的政策, 在生物医药领域数字化监管的探索工作相对滞后。近几年, 欧盟逐渐意识到数字技术及人工智能在生物医药监管中的巨大潜力, 开始加速推进数字化监管工作。在药品方面, 为防止假药进入合法供应链,欧盟强制药品上市许可持有人和制造商构建欧洲药品验证系统(european medicines verification system,EMVS),该系统由欧洲药品验证中心数据库(european medicines verification system database,EMVS database)和各成员国建立的国家药品验证系统( national medicine sverification system,NMVS)组成;在医疗器械方面,与美国类似,欧盟也使用医疗器械唯一标识(unique device identification,UDI)对医疗器械进行标识,同时, 建立基于UDI 码的欧盟医疗器械数据库(european database on medical devices,EUDAMED)。此外,发布了欧洲药品机构网络战略(european medicines agency network strategy ,EMANS)将数据分析、数字工具和数字化转型列为重点,为欧洲药品监管提供战略方向,取得了一系列突破[13]。
美国和欧盟的生物医药产业数字化监管实践具有较多共性。两者均以控制质量和安全有效的“追溯”为核心;对生物医药产品的数字化监管均在明确的法律授权范围内;同时,均重视监管科学的应用研究,不断推进监管新工具、新标准、新方法的发展;并且还根据产业发展新形势,开展智能制造的相关研究,不断完善技术指南与标准。
2.3 我国药品数字化监管实施存在的不足
我国的药品智慧监管试点工作已形成了一些相对成熟、可靠的做法和经验,然而由于缺乏有效规划和统一的系统设计,尚存在一些不足。例如,存在重复建设;频繁变更系统和业务流程,增加管理复杂性和成本;监管业务标准化、规范化水平低,全流程数字化难度高,数据价值不足;信息数据化程度较低,数据共享、系统互通建设不完善,监管协同效能低。同时,数字化监管未形成对产品和企业的全覆盖,尚存在对分析质量关键因素、精准预警等支撑能力不足,产品质量控制和安全有效追溯性有待加强等问题[14],限制了数字化监管方式的持续探索与广泛应用。
根据江苏省开展的医疗器械企业信息化调研情况可知,企业开展智能制造动能较强。在1181家参与调研的企业中,38.0%的企业决策层期望推动数字化,32.0% 的企业结合信息化开展创新,但总体信息化水平还不高。85.6% 的企业信息化投入占营业收入的0.5% 以下,主要原因是受限于技术与相关法规的要求,数字化的推进速度慢。同时,由于转型成本高,大部分中小企业无法负担高昂的数字化转型成本[15],不同规模企业的数字化转型进程差距大,产业数字化推进存在困难。
3、 监管数字化的技术方案
基于信息技术特点、发展现状与趋势,立足医疗器械监管业务的现实需要,结合现有试点项目的优秀经验做法与共性问题,本文对于医疗器械生产环节数字化监管探索,提出“一体化的企业数字化工具包、一体化的数据管理平台、一体化的数字化监管平台”3 部分技术方案和建议,以期为构建安全合规、兼容高效、经济适用的医疗器械数字化监管体系提供参考。
3.1 一体化的企业数字化工具包
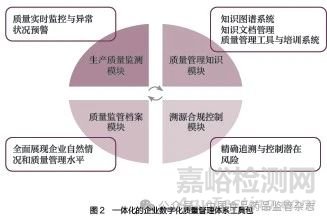
为解决企业数字化转型的成本与合规困局,开发医疗器械生产企业数字化工具包,采集并分析医疗器械生产环节关键数据,为数据的汇集、管理和预警等功能打下基础。一体化的企业数字化工具包主要包括:生产质量监测模块、质量管理知识模块、溯源合规控制模块和质量监管档案模块,如图2 所示。
(1)生产质量监测模块。通过知识图谱、区块链、5G+ 物联网等新技术,构建一体化的企业质量管理体系工具包,实现生产关键质量参数实时采集、设备运行状态监控、生产数据趋势分析以及生产异常状况预警,规范生产质量管理流程,获取标准化、规范化的质量关键数据。
(2)质量管理知识模块。根据企业的实际业务场景构建产品细分知识库和知识图谱。通过图谱搜索与智能问答等功能,快速准确地锁定目标数据,充分利用数据的关联性与相关经验的积累,制定多种培训计划,提供多种在线学习方式,以实现全面的培训管理和记录。
(3)溯源合规控制模块。建设追溯体系,实时上传关键数据和监督检查的预填报。通过全面追踪质量事件,实现数据的实时高效、永久留存和完整可溯,帮助企业精准追溯与控制潜在风险,同时为远程监管、自动智能化执法提供可能性。
(4)质量监管档案模块。建设质量监管档案模块,多渠道汇聚数据、借助“企业+ 产品+ 人员”多维度数据画像等手段,探索以医疗器械风险分析模型建设为核心的数据整合。通过数据关联建立企业全景和企业画像,实现风险信息动态预警提示功能,实现“一站式”管理。
3.2 一体化的数据管理平台
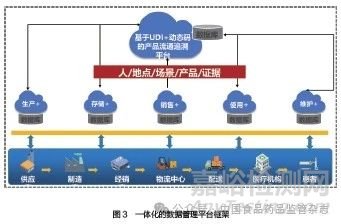
从药品监管领域的实践来看,长期存在数据含义不明确、数据质量不可控、数据共享不畅通等问题,导致数据的应用价值难以充分发挥。为解决数据应用问题,本文构建了一体化的数据管理平台,如图3 所示,深化数据资源的共享与开放,提升数据共享融通、风险研判、决策支持能力,推进监管和产业数字化升级。该平台主要通过以下几点实现数据价值的提升。
(1)基于分布式存储技术,一方面对结构化数据进行数据标准化后存入标准化数据库,另一方面对非结构化数据构建索引,并在标准化数据库存储索引数据。为不同存储系统提供公共的存储管理服务,实现海量真实世界数据的标准化存储与持续积累,并通过分布式的节点共同维护数据的完整性和安全性,确保数据的可信度和可靠性。
(2)制定数据接入规范,包含数据接入的工作流程、接入数据分类、接入数据对象及范围、不同类型监管数据的采集要求、数据接入方式、数据传输模式、生产企业系统数据接入时的频次、智慧比对计算方法、监管部门和生产企业在接入工作中的职责划分以及对数据安全的保障等内容。
(3)通过区块链的去中心化及数据留痕等特点,实现数据流通共享全流程的可记录、可验证,保障数据的防篡改和可追溯[13],保证数据使用管理全过程的透明化、真实性和可信度,并通过分布式网络实现实时或准实时的数据更新,大幅提高数据传输的效率和透明度,降低信息不对称的风险。
(4)在各方数据不出本地,包括数据不交换、不公开的情况下,联合利用多方数据,进行共享机器学习模型的协作训练。这种方法既能避免数据在链上被公开又能确保数据的真实性,保障数据隐私和数据规范,消除企业不愿公开数据的顾虑,做到从技术上打破数据孤岛,降低数据共享的成本和难度,实现数据的协作和共享。
3.3 一体化的数字化监管平台
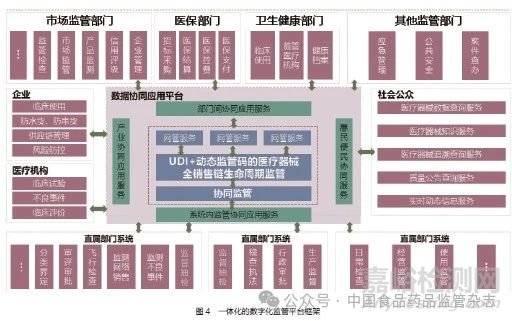
本文通过建立一体化的数字化监管平台,如图4 所示,开展医疗器械风险预警分析,并结合智慧监管,以问题为导向,使有限的监管资源聚焦到重点环节和风险隐患上,切实保障产品质量安全。该平台主要通过以下几点实现海量数据的快速处理和关键环节的风险预警。
(1)通过信息化监管模型监控生产和质量管理过程,及时发现企业异常行为和风险情况,迅速提示监管靶点,充分发挥数据要素在监管流程中的重要作用。将医疗器械质量监管关口前移,将风险控制在萌芽状态,为监管部门提供事前识别、提前预警、提前管控的信息化手段,提升监管工作决策的精准性和有效性。
(2) 构建医疗器械生产过程风险预警模型[16],包括不合格风险预警、超限值风险预警和波动异常预警, 设置风险预警规则, 实时进行数据分析和异常信号报警, 及时向企业和监管部门反馈风险信号。同时,结合企业质量监管档案和风险会商会的研判内容, 进行风险源识别、预测及管理优化, 为药品监管部门提供大数据决策的风险预警信息。
(3)当监管模型发生预警时,应根据预设的规则,自动将预警信息发送至监管部门,监管部门对风险预警信息进行分级分类后,可采用调阅详细数据、远程检查、现场检查等多种方式开展线上和线下相结合的全面性风险排查,并跟踪企业处置过程,强化企业主体责任,落实部门监管职责,实现风险闭环管理。
4、 相关思考
为更好地保障产业和监管的数字化发展, 本文尝试性提出以下几点建议, 以推进医疗器械生产环节数字化监管的建设。
4.1 分步实施试点
为落实《国务院办公厅关于全面加强药品监管能力建设的实施意见》《关于加快推进省级药品智慧监管的指导意见》有关部署,建议分步选择重点领域具有代表性的医疗器械生产企业开展数字化监管试点应用研究。按照医疗器械风险程度,探索分领域推动数字化监管,优先重点选取第三类植介入医疗器械作为第一批实施数字化监管的试点品种,从中选取具备一定数字化基础的企业作为试点企业。依据《医疗器械生产质量管理规范》,参照《血液制品生产检验电子化记录技术指南(试行)》《药品监管人工智能典型应用场景清单》等相关指导原则和指南,以产品生产为主线,重点对灭菌、质量控制等生产过程的关键工序采取必要的可视化视频监控,包括因技术条件限制或其他因素导致生产设备和生产过程的检测设备无法自动采集、记录数据的,应采用人工录入或其他辅助方式及时将生产及检测过程信息转化为电子数据。同时逐步将不同种类的典型产品也纳入试点工作,便于进一步推广和扩展。
4.2 建立相关标准和指南
建立符合产业发展特点和监管需求的监管信息化标准体系,包括基础设施标准、数据标准、应用支撑标准、安全标准、管理标准等,以解决各地区监管系统建设参差不齐,设计理念与监管服务实践不匹配,政府监管数据互联互通和外部数据共享程度水平较低,系统功能与事中、事后监管体系总体目标存在差距等问题[17]。同时,建立统一检查的操作标准规程,明确检查范围、内容、方式、程序、编制质量、抽检、日常监督检查结果、违法行为查处、不良行为记录、投诉举报数据及规范,动态管理监管事项目录,强化检查结果的运用,实现电子文书标准化、规范化,提升医疗器械生产过程信息化监管的精准度。
4.3 调动企业转型积极性
贯彻落实医疗器械生产分级分类监管职责,出台相关鼓励政策,建议对纳入数字化监管的企业,提升其信用等级,降低监管级别,包括建立合并现场检查机制,降低现场检查、抽检比例和频次等,降低企业的监管成本。同时加强对信息技术研发人才、新技术创新应用人才、数字化转型管理放权人员等的激励。鼓励有条件的地区通过专项资金、补贴政策等方式,支持中小企业的平台建设,鼓励金融机构为中小企业提供数字化转型专项服务,调动各方推进企业数字化转型的积极性。
4.4 完善法律法规
逐步完善医疗器械生产过程数字化监管的法律法规,明确医疗器械生产企业建立信息化管理系统的义务,并定期接受监管部门对其信息化建设和数据管理情况的检查和评估。规范生产过程的电子化记录,包括设施设备、硬件要求、生产过程的物料管理、生产操作等,明确数据报送要求,规定企业必须按照一定的格式和频率,向监管部门报送生产关键工序(如灭菌和质量控制等环节)的数据,并保证数据的真实性、完整性和准确性。明确企业和监管部门在数据存储、处理和传输过程中的数据安全和隐私保护责任,并需采取必要的技术和管理措施,防止数据泄露、篡改或滥用。明确不同监管部门之间数据共享互通机制,保证数据的及时性和准确性,促进市场监管、卫生健康和药品监管等部门之间的协同监管,形成监管合力。
引用本文
林家颐,李丹荣*.关于我国医疗器械生产环节开展数字化监管的思考[J].中国食品药品监管.2024.09(248):130-139.

来源:中国食品药品监管杂志


