您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-29 18:03
放射性药物(也称“核药”)从临床用途上分为诊断性核药和治疗性核药。诊断性核药和治疗性核药的核素类型不同,诊断用核素多选择穿透性强、电离能力弱的释放γ光子的核素(如Tc99,In111)或释放正电子的核素(如Ga68,F18,Cu64),该类核素的物理半衰期较短(1h~3天);治疗类核素常选择穿透力弱但电离能力强的α核素(如Ac225,Ra223)或β核素(如Lu177,Y90),物理半衰期相对较长(6-10天)。诊断性核药和治疗性核药的配体结构可能相同也可能不同,而使用相同或相似配体结构开发诊疗一体化药物已成为核药研发的一个备受关注的新方向。
近年来,多款放射性核素偶联药物(RDC)展现了其在肿瘤领域强大的治疗潜力,尤其是诺华的Pluvicto,配合放射性诊断药物Locametz使用,实现了对PSMA阳性前列腺癌患者的诊疗一体化。2022年, Pluvicto获得FDA批准上市。2023年和2024年上半年,该药物的销售额分别达到9.8亿美元和5亿美元,预计2024年全年销售额将首次突破10亿美元。Pluvicto在临床上的成功验证了核药的商业潜力,极大地激发了RDC药物研发市场的热情。中美欧等地药物监管机构陆续发布了多项针对性的放射性药物指导原则,有力地规范和推动了RDC药物研发,核药市场呈现出一片繁荣景象。
本文通过分析RDC药物的结构,探讨了RDC药物的特点及其毒性来源,并结合已上市药物Pluvicto所公布的研发数据,进一步探讨优质RDC药物可能具备的药性特点。
RDC药物的关键要素
RDC药物主要由靶向配体(抗体、多肽、小分子等)、连接子、螯合物和放射性核素四个部分构成。
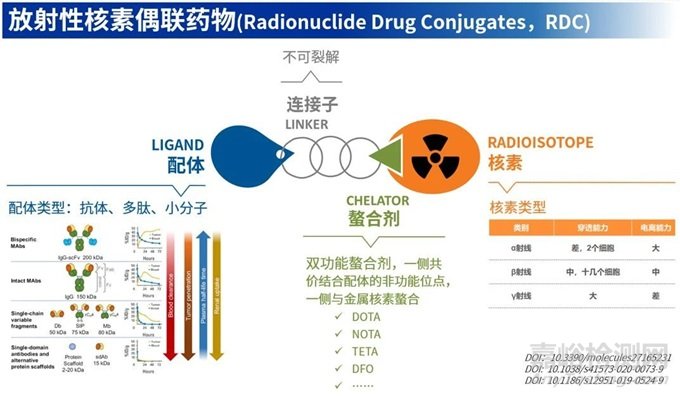
图1. RDC药物的组成部分
配体
配体可以是多肽、抗体或小分子等。不同类型的配体其药性特征有所不同,需要关注药物的血液清除率、血浆半衰期以及其在肿瘤和非靶组织中的摄取情况。这些性质最终将影响药物在药效和安全性之间的平衡。
核素
需要关注其穿透能力和电离能力。例如,α射线具有较强的电离能力,能够瞬间释放高能量,治疗效果较好,但由于穿透性差,仅适用于小灶病变。γ射线则相反,穿透性强,常用于诊断药物。β射线的特性介于两者之间,目前放疗药物中常用的核素Lu177就是β射线。此外,α射线因其高能量优势,成为未来研发的趋势之一。然而,由于α核素在生产和使用上的限制,以及子核素再分布的不确定性可能给非临床研究带来挑战。
螯合剂
RDC药物的起效基团是放射性金属核素,所以与ADC相比,RDC多了螯合剂结构。根据核素的不同价态,需要选择不同的螯合剂,常见的螯合剂包括DOTA、NOTA等。
Linker
由于药物发挥作用过程中,核素不一定需要断裂下来,且不必内吞入细胞也可以发挥辐射杀伤的效果。因此,RDC药物常使用不可裂解的Linker,这样可以减少放射核素在血液循环中的脱落,降低脱靶毒性。
RDC的作用机制
常见的RDC药物通常通过静脉给药,药物随着血液循环与肿瘤细胞表面抗原或微环境中的蛋白结合,通过内化/吞噬或无需内吞即可发挥药效。其作用机制主要分为两个方面:一方面是通过放射性损伤细胞DNA,引起细胞凋亡;另一方面是远端效应,通过损伤相关分子模式,机体细胞死亡所释放的内源性因子激活T细胞免疫,引起对远端病灶的免疫杀伤。第二个机制为RDC药物提供了更大的想象空间。

图2. RDC的作用机制示意图[1]
RDC的毒性来源
RDC药物的毒性主要来自配体毒性和辐射毒性两个方面。然而,由于药物在产生核素辐射毒性时往往还未达到配体毒性的剂量,因此配体毒性通常并非RDC毒性的限制因素。辐射毒性才是RDC毒性的主要关注点。
配体分子导致的辐射毒性
配体分子对靶点的亲和力、稳定性以及特异性决定了RDC在靶部位和非靶部位的分布比例。RDC在非靶组织的分布与蓄积会导致对这些组织的辐射杀伤。此外,如果配体的分子类型是抗体,由于其在体内循环时间较长,可能导致血液学和骨髓毒性。若配体是较小分子,则因其渗透性较强,能够通过肾小球滤过屏障,导致肾脏分布和蓄积,较易引起肾毒性。
核素性质导致的辐射毒性
当连接子和螯合剂不稳定导致核素脱落后,核素会随着血液自由分布,对辐射较敏感的组织(如生殖系统、骨髓造血系统等)首当其冲受累。此外,不同核素本身也具有不同的组织亲和特点,例如碘与甲状腺,镭与骨,这些亲和特征使得这些器官容易成为毒性靶器官。
核药进入体内后,可能会被内源性自由形态的金属离子(如钙、锌、铁)取代络合,从而使金属核素以离子形式自由分布在体内。当金属核素被金属蛋白清除时,相似的氧化态和离子半径也可能产生转络合效应。
此外,下一代放射性药物聚焦到更高效能的α核素,尽管α核素用于放射性治疗药物的开发有很多优势,但α粒子的反冲能量效应也增加了辐射毒性的不可预测性。如下图所示,这种衰变产生的能量可能导致核素从螯合基团中脱离,衰变后的子核素可能继续衰变,衰变子核素的毒性大小和影响范围与以下因素相关:反冲能量的大小、核素渗透性以及血液运输情况。
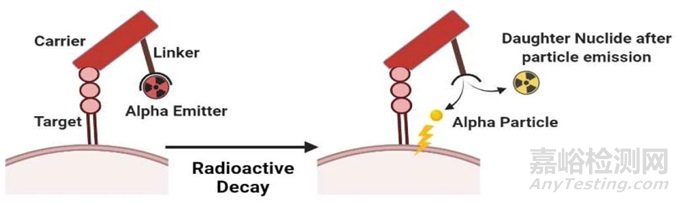
图3. α核素衰变的反冲能量效应[2]
已上市RDC(Pluvicto)分析
我们以Pluvicto这款里程碑式的药物为例,分析RDC药物的药理毒理特点。结合Pluvicto的研发历程,可以发现,这款药物的成功离不开对配体的选择和优化。Pluvicto的配体结构非常简单,却实现了高度的特异性和靶点亲和力,同时达到了药性特征的平衡。
2020年,Eline等发表文章对几种不同配体(PSMA-617、PSMA I&T、JVZ-007)进行了药性特征比较。[3] PSMA I&T的结构比PSMA-617更复杂且分子量更大,而JVZ-007则是一个纳米抗体。如图4显示,在PSMA-PDX模型中,肿瘤的辐射摄取量几乎为零;在PSMA+ PDX模型中,可以看到PSMA-617的辐射收取优于PSMA I&T,而纳米抗体JVZ-007在三个PDX模型中的表现都没有明显的优势。

图4. Pluvicto不同配体的药性特征比较[3]
对于在肿瘤组织分布较好的Lu177-PSMA-617和Lu177-PSMA-I&T,如图5,肿瘤模型小鼠的成像直观地展示了两款药物在肿瘤和非靶组织中的摄取情况。其中,Lu177-PSMA-617在肿瘤中的摄取明显,而在其他器官如肾中的摄取不明显。相比之下,Lu177-PSMA I&T在肾脏和膀胱的摄取非常显著,放射性药物在肾脏和膀胱的大量分布意味着可能会产生较强的肾毒性和膀胱毒性。

图5. 177Lu-PSMA-617和177Lu-PSMA-I&T给药后的的分布[3]
第二点是核素类型的选择。Lu-177是一种能量高但射程短的核素,能够在杀伤肿瘤细胞的同时减少对非靶组织的影响。其稳定性良好,半衰期为6-7天,为临床应用提供了充足的时间。
第三点是适应症选择。Pluvicto的上市适应症前列腺癌是典型的冷肿瘤类型,肿瘤免疫治疗尚未获得显著药效,而其他靶向药物还在研发中,这种背景为Pluvicto的商业化发展提供了足够的空间。由于远端效应,放疗后的免疫激活提示Pluvicto未来还可能与免疫药物联用,以提高药效。
结语
目前,RDC药物的靶点主要集中在PSMA和SSTR。未来,随着更多靶点和适应症的探索,RDC药物有望覆盖更广泛的疾病领域。随着新放射性核素的不断涌现,RDC药物的应用领域将进一步扩大。
参考文献:
[1] Oleksii O Peltek, Albert R Muslimov, Mikhail V Zyuzin, Alexander S Timin. Current outlook on radionuclide delivery systems: from design consideration to translation into clinics. J Nanobiotechnology. 2019, 17(1):90. doi: 10.1186/s12951-019-0524-9
[2] Holis Abdul Holik, Faisal Maulana Ibrahim, Angela Alysia Elaine, Bernap Dwi Putra, Arifudin Achmad, Achmad Hussein Sundawa Kartamihardja. The Chemical Scaffold of Theranostic Radiopharmaceuticals: Radionuclide, Bifunctional Chelator, and Pharmacokinetics Modifying Linker. Molecules. 2022, 27(10):3062. doi: 10.3390/molecules27103062.
[3] Eline A M Ruigrok, Nicole van Vliet, Simone U Dalm. Extensive preclinical evaluation of lutetium-177-labeled PSMA-specific tracers for prostate cancer radionuclide therapy. Eur J Nucl Med Mol Imaging. 2021, 48(5):1339-1350. doi: 10.1007/s00259-020-05057-6.

来源:Internet


