您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-30 08:54
前言
今年4月,Nature Review Drug Discovery杂志在文章“The antibody–drug conjugate landscape”中提到,抗体-药物偶联物(Antibody-drug conjugates, ADC)已成为肿瘤领域的一种关键治疗方式,与多种适应症的标准治疗和化疗相比,其临床表现优越,因此预测上市和处于三期临床开发的ADC药物收入将在2028年达到260亿美元[1]。全球癌症发病率的上升也推动了对抗癌药物的投资增加,促使ADC药物市场大幅增长。尽管ADC药物已经成功上市15个,但其仍然面临两大主要挑战:首先,经验证的有效载荷作用机制单一,限制了可治疗的疾病范围;其次,非特异性和不充分的有效载荷传递限制了ADC的治疗窗口。本文总结了从靶点、小分子毒素和连接子这三个设计维度的创新点,并重点介绍体外ADME在研究ADC药物中建立的各个实验平台及其应用。
1、ADC药物及研发创新
ADC药物是将单克隆抗体经过连接子与小分子毒素药物偶联形成的靶向药物。ADC由三个部分组成:抗体、小分子毒素和连接子,各个组分需要具备对应的特征,抗体需要有高特异性和低免疫原性;连接子要求在循环系统中稳定,肿瘤环境中可有效释放细胞毒素,小分子毒素则需要生理条件下稳定,且对于肿瘤细胞有很强的杀伤力;理想的ADC药物需在血液循环中保持稳定,精准到达治疗目标,并最终在目标附近释放细胞毒性。
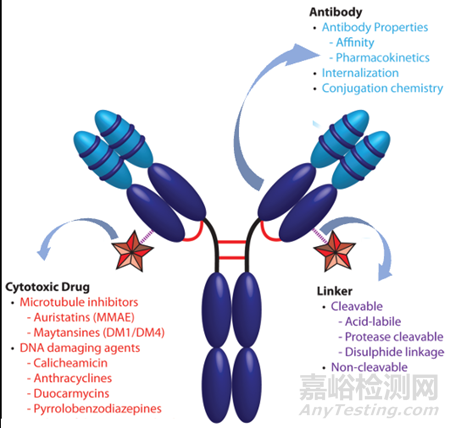
图1. ADC药物的结构[2]
1、靶点的创新
目前,从处于各个研发阶段的ADC药物可以看出,靶点主要集中在HER2、TROP2等常用靶点上。总体而言,约90%的靶点是在癌细胞上高表达的抗原,约10%的靶点与肿瘤微环境的独特特征相关。新出现的靶点是一种纤维连接蛋白(FN)的额外结构域B(EDB),纤维连接蛋白是一种普遍表达的高分子量细胞外基质,其在正常组织中表达受限,在肿瘤组织中高表达。
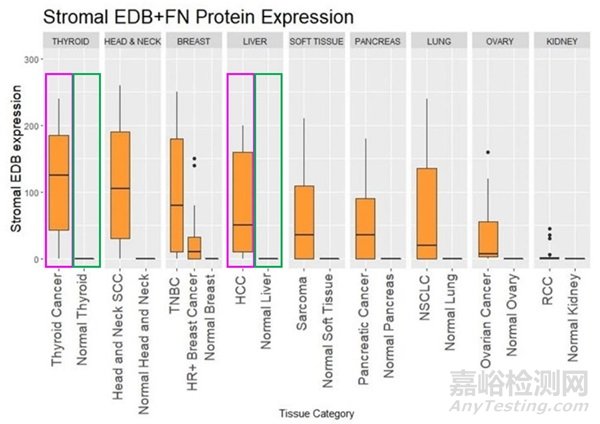
图2. EDB+FN蛋白在肿瘤间质与正常组织中的表达差异[3]
该靶点在肿瘤间质与正常组织中的表达差异如图2所示。以甲状腺和肝脏中表达为例,紫色框线是肿瘤间质的表达量,绿色是正常组织的表达量,可以看出其明显的差异化表达。目前有一款在研的ADC药物PYX-201靶向纤维连接蛋白,在2024年美国癌症大会上进行了数据披露,治疗效果较好[1]。
2、小分子毒素的创新
目前常用的小分子毒素作用机制是抗有丝分裂、拓扑异构酶1抑制剂和DNA烷化剂,包括熟知的MMAE(微管抑制剂)、Dxd(拓扑异构酶1抑制剂)等小分子毒素。新型的毒素是一种小分子降解剂,作用机理是选择性降解GSPT1。GSPT1是多种肿瘤组织和细胞中显著过表达的关键翻译终止因子,小分子降解剂通过选择性降解GSPT1进而使得细胞凋亡,其具有高特异性、皮摩尔效力和靶向多种与癌症相关的细胞内蛋白的能力。目前在研的ADC药物ORM-5029的有效载荷是高效选择性GSPT1降解物。在临床前研究的乳腺癌模型中,其抗癌活性与曲妥珠单抗(Enhertu)相似[1]。
3、连接子的创新
常用的连接子是二肽VC、四肽GGFG等,其可以通过组织蛋白酶进行裂解。新兴的连接技术不依赖于内源性酶介导的切割,专注于外源性控制有效载荷的释放。其原理是ADC与细胞外肿瘤靶点结合,然后静脉注射外源化学探针(激活剂),选择与ADC连接子快速反应进而释放药物,可以绕过对肿瘤生物学的依赖。在研的TGW101采用外源性化学激活剂来诱导有效载荷释放,与VC二肽连接子相比,在结直肠癌和卵巢癌异种移植模型中显示出优越的抗肿瘤活性[1]。
通过三方面的创新点可以看出,ADC还有广阔的发展空间,在研的很多药物以传统经典的设计为主要导向,结合一些新的小分子毒素或者连接子等,将经典和创新相互碰撞,设计出更加合理的ADC药物。
2、ADC药物的体外ADME研究
根据ADC药物在体内的代谢过程,药明康德DMPK建立了对应的测试平台。在静脉注射后,首先需要保证ADC药物在循环系统中稳定,为了评估该稳定性,可以采用血浆/全血的研究体系;到达靶组织之后,利用抗体特异性结合抗原,经过内吞作用进入肿瘤细胞,在溶酶体作用下裂解连接子,释放细胞毒素导致细胞凋亡,为了评估细胞毒素释放机理,建立溶酶体、组织蛋白酶B、酸化肝匀浆和肝S9等测试体系;同时可以体外评估肿瘤靶细胞中细胞毒素的释放能力及其杀伤力。通过这些评估,可以更清楚地了解循环系统的稳定性和毒素释放的机制,更加合理地设计ADC药物。
1、血浆稳定性研究
选取ADC药物DS8201开展研究,其连接子和有效载荷是GGFG和Dxd,GGFG是常用的连接子,Dxd作用机制是拓扑异构酶1抑制剂。
表1. DS8201 基本信息
通过和不同种属的血浆及其含1%BSA的PBS孵育不同时间点直至21天,检测血浆中Dxd的生成浓度并计算其释放率。数据展示如下:
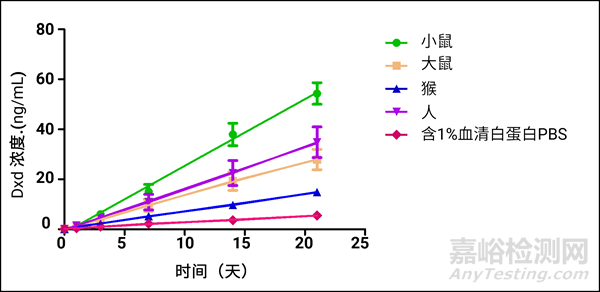
图3. 不同种属血浆和含1%BSA的PBS中Dxd的释放浓度
表2. DS8201和血浆孵育21天后Dxd释放浓度和释放率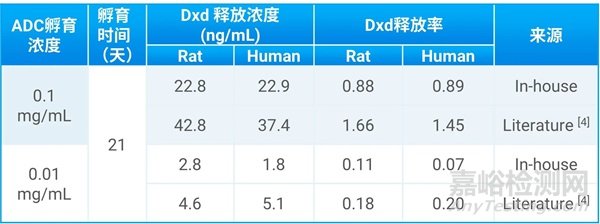
图3呈现了DS8201在不同种属血浆及其阴性对照组中payload释放浓度,可以看出均有一定的释放,但其释放率都小于2%,说明其在循环系统中稳定,与ADC设计的想法一致,孵育21天后的Dxd释放浓度和申报材料中的差异在3倍以内,说明血浆体系适合评估长时间的ADC的稳定性。考虑到Dxd在不同pH下有开环闭环两种形式,该体系将会进一步扩展优化。
2、ADC药物在不同测试体系中payload释放研究
维布妥昔单抗是2020年上市的一款ADC药物,靶点为CD30, 连接子和毒素是经典的VC二肽和MMAE。
表3.维布妥昔单抗基本信息
通过和组织蛋白酶B、肝溶酶体、肝匀浆、肝S9孵育不同时间点,检测其MMAE的生成浓度并计算其释放率。数据展示如下:
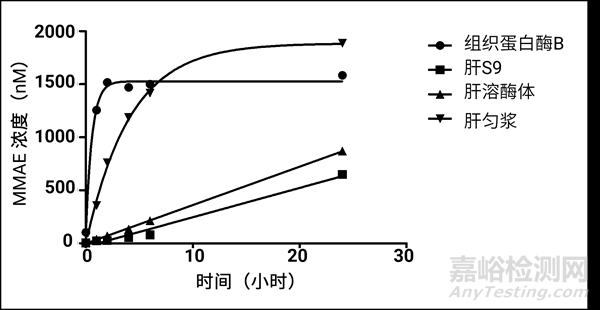
图4. 不同基质中MMAE的释放浓度
图4呈现其在不同测试体系孵育不同时间点后MMAE的释放浓度曲线,可以看出在组织蛋白酶B和肝匀浆中,其释放量类似,肝溶酶体和肝S9均有不同程度的释放。所以探索ADC药物中payload的释放机理,根据不同连接子类型(二肽,四肽,葡萄糖苷键等),可以选择不同的测试体系,以设计出更加合适的连接子。例如组织蛋白酶B是单一酶,裂解特定的连接子(VC,GGFG等),对于该类连接子可以直接用组织蛋白酶B进行研究,溶酶体则是含有多种水解酶,可以水解外源性和内源性的大分子,对于不明确裂解机理的连接子,可优先选择该体系。
结语
机遇和挑战并存,未来ADC药物的发展会朝向双靶点ADC、双载荷ADC及其新型的连接子方向,同时随着小分子筛选和蛋白质重组分子生物技术的进步,药物开发中出现了新的抗体偶联模式,包括抗体片段-细胞毒素偶联物、抗体-寡核苷酸偶联物(AOC)等。药明康德DMPK已建立不同的研究平台以评估ADC药物在循环系统稳定性及其payload的释放机理。面对“万物皆可偶联”的时代,药明康德DMPK针对不同的偶联技术,迎接挑战,不断丰富体外实验,建立了更多的评估平台,如组织蛋白酶L/K、葡萄糖醛酸酶等研究连接子裂解效率,更好地服务ADC药物的研发之路。
参考文献:
[1] Patrick Flynn, Smruthi Suryaprakash, Dan Grossman, Val Panier & John Wu, The antibody–drug conjugate landscape. Nature Review Drug Discovery, 2024.
[2] Siler Panowski, et al, Site-specific antibody drug conjugates for cancer therapy. mAbs, 2014
[3] Sharon Wilks, et al, A First-in-Human Phase 1 Clinical Study Evaluating Safety, Tolerability, Pharmacokinetics, Pharmacodynamics and Efficacy of the EDB+FN targeting ADC PYX-201 in Participants with Advanced Solid Tumors. Poster.
[4] NDA/BLA Multi-disciplinary Review and Evaluation. Center for Drug Evaluation and Research, 2019, Enhertu.

来源:药明康德DMPK