您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-30 09:09
替代分析方法及其基本要求
不同企业药品生产工艺可能不同,辅料、杂质等情况不同,尽管药典分析方法可能适用于市场上所有已有工艺生产出来的产品,但未必能够适合申请人所生产的产品。这时候申请人就会面临着两个选择,一是建立补充分析方法进行额外控制,二是建立替代分析方法。下面我们仅讨论替代分析方法。
当然,正如美国药典凡例6.30. 替代及协调方法和程序所讲,开发替代方法或程序的原因可以是多种多样的,不限于简化样品准备、提高精密度和准确度、改善(缩短)运行时间,或比官方方法或程序更适合自动化。【1】
替代分析方法或程序的定义为,除了官方药典方法或程序之外的任何方法或程序。替代分析方法与内部分析方法的区别是,替代分析方法所控制的项目已为各论或通则所收载,内部分析方法则没有被收载。
EDQM在《根据CEP 2.0对CEP档案内容的新要求》中对此进行了区分,要求分别放在注册资料3.2.S.4.2的2个不同小节中,第1小节---替代Ph. Eur.各论的内部分析检验规程,第2小节---额外的内部分析检验规程。【2】
替代方法或程序必须经过完全验证(见方法学验证程序(1225)),并且必须在逐个案例基础上建立的允许范围内产生与官方方法或程序相当的结果。【1】内部分析方法仅需要进行充分的方法学验证即可。
欧洲药典凡例 1.1.2.5 替代分析方法也规定,经主管当局同意,可以使用替代分析方法进行控制目的,前提是这些替代方法能够明确判断,如果使用官方方法,是否能达到各论标准的要求。如有疑问或争议,欧洲药典的分析方法是唯一具有权威的。【3】
如何判断替代分析方法与药典方法具有可比性?
最终证明可比性的责任在于使用者,必须以能令主管当局满意的方式证明和记录该方法的可比性。在药典和替代分析方法的生命周期内必须维持可比性。【4】
如何判断替代分析方法与药典方法具有可比性?不是简单的检验几批产品比较一下最终检测结果是否相近即可,必须对两种方法的性能进行评估和比较。
因此,可比性研究前提是,药典分析方法必须要进行确认,必要时进行验证。
可比性研究的目的是为了评估替代分析方法的结果和性能是否与药典分析方法具有可比性。这种评估通常涉及等效性试验研究,该实验研究是针对两种方法的APPCs(性能特征)生成可比性数据。在定量试验的情况下,可以评估这些比较数据在整个测量范围内的准确度和精密度。在可比性研究中,还可以根据方法的预期用途评估其他APPCs,如专属性/选择性。如果两个分析方法的数据不能进行统计学比较,那么关于可比性的结论则是基于替代分析方法的结果导致与药典分析方法相同的明确决定。
对于定量结果,可以考虑使用双单侧t检验(TOST)方法来比较两组均值。对于比单个水平上获得的结果分布范围更广的结果,可以考虑使用回归方法(如戴明回归,双变量最小二乘回归)。对于定性结果(如通过/失败)和限度试验,在评估分析方法一致性之前,可以使用列联表总结结果。比较报告的结果,确保分析接近标准限度的样品时,两种分析程序获得的结果可以得出相同的明确决定。
对药典分析方法和替代分析方法进行相同的试验,应尽可能使用相同的样品,进行直接比较。样品制备取决于比较的性质和/或使用的分析方法。
最好使用两种方法测试相同的均质、真实(即非加标)的样品。如果无法获得真实样品,也可以是合成样品,例如通过加标分析物或在受控条件下进行强制降解。重要的是选择的样品应代表方法常规使用中测试的物料。在选择代表性样品时应考虑以下方面:
- 应涵盖待测产品属性的数量值(例如浓度)的预期变异性。如果可用,考虑包含已知接近标准限度的样品也可能是有益的。
- 考虑样品基质的预期变异性。
- 对于产生多个结果的方法,如杂质测定,样品的选择允许对所有相关单个结果进行可比性试验,确保替代分析方法与药典分析方法具有可比性。
- 研究中应包括包含达到或接近报告阈值的关键成分的样品。
这些考虑因素可以确定是应该使用单一批次进行可比性研究,还是需要多个批次的待测物品以获取代表性样品。
在替代分析方法验证期间进行的精密度实验验证也可能适用于比较试验,前提是使用药典分析方法分析相同的样品。如果可以确认中间精密度因素对方法的可变性没有显著影响,则通过重复性实验来确定比较测试的精密度就足够了。
根据各论中描述的用途,药典中的标准品旨在用于药典方法;它们不一定适用于其他目的。使用者有责任建立用于替代分析方法的标准品。根据方法的预期目的,通过使用替代分析方法分析欧洲药典中的标准品,可能可以在可比性研究中获得有关APPCs的有效可比性信息。
可比性研究最困难方面之一就是为等效边界赋值,通常会结合科学知识和统计专业知识来确定合适的值。该接受标准在研究实施之前定义,并证明其合理性,符合预先定义的等效边界表明可以使用替代分析方法代替药典分析方法。
具体统计分析方法和可接受标准,建议参考欧洲药典通则5.27. 替代分析方法的可比性【4】、美国药典(1010)分析数据-解释和处理【5】、(1210)程序验证的统计工具【6】等。
欧洲药典通则5.27. 替代分析方法的可比性有关准确度和精密度综合评价的一个图很有意思,如下:
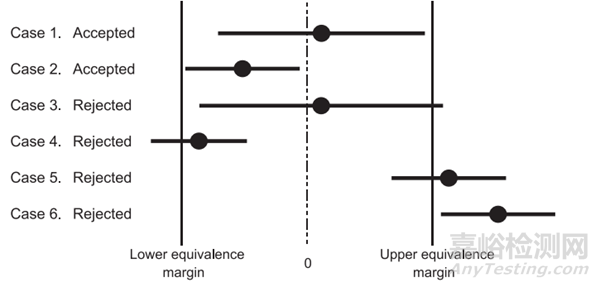
方法性能中的准确度和精密度可以综合评价【4】,准确度高精密度差,结果在允许的范围内如情况1,准确度差精密度好,结果在允许的范围内如情况2,等效性都是可以别接受的。
BP/EP/JP/USP之间的相互替代
主要国家或地区(欧美日)通过药典讨论组(PDG)对药典大量内容成功完成了协调工作。经过协调后的内容,可以视作与本国或本地区药典具有可比性,仅需要参考美国药典(1226)药典分析方法的确认【7】、欧洲药典5.26 药典分析方法【8】的实施进行确认即可。相关要求在各国药典凡例均有相应说明,如:
欧洲药典凡例规定,某些一般章节包含了与《日本药典》和/或《美国药典》一致的相关文本、以及这些文本可互换的说明。这意味着如果使用这些药典中的一种可互换方法发现某物质或制剂符合要求,则该物质或制剂符合《欧洲药典》的要求。如有疑问或争议,仅《欧洲药典》文本具有权威性。
美国药典和日本药典凡例也有类似的规定。
但各国药典中的大部分分析方法依然存在差异,申请人同时在多个国家注册,如果分别执行不同药典比较麻烦和浪费,必然会出现药典间方法替代。
药典间分析方法替代具有替代分析方法的共性特点,但鉴于纳入主流药典的方法比较准确、可靠,监管部门相应的也会比较放心。
如CDER就专门出台了一个政策和程序手册,编号为MAPP 5310.7 Rev. 1,目的是为药品审评中心(OPQ)的审评员提供关于在INDs、NDAs和ANDAs申请的化学、制造和控制(CMC)审评过程中,使用替代药典(即英国药典(BP)、欧洲药典(EP)和日本药典(JP))中辅料、原料药和制剂的适用质量标准提出明确指导。
如果BP、EP或JP中的质量标准相当于或优于相应的USP/NF标准,那么接受申请人提议使用BP、EP或JP中的质量标准作为药物申请中辅料、药物成分或药物产品规格的一部分是合理的。等效标准具有相同的接受标准,并使用基于相似原理(例如,色谱、光谱、滴定)的分析方法和性能特征(例如,特异性、准确性、精密度)。一个标准可能因为多种原因被认为比相应的标准更好,包括接受标准的更窄范围或分析方法的更优性能(例如,提高的特异性、更大的准确性)。
尽管USP/NF的通则中的规定(即测试、分析方法和接受标准)仅在USP/NF中有被测试的辅料、药物成分或药物产品的专著时才适用;如果适当,这些规定在没有专著的情况下也可以被接受。在这种情况下,如果申请人提议使用BP、EP或JP中的分析方法代替USP/NF通则中的相应分析方法,该方法被视为替代分析方法,并且可以使用,前提是它相当于或优于USP/NF中的相应分析方法。在这种情况下,只有在认为适合审查的产品时,才应接受BP、EP或JP专著中的接受标准。
当然,申请人有责任证明在申请中使用BP、EP或JP的标准代替USP/NF标准是合理的。申请人还应提供所引用的BP、EP或JP各论或分析方法的副本,并声明承认相应的USP/NF专著为官方标准或相应的分析方法为监管分析程序。【9】
故而,建议优先从BP/EP/JP/USP中选择替代分析方法。
参考文献
1、USP,GENERAL NOTICES ANDREQUIREMENTS,6. TESTING PRACTICES ANDPROCEDURES,6.30. Alternative and Harmonized Methods and Procedures
2、EDQM,PA/PH/CEP (23) 21,New requirements for the content of the CEP dossier for chemical purity and for herbal drugs/herbal drug preparations according to the CEP 2.0
3、Ph. Eur.,1. GENERAL NOTICES,1.1.2.5 Alternative analytical procedures
4、Ph. Eur.,5.27. COMPARABILITY OF ALTERNATIVE ANALYTICAL PROCEDURES
5、USP,(1010) ANALYTICAL DATA—INTERPRETATION AND TREATMENT
6、USP,(1210) STATISTICAL TOOLS FOR PROCEDURE VALIDATION
7、USP,(1226) VERIFICATION OF COMPENDIAL PROCEDURES
8、Ph. Eur.,5.26. IMPLEMENTATION OF PHARMACOPOEIAL PROCEDURES
9、CDER,MAPP 5310.7 Rev. 1,Acceptability of Standards from Alternative Compendia (BP/EP/JP)

来源:注册圈


